移液枪头式固相微萃取-高效液相色谱法测定细胞培养液中的4种生物碱
王娜妮, 寿 旦,2, 王绪平, 朱 岩(. 浙江省中医药研究院中药研究中心, 浙江 杭州 30007; 2. 浙江大学化学系, 浙江 杭州 30007)
邹汉法研究员纪念专辑(下)·研究论文
移液枪头式固相微萃取-高效液相色谱法测定细胞培养液中的4种生物碱
王娜妮1, 寿 旦1,2, 王绪平1, 朱 岩2*
(1. 浙江省中医药研究院中药研究中心, 浙江 杭州 310007; 2. 浙江大学化学系, 浙江 杭州 310007)
建立了移液枪头式固相微萃取(SPME)-高效液相色谱检测细胞培养液中4种生物碱(黄柏碱、药根碱、巴马丁和小檗碱)的分析方法。以甲基丙烯酸为反应单体、乙二醇二甲基丙烯酸酯为交联剂、偶氮二异丁腈为引发剂,在移液枪头内进行原位聚合反应,制备含有弱阳离子交换整体固定相的SPME枪头。样品经SPME净化后,用高效液相色谱-紫外检测法进行分析,流动相为乙腈-磷酸二氢钾溶液(0.05 mol/L, pH 4),紫外检测波长为270 nm,外标法定量。4种生物碱的检出限(S/N=3)为0.16~0.39 μg/L;以空白细胞培养液进行加标回收率试验,加标回收率为92.73%~97.91%,相对标准偏差(RSD)为0.14%~3.31%。该方法简单、灵敏、准确,能够用于细胞培养液中微量生物碱的分析研究。
高效液相色谱;固相微萃取;整体柱;生物碱;黄柏
黄柏为常用中药,始载于《神农本草经》,原名“檗木”,具有清热燥湿、泻火除蒸、解毒疗疮的功效[1]。黄柏的主要药效成分为生物碱[2],包括黄柏碱、药根碱、巴马丁和小檗碱,临床上常用于降血压、抗心律失常、抗血小板聚集、降血糖、逆转肿瘤耐药性、抗氧化等[3,4]。
细胞药理实验是研究中药药效物质的重要手段,因此研究细胞培养液中有效成分的变化,能够为明确中药的药效、物质基础及作用机制提供理论依据[5]。而细胞培养液的分析存在样品基质复杂和有效成分含量低等问题[6],需采取适当的分离、净化、富集等样品前处理技术,以增加检测的灵敏度和准确度,同时降低对整个检测系统的污染。
固相萃取技术是目前应用较为广泛的一种样品前处理技术[7],已应用于环境、化工、食品等多个领域[8]。采用固相萃取柱进行萃取时,因其柱体积大、样品用量多,难以用于血液、细胞培养液、组织液等微量生物样品的分析,从而限制了该技术的应用[9]。因此,固相萃取的微型化已成为该领域的研究热点[10]。移液枪头在实验室中应用广泛,可通过内置固相萃取吸附剂,同时实现采样、定量、净化和富集,弥补传统生物样品前处理方法操作复杂、有机溶剂用量大、目标物易损失等技术缺陷[11,12]。本文通过原位聚合法将聚(甲基丙烯酸-乙二醇二甲基丙烯酸酯)整体固定相内置于移液枪头内,制成具有弱阳离子交换基团的固相微萃取(SPME)装置,用于微量细胞培养液的前处理和生物碱的富集,为进一步开展药效筛选和药理实验、科学合理地利用药用植物资源提供技术手段和科学依据。
1 实验部分
1.1 仪器、试剂与材料
Ultimate 3000高效液相色谱(HPLC)仪、Orion 3-Star pH计、311型二氧化碳细胞培养箱、Reacti-ThermTS-18823氮吹仪(赛默飞世尔科技(中国)有限公司); DK-S24电热恒温水浴锅(上海精宏实验设备有限公司); KQ-400DB数控超声波清洗器(昆山市超声仪器有限公司); DHG-9070A电热恒温鼓风干燥箱(上海精宏实验设备有限公司); DJ-10A倾倒式粉碎机(上海淀久中药机械制造有限公司); YJ-40L超纯水机(杭州亚洁环保设备有限公司)。
黄柏碱(批次11062401)、药根碱(批次15050712)、巴马丁(批次16022614)和小檗碱对照品(批次15010411)均购自北京恒元启天化工技术研究院,纯度>98%。乙二醇二甲基丙烯酸酯(纯度>97%)、甲基丙烯酸(纯度>95%)均购自日本东京化成工业株式会社;异丙醇、1,4-丁二醇、偶氮二异丁腈、无水乙醇、磷酸二氢钾、甲醇(分析纯)均购自国药集团化学试剂有限公司;乙腈(色谱纯)购自上海阿拉丁试剂有限公司;DMEM高糖细胞培养液购自吉诺生物医药技术有限公司。本实验用水均为二次去离子水(18.2 MΩ5cm)。
1.2 整体柱的制备
采用原位聚合法制备聚(甲基丙烯酸-乙二醇二甲基丙烯酸酯)整体柱[13]。分别称取0.9 mL甲基丙烯酸(单体)、0.3 mL乙二醇二甲基丙烯酸酯(交联剂)、1.8 mL三元致孔剂(包括1.05 mL异丙醇、0.6 mL 1,4-丁二醇和0.15 mL去离子水)、5.0 mg偶氮二异丁腈(引发剂)于10 mL烧杯中,于冰浴中超声10 min,混匀,形成反应混合液。将500 μL反应混合液用移液枪迅速吸入经甲醇清洗过的2 mL移液枪头中,用硅胶垫密封,于60 ℃烘箱中聚合反应24 h后,用无水乙醇和去离子水反复冲洗。
1.3 样品前处理
1.3.1黄柏提取物的制备
采用热水提取法制备黄柏提取物。将黄柏药材干燥后粉碎,称取50.0 g黄柏粉末于3 000 mL圆底烧瓶中,加入1 000 mL水,回流提取2 h,共3次,合并提取液,减压蒸馏至干,得到黄褐色固体状的黄柏提取物,于4 ℃冷藏保存。称取100 mg黄柏提取物,用细胞培养液溶解后,过0.22 μm滤膜,其生药含量为0.50 g/L。

图1 固相微萃取流程示意图Fig. 1 Schematic diagram of the extraction procedure
1.3.2固相微萃取
固相微萃取的整个过程均通过移液枪吸取溶液或样品(流程见图1)。 具体步骤,①活化整体柱:分别吸取1.0 mL甲醇和0.5 mL水冲洗整体柱;②取样:吸入1.0 mL标准溶液或细胞培养液,经8 min后排出;③净化:吸取1.0 mL水后立即排出;④洗脱:吸取1.0 mL氨水-甲醇混合溶液(18∶82, v/v),经10 min后排出;⑤浓缩:收集洗脱液,氮气吹干后,用100 μL乙腈-磷酸二氢钾溶液(0.05 mol/L, pH 4)(90∶10, v/v)溶解,待HPLC分析。
1.3.3细胞培养与给药
采用成骨细胞进行实验。细胞培养过程[14]:将新生乳鼠置于75%(v/v)乙醇溶液中浸泡10 min,切下颅盖骨于无钙、镁离子的平衡盐溶液(D-Hanks液)内,清除骨膜、血管等结缔组织,用D-Hanks液洗净颅盖骨,剪成1 mm×1 mm大小的骨片,置于0.25%(质量分数)胰蛋白酶溶液,消化30 min,加入含10%(质量分数)胎牛血清(FBS)的完全培养基终止消化,将消化后的颅盖骨片移入0.1%(质量分数)Ⅱ型胶原酶溶液中振荡30 min后,以1 000 r/min离心10 min,吸去上清液,沉淀的细胞团块用培养液吹打成细胞悬液,接种于培养瓶,于37 ℃ 含有5%(v/v)CO2的培养箱中培养,每2~3 d换液1次,直至80%的细胞融合,然后对细胞进行传代培养。在接种6 d的成骨细胞中加入1.5 mL 0.25%(质量分数)胰酶,消化5 min,加入等体积FBS培养基与胰酶,以1 000 r/min离心5 min,收集沉淀,用培养液吹打成为合适浓度细胞液后,接种于96孔板中,培养24 h后,加入黄柏提取物溶液,采集5 h、24 h的细胞培养液样品,经0.22 μm滤膜过滤,待SPME净化和色谱分析。
1.4 色谱条件
色谱柱为Diamonsil C18柱(150 mm×4.6 mm, 5 μm);柱温为30 ℃;流动相为(A)乙腈-(B)磷酸二氢钾溶液(0.05 mol/L, pH 4);流速为1.0 mL/min。梯度洗脱条件:0~10 min, 90%B~80%B; 10~50 min, 80%B。进样量为20 μL;紫外检测波长为270 nm。
1.5 标准溶液的配制
用乙腈-磷酸二氢钾(0.05 mol/L, pH 4)(90∶10, v/v)混合溶液配制质量浓度为50、100、200、300、500、700、1 000 μg/L的黄柏碱系列标准溶液;配制质量浓度为5、10、50、100、200、300、500 μg/L的药根碱和巴马丁系列标准溶液;配制质量浓度为100、200、500、1 000、1 500、2 000、3 000 μg/L的小檗碱系列标准溶液。
2 结果与讨论
2.1 整体柱的形态表征
整体柱为连续多孔结构,其比表面积对分离能力有很大影响。为保证整体柱具有良好分离效果的同时还能具备较低的系统压力,需选择合适的致孔剂来控制整体柱的孔隙结构。本实验选择了三元致孔剂系统(异丙醇、1,4-丁二醇和水)。致孔剂在甲基丙烯酸和乙二醇二甲基丙烯酸酯混合物中具有良好的溶解性,能够产生合理的孔隙结构,使柱体的柱压较低,有利于后续的固相微萃取[15]。用扫描电子显微镜对材料的表观结构形态进行表征(见图2),可以看出,该整体柱具有规则的三维网络骨架结构,空隙分布均匀,其中微米级大孔保证了整体柱具有良好的通透性,颗粒表面的纳米级小孔有助于目标成分的有效分离。

图2 移液枪头内置整体固定相的扫描电镜图Fig. 2 Scanning electron microscope photographs of monolithic stationary phase in the pipette tips
2.2 整体柱制备过程的优化
整体柱在制备过程中采用了甲基丙烯酸作为功能单体,因此材料表面具有丰富的羧酸基团,使该固相萃取材料具有亲水作用、氢键作用和离子交换作用,其与极性化合物间的结合能力较强、生物碱在萃取材料和分配介质间的分配系数较大,可达到良好的萃取效果。
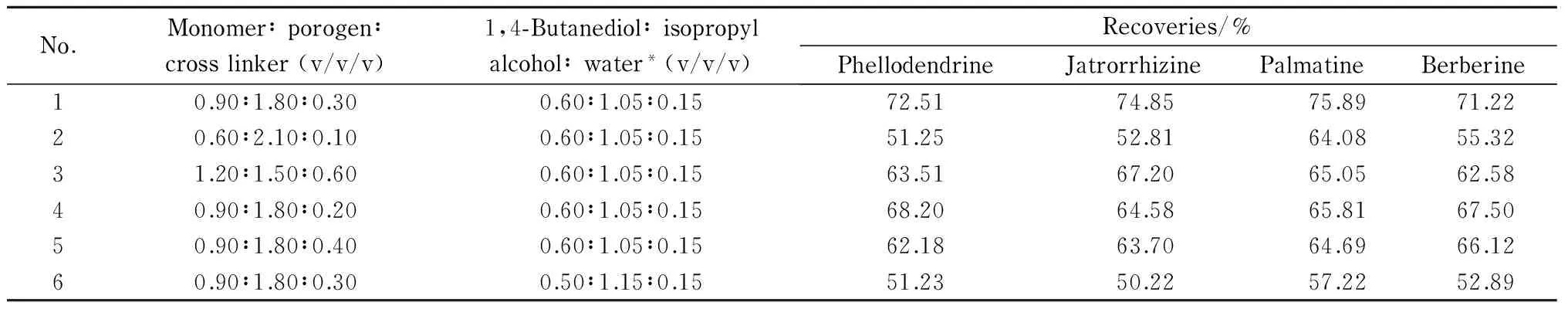
表1 整体柱的制备条件对萃取效率的影响Table 1 Effect of preparation conditions of the monolithic columns on the extraction efficiencies
* Porogens.
本文以黄柏碱、药根碱、巴马丁和小檗碱为目标物质,考察了系列整体柱的富集效果,并优化了整体柱的制备条件。结果表明,单体、致孔剂、交联剂间的配比对4种生物碱的萃取效率均有影响。当单体、致孔剂、交联剂的体积比为0.90∶1.80∶0.30,三元致孔剂1,4-丁二醇、异丙醇、水的体积比为0.60∶1.05∶0.15时,4种生物碱的萃取效率最好(见表1)。
在最优条件下制备的整体柱具有良好的吸附性能,对黄柏碱、药根碱、巴马丁和小檗碱的吸附容量分别为0.13、0.15、0.12和0.16 mg/g,能够满足细胞培养液中样品的检测需求。由于不同厂家生产的枪头在材质上有一定差别,本文分别考察了5种不同厂家生产的枪头所制备的整体柱对目标生物碱吸附性能的影响。结果表明,其吸附性能未发现显著性差异。这可能是因为吸附材料与移液枪头内壁没有发生化学反应,枪头材质对整体柱的制备没有影响。
2.3 萃取条件的优化
2.3.1萃取时间的选择
萃取时间是影响SPME的一个重要因素。本实验考察了不同的萃取时间(2、4、6、8、10、12 min)对4种生物碱回收率的影响(见图3)。结果表明,当萃取时间为8 min时,4种生物碱基本趋于饱和,萃取量较大。综合考虑灵敏度和分析速度,最终将萃取时间设为8 min。
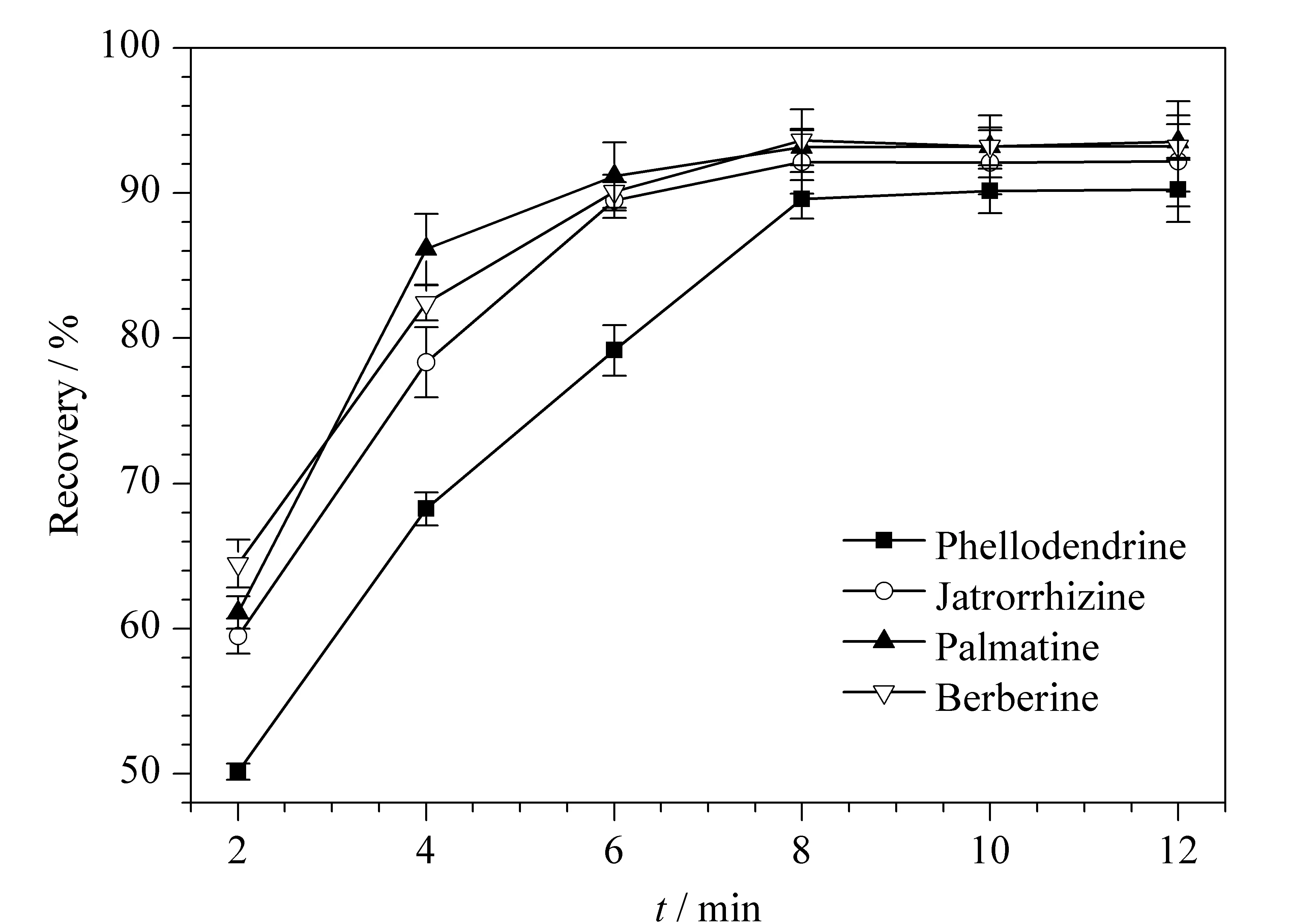
图3 萃取时间对4种生物碱回收率的影响(n=3)Fig. 3 Effect of the extraction time on the extraction recoveries of the four alkaloids (n=3)
2.3.2洗脱溶液中氨水含量的选择
本实验分别考察了氨水甲醇溶液作为洗脱溶剂时,不同含量(2%、6%、10%、14%、18%、22%, v/v)的氨水对4种生物碱回收率的影响(见图4)。结果表明,当采用2%(v/v)氨水甲醇洗脱时,4种生物碱的回收率较低;当采用18%(v/v)氨水甲醇洗脱时,4种生物碱可完全洗脱。因此本实验最终选择18%(v/v)氨水甲醇作为洗脱溶液。

图4 洗脱溶液中氨水的体积分数对4种生物碱回收率的影响(n=3)Fig. 4 Effect of the volume percentage of ammoniaon the extraction recoveries of the four alkaloids (n=3)
2.3.3洗脱时间的选择
聚合物整体柱有规则的空隙结构和较大的比表面积,可以加速目标成分的洗脱。移液枪吸取样品进入SPME枪头,经过一定洗脱时间后,再排出枪头。本实验考察了洗脱时间(2、4、6、8、10、12 min)对4种生物碱回收率的影响(见图5)。结果表明,随着洗脱时间的增加,4种生物碱的回收率逐渐增大,当洗脱时间为10 min时,4种生物碱的回收率已较高。综合考虑分析速度和萃取效率,本文最终确定洗脱时间为10 min。
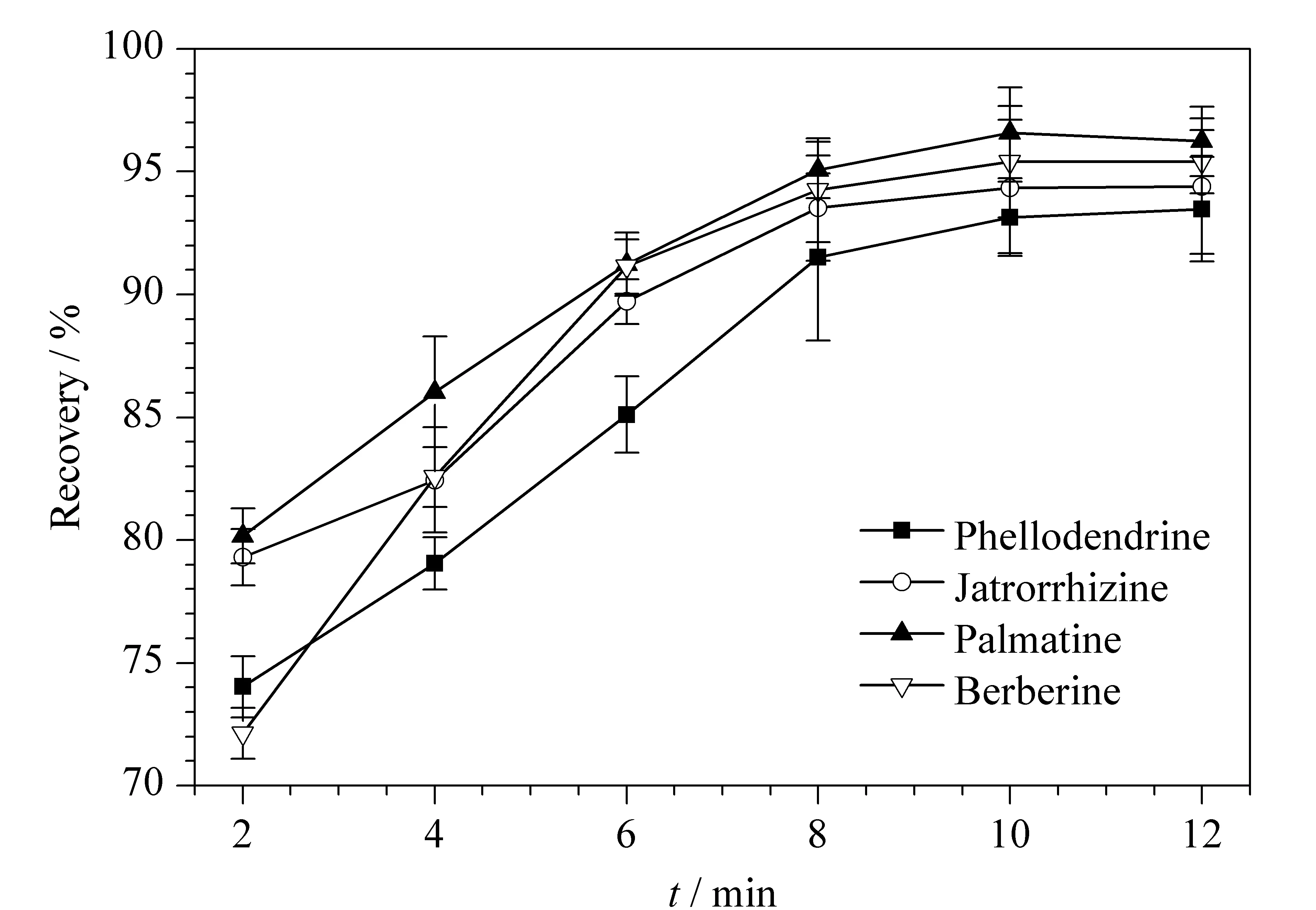
图5 洗脱时间对4种生物碱回收率的影响(n=3)Fig. 5 Effect of elution time on the extraction recoveries of the four alkaloids (n=3)
2.4 线性关系和检出限
本文采用外标法对4种生物碱进行定量分析。按1.5节所述配制系列标准溶液,以各组分的峰面积(y)为纵坐标,质量浓度(x, μg/L)为横坐标进行线性回归,4种生物碱在其线性范围内线性关系良好,相关系数(r)为0.999 3~0.999 6(见表2)。取10份空白样品,添加一定质量浓度的标准溶液,计算各化合物的检出限(LOD,S/N=3),结果为0.16~0.39 μg/L。

表2 4种生物碱的线性范围、校准曲线、相关系数(r)和检出限Table 2 Linear ranges, calibration curves, correlationcoefficients (r) and limits of detection of the four alkaloids
y: peak area;x: mass concentration, μg/L.
2.5 回收率和精密度
向空白细胞培养液中添加含4种生物碱的标准溶液,进行空白加标回收率试验,在各自的添加水平下进行6次平行试验,4种生物碱的加标回收率为92.73%~97.91%,相对标准偏差(RSD)为0.14%~3.31%(见表3)。结果表明,该方法的回收率及精密度均满足定量检测的要求。

表3 细胞培养液中4种生物碱的加标回收率和相对标准偏差(n=6)Table 3 Recoveries and RSDs of the four alkaloids in spiked cell culture fluids (n=6)
2.6 样品分析
将成骨细胞用黄柏提取物处理5 h和24 h后进行测定,其中,4种生物碱的含量见表4,处理5 h的细胞培养液的色谱图见图6。可以看出,随着时间的增加,4种生物碱的含量逐渐降低。
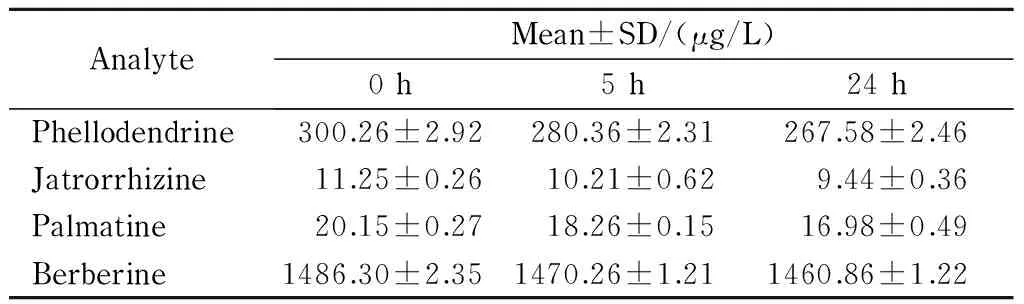
表4 细胞培养液中的4种生物碱的含量(n=3)Table 4 Contents of the four alkaloids in cell culture fluids (n=3)
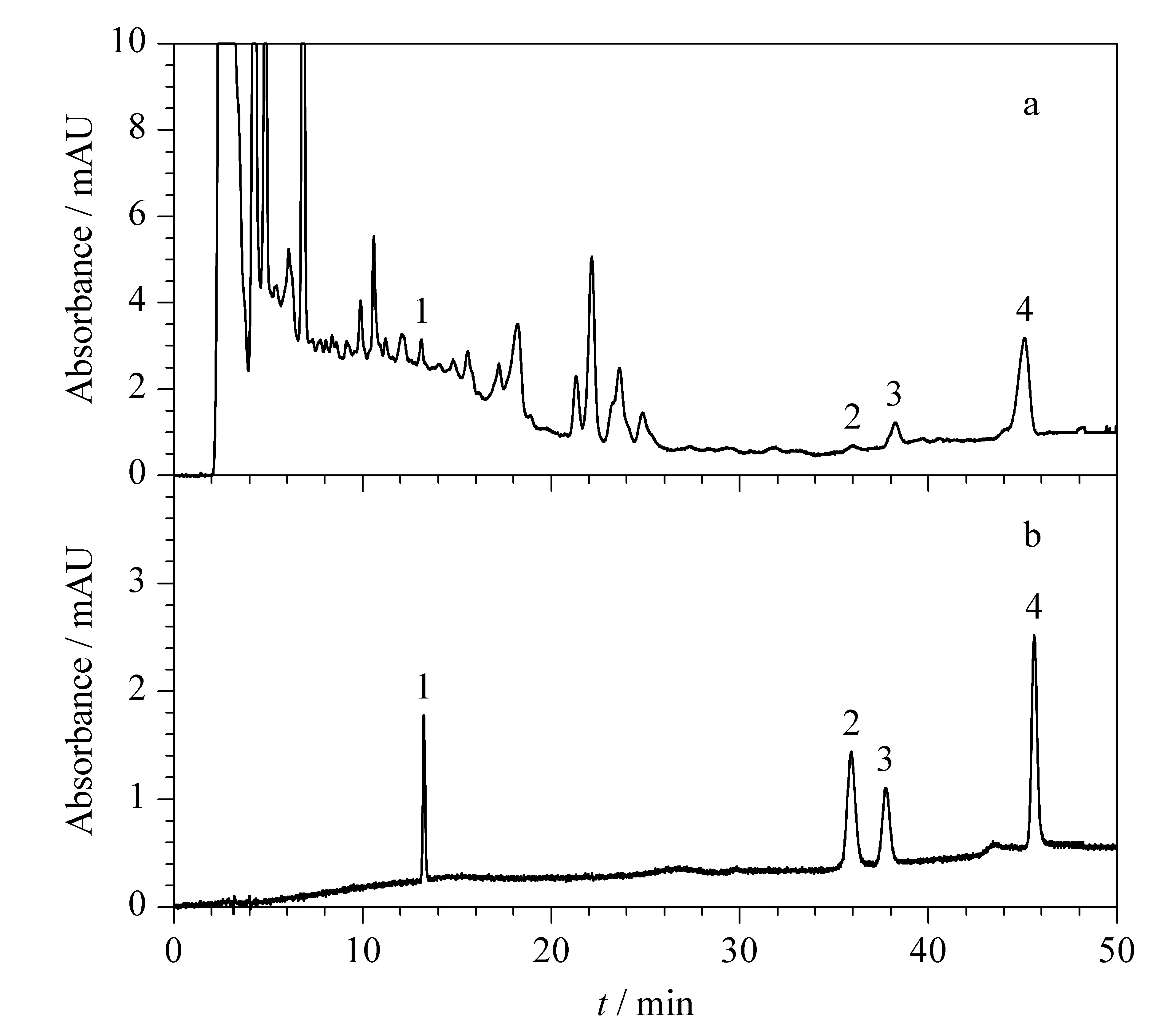
图6 细胞培养液和标准溶液的色谱图Fig. 6 Chromatograms of (a) a cell culture fluid and (b) a standard solution a. the cell culture fluid for 5 h; b. the standard solution, containing 400 μg/L phellodendrine, 50 μg/L jatrorrhizine, 20 μg/L palmatine, 1200 μg/L berberine.1. phellodendrine; 2. jatrorrhizine; 3. palmatine; 4. berberine.
3 结论
本文制备了含有弱阳离子交换整体柱的SPME枪头,建立了高效液相色谱-紫外检测细胞培养液中黄柏碱、药根碱、巴马丁和小檗碱的分析方法。该方法净化效果好、操作简单、实用性强,对中药药效物质的研究具有重要的参考意义。
[1] Li F, Jia Y Z. Clinical Journal of Traditional Chinese Medicine, 2004, 16(2): 191
李峰, 贾彦竹. 中医药临床杂志, 2004, 16(2): 191
[2] Shi H L, Peng S L, Sun J, et al. J Sep Sci, 2014, 37(6): 704
[3] Chen G, Li K K, Fung C H, et al. J Ethnopharmacol, 2014, 154(3): 711
[4] Sun H, Wang H Y, Zhang A H, et al. Pharmacogn Mag, 2016, 12(45): 41
[5] Quanson J L, Stander M A, Pretorius E, et al. J Chromatogr B, 2016, 1031: 131
[6] Bourgogne E, Grivet C, Varesio E, et al. J Pharmaceut Biomed, 2015, 102(5): 290
[7] Wei Z, Sandron S, Townsend A T, et al. Talanta, 2015, 135: 155
[8] Rigi M R, Farahbakhsh M, Rezaei K. J Brazil Chem Soc, 2015, 26(1): 156
[9] Zhang L Y, Cao B C, Yao D, et al. J Sep Sci, 2015, 38(10): 1733
[10] Miró M. TrAC-Trends Anal Chem, 2014, 62: 154
[11] Wang N N, Huang X W, Wang X P, et al. J Chromatogr B, 2015, 990: 64
[12] Wang M Y, Yan H Y, Yuan Y N, et al. Anal Bioanal Chem, 2015, 407(4): 1231
[13] Wang N N, He S W, Zhu Y. Eur Food Res Technol, 2012, 235(4): 685
[14] Li C J, Cheng P, Liang M K, et al. J Clin Invest, 2015, 125(4): 1509
[15] Wang N N, He S W, Yan W W, et al. J Appl Polym Sci, 2013, 128(1): 741
Determination of four alkaloids in cell culture fluidsby pipette tip solid phase microextraction-highperformance liquid chromatography
WANG Nani1, SHOU Dan1,2, WANG Xuping1, ZHU Yan2*
(1.DepartmentofMedicine,ZhejiangAcademyofTraditionalChineseMedicine,Hangzhou310007,China; 2.DepartmentofChemistry,ZhejiangUniversity,Hangzhou310007,China)
A method for the determination of four alkaloids (phellodendrine, jatrorrhizine, palmatine, berberine) in cell culture fluids was developed by pipette tip solid phase microextraction (SPME) and high performance liquid chromatography (HPLC). A weak cation exchange monolithic stationary phase was prepared by in-situ polymerization in a pipette tip. Methacrylate acid, ethylene dimethacrylate and azodiisobutyronitrile were the functional monomer, the cross-linker and the initiator, respectively. The samples were cleaned-up using the microextraction tips. Phellodendrine, jatrorrhizine, palmatine and berberine were extracted from cell culture fluids. The analytes were separated on a reversed-phase Diamonsil C18 column (150 mm×4.6 mm, 5 μm) and eluted gradiently with acetonitrile and 0.05 mol/L potassium dihydrogen phosphate solution. The detection wavelength was 270 nm. The extraction performance was investigated by varying the elution solution types, the extraction and elution time and the molar ratios among monomers, cross-linkers and porogens. The analytes were quantified using external standard method. The established method was successfully applied for the pretreatment and determination of four alkaloids fromCortexPhellodendriin cell culture fluids. Under the optimal conditions, the limits of detection (S/N=3) for the analytes were 0.16-0.39 μg/L. The recoveries were in the range of 92.73%-97.91% and the relative standard deviations (RSDs) were ranged from 0.14% to 3.31% (n=6). The method is simple, sensitive and accurate. It can be used in the determination of alkaloids in cell culture fluids.
high performance liquid chromatography (HPLC); solid phase microextraction (SPME); monolithic columns; alkaloid;CortexPhellodendri
10.3724/SP.J.1123.2016.08001
2016-08-05
国家自然科学基金(81603252);浙江省自然科学基金(LQ17H280002);浙江省中医药科技计划项目(2016ZQ003);浙江省医药卫生科技计划项目(2016RCB003).
Foundation item: National Natural Science Foundation of China (No. 81603252); Zhejiang Provincial Natural Science Foundation of China (No. LQ17H280002); Zhejiang Province Science and Technology of Traditional Chinese Medicine Project (No. 2016ZQ003); Zhejiang Province Science and Technology of Medical and Health Project (No. 2016RCB003).
O658
:A
:1000-8713(2017)01-0014-06
*通讯联系人.Tel:(0571)88273637,E-mail:zhuyan@zju.edu.cn.
- 色谱的其它文章
- 基于高通量解析算法的复杂样品重叠气相色谱-质谱信号的快速分析
- 整体柱在线固相微萃取-高效液相色谱法分析爽肤水中痕量雌激素
- 化学衍生辅助液相色谱-串联质谱测定枇杷膏中的齐墩果酸和熊果酸
- Holistic analysis of Liuwei Dihuang pills using ultrasoniccell grinder extraction and ultra-performanceliquid chromatography
- Investigation of aromatic impurities in liquefied petroleumgas by solid-phase extraction sampling coupled withgas chromatography-mass spectrometry
- Quantification of intracellular adenosine 5′-triphosphateand its metabolites by high performance liquidchromatography analysis

