整体柱在线固相微萃取-高效液相色谱法分析爽肤水中痕量雌激素
宋雯雯, 罗夏琳, 李攻科, 胡玉斐(中山大学化学学院, 广东 广州 510275)
邹汉法研究员纪念专辑(下)·研究论文
整体柱在线固相微萃取-高效液相色谱法分析爽肤水中痕量雌激素
宋雯雯, 罗夏琳, 李攻科*, 胡玉斐*
(中山大学化学学院, 广东 广州 510275)
以甲基丙烯酸缩水甘油酯(GMA)为功能单体、乙二醇二甲基丙烯酸酯(EDMA)为交联剂,偶氮二异丁腈(AIBN)为引发剂、甲醇及正己烷(14∶5, v/v)为二元致孔剂,通过原位聚合反应制备了聚甲基丙烯酸缩水甘油酯(Poly(GMA-co-EDMA))毛细管整体柱。研究表明,制备的Poly(GMA-co-EDMA)整体柱具有良好的通透性和较低的柱压(1.5×106Pa,冲洗流速0.5 mL/min)。该整体柱对雌二醇、炔雌醇、雌酮和己烯雌酚的富集倍数分别为86、116、77和86。构建了整体柱在线微萃取接口装置,建立了整体柱在线固相微萃取-高效液相色谱(HPLC)测定爽肤水中痕量雌二醇、炔雌醇、雌酮和己烯雌酚的分析方法。该分析方法的检出限(S/N=3)为0.05~0.20 μg/L。将方法应用于爽肤水中雌激素的检测,加标回收率为69.3%~111.3%, RSD<5.0%。所建立的方法简单、快速、灵敏、准确,可满足爽肤水中痕量雌激素的分析。
高效液相色谱;聚甲基丙烯酸缩水甘油酯整体柱;在线固相微萃取;雌激素;爽肤水
近年来,化妆品的安全问题引起了人们的广泛关注[1,2]。我国化妆品卫生规范(2007版)[3]列出了1 208种禁用物质,其中明确指出了性激素。雌激素是性激素的一种,是一类生物活性广泛的类固醇化合物[4],具有促进、维持女性生殖器官和第二性征的生理作用,同时对内分泌系统、肌体代谢、骨骼生长等有显著影响[5]。长期服用添加雌激素的食品或使用含雌激素的化妆品会引起体内雌激素水平的增高[6],从而引发人体新陈代谢紊乱甚至癌症[7,8]。因此,对化妆品中雌激素的分析、检测具有重要意义。 目前,常用的分离介质有填充柱[9]、开管柱[10]和整体柱[11]等。填充柱的填充步骤相对复杂,制备过程中固定相易受外界条件的影响(如高温烧结可能会破坏键合固定相)[12];开管柱的制备过程简单、柱效高[13],但其柱容量低、相比小[14]。整体柱材料作为萃取介质在复杂样品的前处理,尤其是小分子的分离分析方面具有广泛的应用[15]。通过原位聚合反应的整体柱具有制备方法简单、重复性好、柱压低等优点。聚甲基丙烯酸酯类整体柱稳定性高、适用范围宽且材料表面易改性,故本实验以甲基丙烯酸缩水甘油酯(GMA)为功能单体、乙二醇二甲基丙烯酸酯(EDMA)为交联剂,偶氮二异丁腈(AIBN)为引发剂,在毛细管中通过原位反应制备了整体柱。
雌激素样品的前处理方法主要包括传统的液液萃取法[16]、固相萃取法[17]和液相微萃取法[18]等。李晶瑞等[16]采用甲醇提取、超高效液相色谱-串联质谱法同时测定化妆品中的15种雌激素,方法准确、灵敏,但溶剂消耗量大;Wang等[18]采用中空纤维液相微萃取法萃取了牛奶中的雌激素,方法操作简单、成本低且环境友好,但耗时长。采用整体柱在线微萃取法与HPLC联用可以有效避免复杂基质的干扰、富集倍数高、重现性好,分析效率高[19],且溶剂消耗量小,是一种高效、环境友好的萃取方法[20]。
本文采用在毛细管内引发原位聚合反应的方式制备了聚甲基丙烯酸缩水甘油酯(Poly(GMA-co-EDMA))整体柱,并将其与HPLC联用,搭建了在线固相微萃取-HPLC联用装置,实现了爽肤水中痕量17β-雌二醇(17β-estradiol,E2)、炔雌醇(ethynyl estradiol,EE)、雌酮(estrone,E1)和己烯雌酚(diethylstilbestrol,DES)的在线分析。该方法简单、快速、灵敏、准确且环境友好。
1 实验部分
1.1 仪器与试剂
LC-10AVP高效液相色谱仪(包括CLASS-VP工作站、SPD-10AVP紫外检测器)、AVATAR-330傅里叶变换红外光谱(FT-IR)仪(日本岛津公司); Quanta 400F热场发射环境扫描电镜-能谱-电子背散射衍射系统(荷兰FEI/OXFORD/HKL公司);石英毛细管(内径0.53 mm)(河北省永年县锐沣色谱器件有限公司)。
EDMA购自广州市千湖贸易有限公司;正己烷、聚乙二醇-400(PEG-400)、1,4-丁二醇、正丙醇均购自广州化学试剂厂;AIBN购自天津市福晨化学试剂厂;GMA(纯度97%)购自上海麦克林试剂公司;E2(纯度>99%)、EE(纯度≥98%)、E1(纯度>98%)标准品购自阿拉丁试剂(上海)有限公司;DES(纯度>98%)标准品购自中国药品生物制品检定所;γ-(甲基丙烯酰氧基)丙基三甲氧基硅烷(KH-570)购自北京市申达精细化工有限公司;乙腈、甲醇(色谱纯)购自美国Dikma公司。所有实验用水均为超纯水(美国Millipore公司),其余试剂均为分析纯。
标准溶液的配制:称取适量雌激素标准品,用甲醇配制成合适质量浓度的标准溶液;用超纯水稀释成所需质量浓度的标准工作液。
1.2 整体柱的制备
将石英毛细管用甲醇洗净,烘干,注入1 mol/L氢氧化钠溶液,浸泡2 h后,用清水洗净,再注入1 mol/L盐酸溶液,浸泡2 h后,用甲醇以0.1 mL/min的流速清洗,于150 ℃烘箱烘2 h,然后将KH570-甲醇混合物(1∶1, v/v)注入毛细管柱中,于室温下反应4 h,然后用甲醇清洗,氮气吹干后,硅胶封口,保存备用。
准确称取4.0 mg AIBN、168 μL GMA、200 μL EDMA、700 μL甲醇和250 μL正己烷于色谱样品瓶中,超声20 min,混匀,制成聚合反应液,将其注入预处理过的石英毛细管中,用硅胶密封,于65 ℃反应10 h。待反应完成后,将聚合好的整体柱用甲醇以0.1 mL/min的流速冲洗,除去残余的单体和致孔剂。制备反应的方程式见图1。
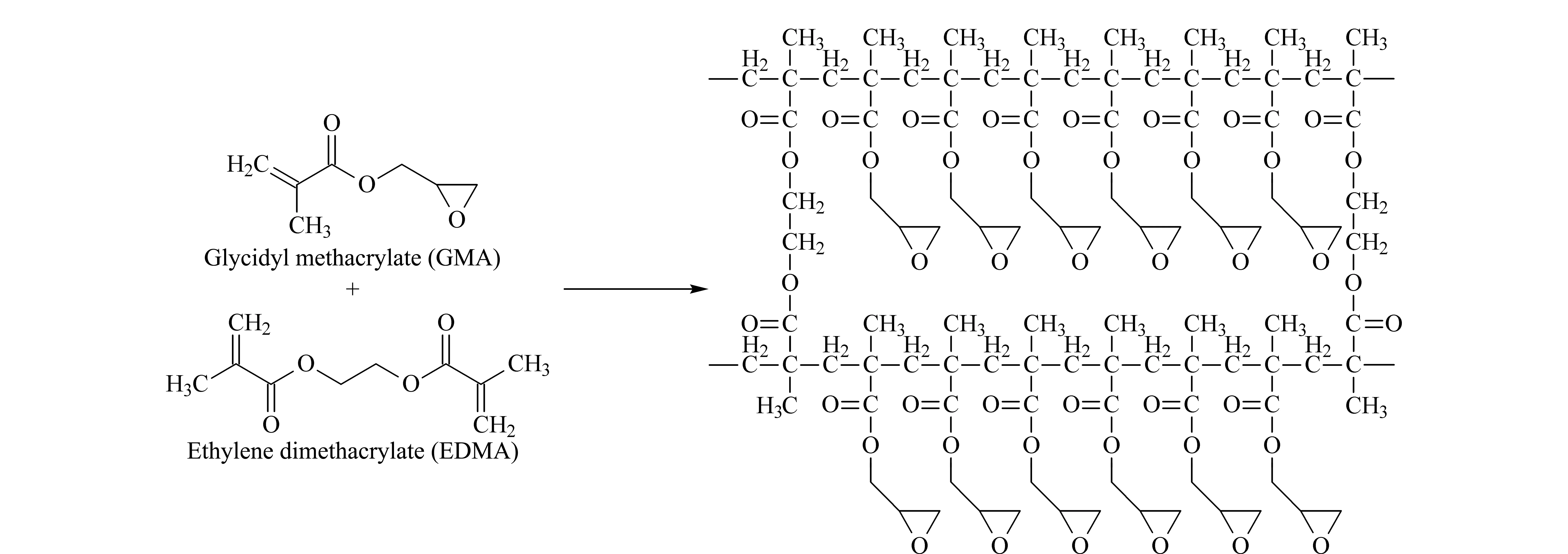
图1 Poly(GMA-co-EDMA)整体柱的制备过程Fig. 1 Preparation process of the Poly(GMA-co-EDMA) monolithic column
1.3 在线固相微萃取
将长为12.7 cm的Poly(GMA-co-EDMA)整体柱作为萃取单元,通过聚醚醚酮(PEEK)连接头、PEEK管、不锈钢双通阀、六通阀与高效液相色谱系统构成整体柱在线微萃取分析流路(见图2)。在实验过程中通过2个六通阀的切换来完成平衡、萃取、解吸和进样(见表1)。在线萃取装置中,所接进样环的体积为4 mL,用于载入样品溶液。萃取时携带液经过定量环,推动样品溶液经过萃取单元,完成萃取。萃取条件:萃取溶剂为5%(v/v)乙腈水溶液;萃取流速为0.3 mL/min;萃取体积为3 mL;解吸溶剂为乙腈-水(45∶55, v/v);解吸流速为100 μL/min。
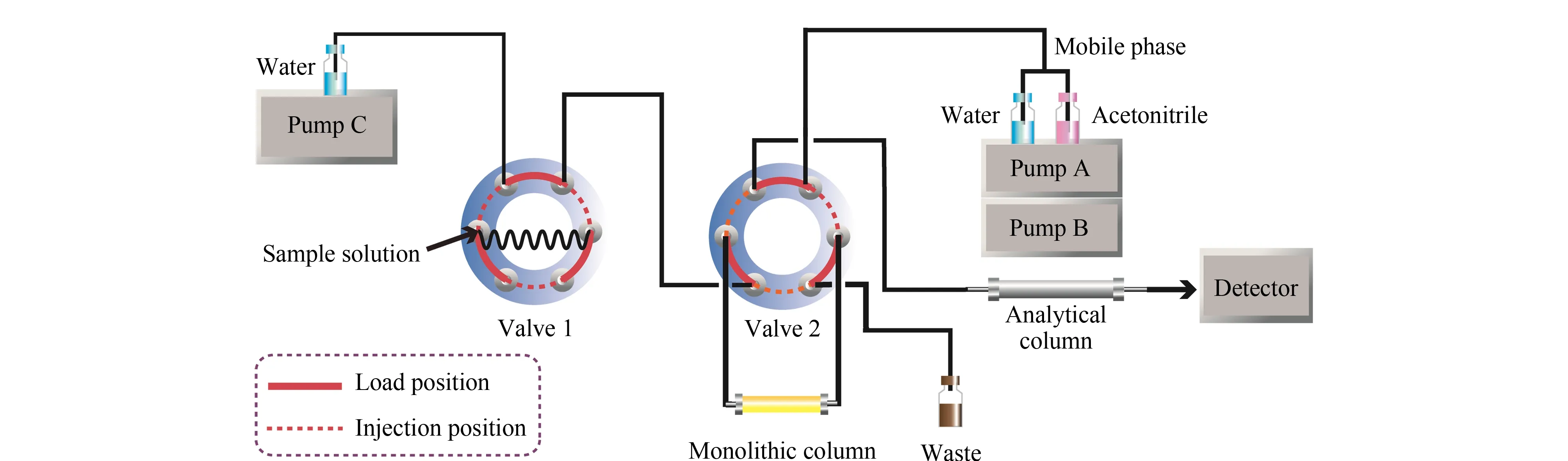
图2 Poly(GMA-co-EDMA)整体柱在线固相微萃取装置图Fig. 2 Schematic diagram of the Poly(GMA-co-EDMA) monolithic column online solid phase microextraction system

表1 在线固相微萃取系统的操作流程Table 1 Operation procedures of online solid phase microextraction system
1.4 色谱条件
色谱柱:Diamonsil C18(250 mm×4.60 mm, 5 μm,北京迪马公司);柱温:30 ℃;流动相:(A)乙腈,(B)水;流速:1.0 mL/min;梯度洗脱程序:0~16 min, 45%A~73%A;紫外检测波长:230 nm。
2 结果与讨论
2.1 致孔剂的选择
本实验控制引发剂用量为单体用量的1%(质量分数),以柱压来表征整体柱的通透性,考察了不同的致孔剂组合(正丙醇和1,4-丁二醇[21]、甲醇和正己烷、正丙醇和PEG-400[22])及其配比对整体柱通透性的影响。研究结果表明,当正丙醇与1,4-丁二醇的质量比为45∶55时,制备的整体柱在甲醇冲洗流速为0.1 mL/min的条件下,柱压为1.5×106Pa;当正丙醇与PEG-400的质量比为47∶53时,整体柱的柱压超过3.0×106Pa(冲洗流速0.1 mL/min),且整体柱中的内容物流出;而当选择甲醇-正己烷(14∶5,v/v)作为致孔剂时,制备的整体柱在较大冲洗流速(0.5 mL/min)下,柱压仅为1.5×106Pa。可能的原因为1,4-丁二醇熔点较高(20.2 ℃),在实验温度(约20 ℃)下仍有部分1,4-丁二醇处于凝固状态,未反应的单体和致孔剂难以被冲出,导致柱压增大;而PEG-400溶液的黏度过高,从而导致柱压过高。故最终选择甲醇和正己烷(14∶5,v/v)作为二元致孔剂,制备Poly(GMA-co-EDMA)整体柱。通常整体柱的柱压会随着流速的增加而增大,选用甲醇和正己烷作致孔剂时,可以有效降低柱压,使整体柱在较高冲洗流速下也可保持良好的通透性。同时将后续优化实验中的萃取流速初步设为0.5 mL/min。
2.2 Poly(GMA-co-EDMA)整体柱的表征
2.2.1热场电镜的表征
由Poly(GMA-co-EDMA)整体柱截面的扫描电镜图可以看出,该整体柱呈现出疏松多孔的结构,保证了其具有较低的柱压且通透性良好(见图3a);聚合物材料紧贴于毛细管内壁,保证了整体柱的稳定性(见图3b);所制备的整体柱具有聚合均一的微球簇(见图3c)。

图3 Poly(GMA-co-EDMA)整体柱的扫描电镜图Fig. 3 Scanning microscope images of the Poly(GMA-co-EDMA) monolithic column Magnification times: a. 2400; b. 2500; c. 30000.
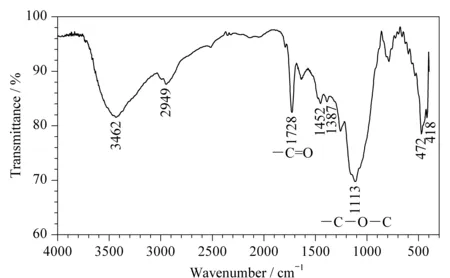
图4 Poly(GMA-co-EDMA)整体柱的红外光谱图Fig. 4 Infrared spectrum of the Poly(GMA-co-EDMA) monolithic column
2.2.2红外光谱的表征
将适量研磨成粉末的干燥无水的整体柱材料与溴化钾(KBr,光谱纯)按质量比1∶200混匀,研磨压片后,在400 ~ 4 000 cm-1范围内对样品进行红外光谱解析(见图4)。可以看出,在1 600 cm-1附近无峰,说明不存在C=C键,且红外光谱图中不存在-CH=CH2的面外弯曲振动峰(895 ~ 885 cm-1);在1 728 cm-1处,出现饱和酯基中羰基的伸缩振动峰,该峰与不饱和酯羰基的峰相比向高波数方向移动。结果表明,GMA中的不饱和酯羰基变成了饱和酯羰基。在1 257 cm-1和1 113 cm-1处的峰分别为C-O-C的反对称和对称伸缩振动峰;在915cm-1和816 cm-1处的峰为环氧基的特征吸收峰。FT-IR表征结果确证了整体材料由GMA聚合而成。
2.3 在线固相微萃取条件的优化
采用单因素优化法考察了在线微萃取过程中萃取溶剂、解吸体积及萃取流速等条件对分析结果的影响。
2.3.1萃取溶剂的选择
在萃取流速(0.5 mL/min)、萃取体积(3 mL)、解吸流速(100 μL/min)、解吸体积(600 μL)和解吸溶剂(45%(v/v)乙腈水溶液)不变的条件下,分别选用纯水和体积分数为5%、10%、20%的乙腈水溶液作为萃取溶剂,对10 μg/L的4种雌激素混合标准溶液进行分析。如图5a所示,随着乙腈体积分数的增加,E2、EE和E1的萃取量逐渐降低;而DES的萃取量随乙腈体积分数的增加先提高后降低,但乙腈体积分数为10%和5%时,其萃取量相差不大。因此本实验最终选择5%(v/v)的乙腈水溶液作为萃取溶剂。
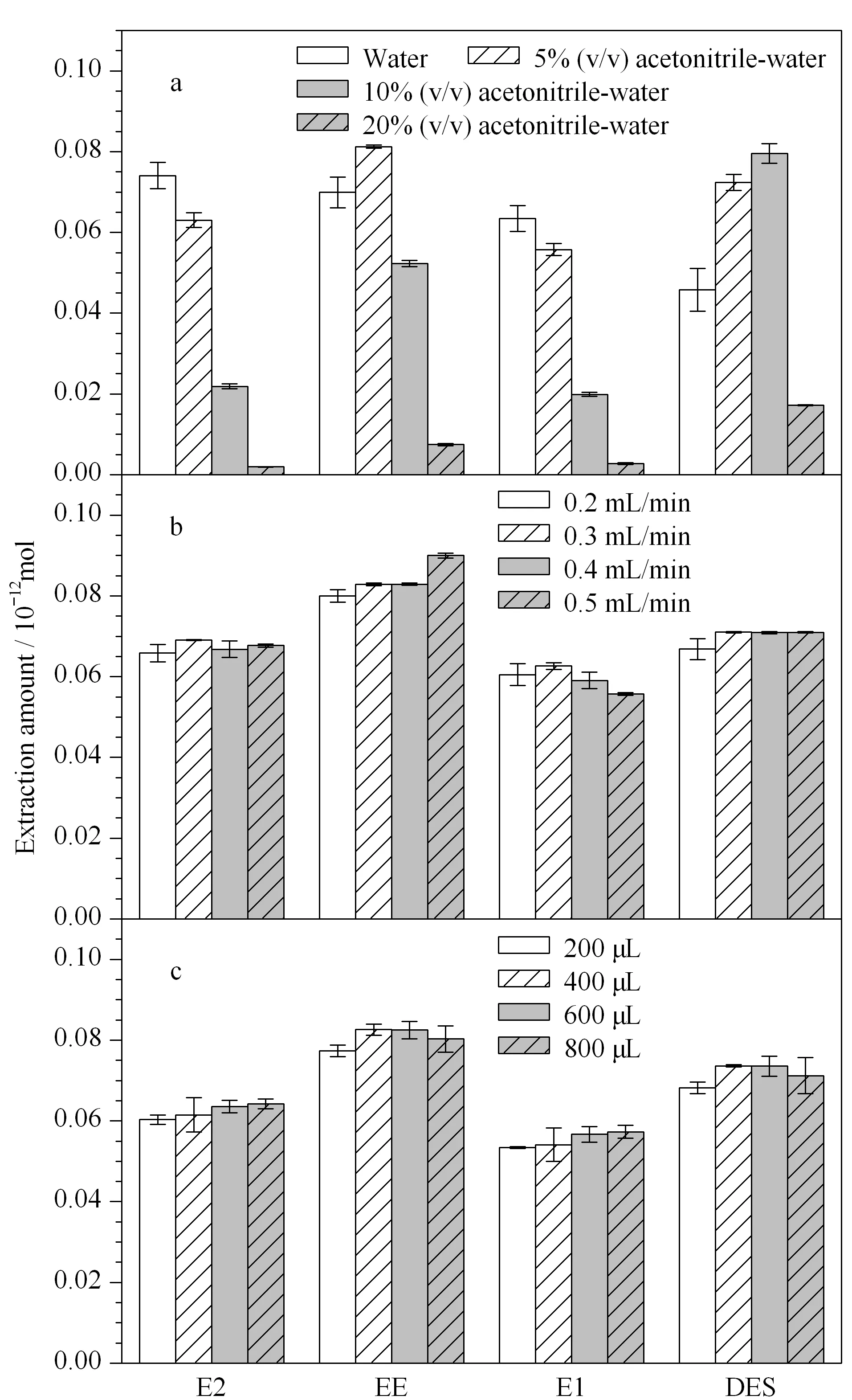
图5 (a)萃取溶剂、(b)萃取流速和(c)解吸体积对4种雌激素萃取量的影响Fig. 5 Effect of (a) extraction solvents, (b) extraction flow rates, and (c) desorption volumes on the extraction amounts of the four estrogens E2: 17β-estradiol; EE: ethynyl estradiol; E1: estrone; DES: diethylstilbestrol.
2.3.2萃取流速的选择
在萃取溶剂(5%(v/v)的乙腈水溶液)、萃取体积(3 mL)、解吸流速(100 μL/min)、解吸体积(600 μL)和解吸溶剂(45%(v/v)乙腈水溶液)不变的条件下,考察不同萃取流速(0.2、0.3、0.4和0.5 mL/min)对4种雌激素萃取量的影响(见图5b)。当萃取流速为0.3 mL/min时,整体柱对E2、E1和DES的萃取效果最好;当萃取流速为0.5 mL/min时,EE的萃取效果最好,但与0.3 mL/min时的萃取量相差不大。综合考虑,最终将萃取流速设为0.3 mL/min。
2.3.3解吸体积的选择
在萃取溶剂(5%(v/v)的乙腈水溶液)、萃取流速(0.3 mL/min)、萃取体积(3 mL)、解吸流速(100 μL/min)和解吸溶剂(45%(v/v)乙腈水溶液)不变的条件下,考察解吸体积分别为800、600、400和200 μL时目标物的萃取效果(见图5c)。随着解吸体积由200 μL增加到600 μL,目标物的解吸量逐渐增加;当解吸体积由600 μL增至800 μL时,目标物的解吸量基本保持不变,表明此时已基本解吸完全。在保证解吸完全的基础上,应尽可能减少分析时间,因此,本实验最终将解吸体积设为600 μL。
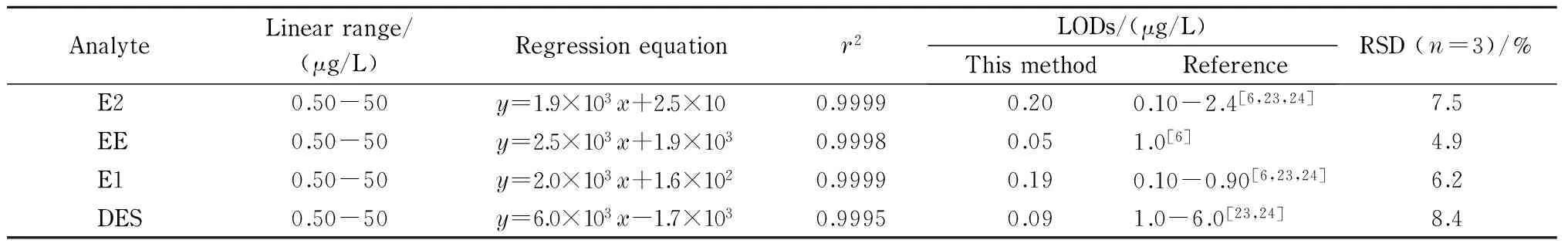
表2 4种雌激素的线性范围、回归方程、相关系数(r2)和检出限(LOD)Table 2 Linear ranges, regression equations, correlation coefficients (r2) and limits of detection (LODs) of the four estrogens
y: peak area;x: mass concentration, μg/L.
2.4 Poly(GMA-co-EDMA)整体柱的萃取性能
对10 μg/L的4种雌激素混合标准溶液进行分析,采用Poly(GMA-co-EDMA)整体柱和不采用整体柱时,E2、 EE、E1和 DES色谱峰的峰面积比(富集倍数)分别为86、116、77和86。表明该整体柱对4种雌激素的富集效果良好,可富集复杂基质样品中的雌激素。
采用同一根和同一批次不同根整体柱对10 μg/L的4种雌激素混合标准溶液进行分析,考察整体柱的稳定性。结果表明,采用同一根整体柱进行萃取时,萃取量的RSD为1.5%~4.9%(n=21);采用同一批次不同整体柱时,萃取量的RSD为2.1%~13.5%(n=3)。说明整体柱的稳定性良好,满足分析要求。
2.5 线性范围、相关系数、检出限和加标回收率
在最优萃取条件下,对4种雌激素的混合标准溶液进行分析,以4种雌激素的峰面积为纵坐标(y),质量浓度为横坐标(x, μg/L)制作标准曲线,4种雌激素在线性范围内相关系数均>0.99(见表2)。E2、EE、E1和DES的检出限(S/N=3)分别为0.20、0.05、0.19和0.09 μg/L,其中E2和E1的检出限与文献报道值接近[6,23,24], EE和DES的检出限低于文献报道值[6,23,24]。4种雌激素含量的RSD(n=3)为4.9%~8.4%。说明该方法具有良好的相关性和重复性。
分别向爽肤水样品中加入2.0、10、20 μg/L的混合标准溶液,在最优条件下分析,E2、EE、E1和DES的加标回收率分别为73.4%~81.2%、69.3%~74.7%、76.1%~79.9%和91.8%~111.3%, RSD均<5.0%(见表3)。结果表明,该方法满足爽肤水中4种雌激素同时测定的要求。
2.6 爽肤水中雌激素的检测
4种雌激素混合标准溶液、稀释10倍的爽肤水直接进样和Poly(GMA-co-EDMA)整体柱在线微萃取未加标爽肤水、20 μg/L加标爽肤水的色谱图见图6。可以看出,未加标爽肤水直接进样时,无法检出4种目标物(见图6b),但经过Poly(GMA-co-EDMA)整体柱在线萃取后,可检出雌二醇(见图6c)。在最优条件下检测8种加标爽肤水样品,其中只在1种爽肤水样品中检测出了雌二醇,含量为9.5 μg/L(见表3)。
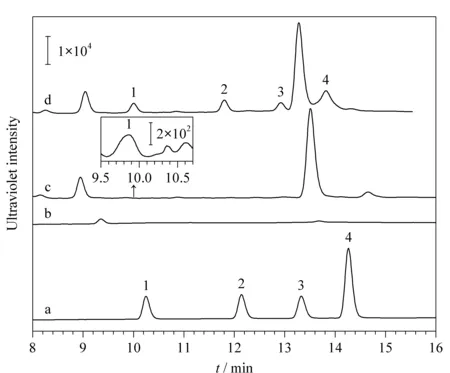
图6 采用HPLC法分析4种雌激素的色谱图Fig. 6 Chromatograms of the four estrogens by HPLC a. The mixed standard solution by direct injection (4 mg/L); b. the toner sample diluted 10 times by direct injection; c. the toner sample diluted 10 times by Poly(GMA-co-EDMA) monolithic column; d. the toner sample spiked with 20 μg/L estrogens standard solutions by Poly(GMA-co-EDMA) monolithic column. 1. 17β-estradiol; 2. ethynyl estradiol; 3. estrone; 4. diethylstilbestrol.
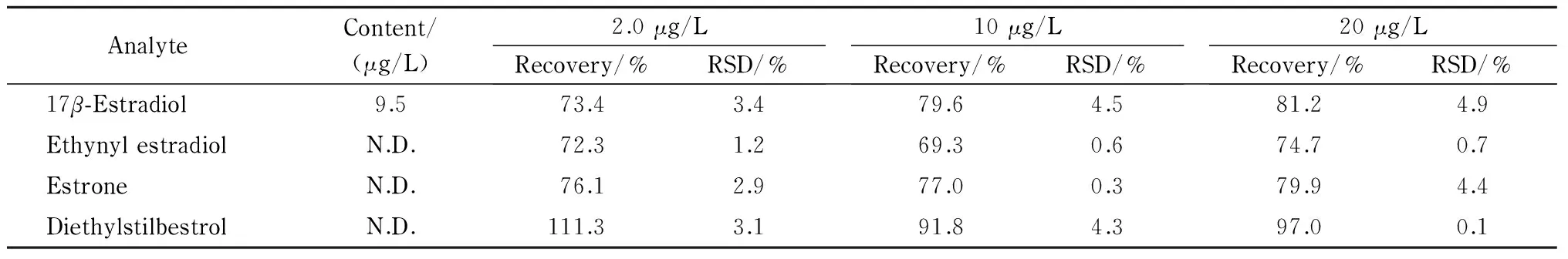
表3 爽肤水样品中4种雌激素在不同加标水平下的回收率和相对标准偏差(n=3)Table 3 Recoveries and RSDs of the four estrogens at different spiked levels in toner samples (n=3)
N.D.: not detected.
3 结论
本文以GMA为单体、EDMA为交联剂、AIBN为引发剂、甲醇及正己烷为二元致孔剂,通过原位聚合反应制备了Poly(GMA-co-EDMA)毛细管整体柱,其通透性和稳定性均良好。同时构建了整体柱在线微萃取接口装置,实现了Poly(GMA-co-EDMA)整体柱在线微萃取与高效液相色谱技术的联用,建立了检测爽肤水中痕量雌激素的分析方法。该方法快速、高效、灵敏、准确、环境友好,可满足化妆品中雌激素的分析要求。
[1] Ocana-González J A, Villar-Navarro M, Ramos-Payán M, et al. Anal Chim Acta, 2015, 858: 1
[2] Jain A, Soni S, Verma K K. J Liq Chromatogr R T, 2015, 38(1): 82
[3] Wang D H, Dong Z Q, Wang Y L, et al. Chinese Journal of Pest Control, 2009, 25(5): 350
王大虎, 董智强, 王玉林, 等. 医学动物防制, 2009, 25(5): 350
[4] Mei M, Yu J, Huang X J, et al. J Chromatogr A, 2015, 1385: 12
[5] Studzińska S, Buszewski B. J Chromatogr B, 2013, 927: 158
[6] Xiao X H, Yin Y, Hu Y L, et al. Chinese Journal of Chromatography, 2007, 25(2): 234
肖小华, 尹怡, 胡玉玲, 等. 色谱, 2007, 25(2): 234
[7] Castanedo-Tardan M P, Zug K A. Dermatol Clin, 2009, 27(3): 265
[8] Darbre P D. Best Pract Res Cl En, 2006, 20(1): 121
[9] Lesellier E, West C. J Chromatogr A, 2015, 1382: 2
[10] Pan C J, Wang W F, Chen X G. J Chromatogr A, 2016, 1427: 125
[11] Chen L F, Ou J J, Liu Z S, et al. J Chromatogr A, 2015, 1394: 103
[12] Zhang Z G, Liu J G, Li J S, et al. Fine and Specialty Chemicals, 2015, 23(1): 9
张志刚, 刘金刚, 李婧实, 等. 精细与专用化学品, 2015, 23(1): 9
[13] Zhou S Y, Chen J Y, Tan J J, et al. Chinese Journal of Chromatography, 2015, 33(12): 1307
周孙英, 陈继涢, 谭静静, 等. 色谱, 2015, 33(12): 1307
[14] Niu X Y, Ding S Y, Wang W F, et al. J Chromatogr A, 2016, 1436: 109
[15] Brabcová I, Satínsky D, Solich P. Anal Methods, 2013, 5(21): 6153
[16] Li J R, Ma Q, Meng X S, et al. Journal of Instrumental Analysis, 2015, 34(1): 43
李晶瑞, 马强, 孟宪双, 等. 分析测试学报, 2015, 34(1): 43
[17] Yan W, Li Y, Zhao L X, et al. J Chromatogr A, 2009, 1216(44): 7539
[18] Wang P J, Xiao Y, Liu W J, et al. Food Chem, 2015, 172: 385
[19] Yang S S, Yang Y N, Li X L, et al. Chinese Journal of Analytical Chemistry, 2016, 44(3): 396
杨姗姗, 杨亚楠, 李雪霖, 等. 分析化学, 2016, 44(3): 396
[20] Zhang J M, Lin W S, Li X N, et al. J Sep Sci, 2012, 35(5/6): 721
[21] Wu R A, Zou H F, Ye M L, et al. Anal Chem, 2001, 73: 4918
[22] Liu Y, Wang M M, Ai L F, et al. J Sep Sci, 2014, 37(13): 1648
[23] Wang J, Zhou Z R, Lin S B. Journal of Hygiene Research, 2010, 39(3): 383
王君, 周志荣, 林少彬. 卫生研究, 2010, 39(3): 383
[24] Liu Y, Zhang X L, Ouyang Y, et al. J Mass Spectrom, 2011, 46(8): 794
Analysis of trace estrogens in toners by monolithic columnonline solid phase microextraction coupled withhigh performance liquid chromatography
SONG Wenwen, LUO Xialin, LI Gongke*, HU Yufei*
(SchoolofChemistry,Sun-Yat-SenUniversity,Guangzhou510275,China)
A Poly(glycidyl methacrylate-co-ethyleneglycol dimethacrylate) (Poly(GMA-co-EDMA)) monolithic column was prepared in a capillary by in-situ polymerization. Glycidyl methacrylate (GMA) was chosen to be the monomer and ethyleneglycol dimethacrylate (EDMA) was utilized as crosslinking agent. The binary porogenic agents of methanol andn-hexane can develop the permeability of monolithic column and they were suitable to construct the online analysis apparatus. A series of experiments were carried out, and they demonstrated the monolithic column had good permeability with low column pressure (1.5×106Pa at the washing flow rate of 0.5 mL/min). The enrichment factors of the prepared monolithic column for estradiol, ethynyl estradiol, estrone and diethylstilbestrol were 86, 116, 77 and 86, respectively. It was proved that the monolithic column was suitable for the online microextraction system by using the interface unit. A method was established for the analysis of trace estradiol, ethynyl estradiol, estrone and diethylstilbestrol in toners by monolithic column online solid phase microextraction coupled with high performance liquid chromatography. The limits of detection (S/N=3) were 0.05-0.20 μg/L. The recoveries in toner samples varied from 69.3% to 111.3%, and relative standard deviations were less than 5.0%. The method is efficient, sensitive, accurate, reliable and applicable to analyze trace estrogens in toners.
high performance liquid chromatography (HPLC); poly(glycidyl methacrylate-co-ethyleneglycol dimethacrylate) (Poly(GMA-co-EDMA)) monolithic column; online solid phase microextraction; estrogens; toners
10.3724/SP.J.1123.2016.08012
2016-08-15
国家自然科学基金项目(21475153,21575167);广东省自然科学基金重点项目(2015A030311020);广东省公益研究与能力建设专项(2015A030401036);广州市科技计划项目(201604020165).
Foundation item: National Natural Science Foundation of China (Nos. 21475153, 21575167); Key Project of Natural Science Foundation of Guangdong Province (No. 2015A030311020); Public Welfare Research and Capacity Building of Guangdong Province (No. 2015A030401036); Guangzhou Science and Technology Project (No. 201604020165).
O658
:A
:1000-8713(2017)01-0020-07
*通讯联系人.Tel:(020)84110922,E-mail:cesgkl@mail.sysu.edu.cn (李攻科);Tel:(020)84110922,E-mail:huyufei@mail.sysu.edu.cn (胡玉斐).
- 色谱的其它文章
- 基于高通量解析算法的复杂样品重叠气相色谱-质谱信号的快速分析
- 移液枪头式固相微萃取-高效液相色谱法测定细胞培养液中的4种生物碱
- 化学衍生辅助液相色谱-串联质谱测定枇杷膏中的齐墩果酸和熊果酸
- Holistic analysis of Liuwei Dihuang pills using ultrasoniccell grinder extraction and ultra-performanceliquid chromatography
- Investigation of aromatic impurities in liquefied petroleumgas by solid-phase extraction sampling coupled withgas chromatography-mass spectrometry
- Quantification of intracellular adenosine 5′-triphosphateand its metabolites by high performance liquidchromatography analysis

