培养细胞体系中槐定碱抗EV71病毒的作用
欧阳刘健,魏昌瑛
(杭州第二中学高三611班(实验班),浙江 杭州 310053)
培养细胞体系中槐定碱抗EV71病毒的作用
欧阳刘健,魏昌瑛△
(杭州第二中学高三611班(实验班),浙江 杭州 310053)
探究槐定碱抗EV71病毒的作用,为防治手足口病提供线索。在体外培养的Vero细胞体系中加入槐定碱,用MTT法检测其细胞毒性;在病毒感染的不同时期用槐定碱处理,用MTT法检测细胞存活率、细胞病变等指标,表征其对EV71病毒吸附、穿入的抑制作用及直接杀灭作用;用RT-PCR法检测其对于病毒RNA复制的抑制作用。(1)槐定碱具有一定细胞毒性,其CC50为1.414mg/mL;(2)能够抑制病毒对Vero细胞的感染,其IC50=0.354mg/ mL;(3)其机制可能是抑制病毒的吸附和RNA复制,但对病毒穿入的抑制作用较弱。槐定碱可抑制病毒吸附和病毒增殖,在病毒感染前后用药效果都较好,且有效浓度远小于其CC50值,作为防治手足口病药物的开发潜力较大。
Vero细胞,槐定碱,抑制,EV71病毒。
1 概述
手足口病 (Hand,foot and mouth disease,HFMD)是一种常见的病毒性传染病,易感人群多为学龄前儿童,尤以3岁以下发病率最高[1]。肠道病毒71型(enterovirus71,EV71)可感染T淋巴细胞、人血管内皮细胞和神经细胞,触发细胞凋亡[2~4],引起持续高热,导致中枢神经系统疾病及并发症[5],致残和死亡率较高[6],是造成HMFD疾病的主要病原体[7]。因此引起全球广泛关注。
EV71是单股正链RNA病毒,属于小RNA病毒科肠道病毒属A组[8]。该病毒侵染细胞时,首先与细胞上的受体(CD55等)结合,吸附在细胞膜上并脱去蛋白质衣壳,其RNA基因组进入细胞,并立即进行蛋白的翻译加工,产生成为新的衣壳蛋白;同时在病毒RNA聚合酶的作用下生成负链RNA,再以负链RNA为模板生成新的正链RNA;在感染晚期组装形成子代病毒,裂解细胞释放出病毒颗粒[9],并进一步感染相邻细胞。感染EV7l后1-2h,细胞自身的大分子合成迅速停止,染色质边缘化;感染3h后,胞质空泡化,病毒蛋白质合成开始;4h后质膜通透性增大;6h后病毒在胞质内合成;10h后细胞裂解,病毒颗粒释放。细胞裂解时出现的细胞形态学改变,称致细胞病变效应(CPE)。典型的细胞CPE表现为细胞圆缩,分散,胞浆内颗粒增加,折光性增强,直至细胞从培养板上脱落,细胞漂起。温度、pH、宿主细胞、感染的多样性等因素都会影响病毒的感染和复制。
目前,在抗EV71病毒药物的研发聚焦于利用现有的抗病毒药物、设计抗病毒药物的衍生物和筛选新的抗病毒药物等方面。Chem等发现吡唑啉[3,4-d]嘧啶类物质在低浓度下对EV71有抑制作用[10]。Liu等发现I型干扰素可能对控制EV71感染起重要作用[11]。Sim等用针对EV71基因组的小干扰RNAr(siRNA)作用于病毒,可显著减轻体外培养的EV71感染细胞病变[12]。Tan等发现一种化学合成的短发卡样RNA(shRNA)可显著抑制培养细胞内EV71的复制[13]。但这些成果大多停留在实验室阶段,能否应用于临床尚有待研究。
槐定碱(Sophoridine)是苦豆子、苦参的主要活性成分之一,可增强正常小鼠巨噬细胞功能,并促进脾脏免疫细胞增殖[21]。在一定剂量范围内,槐定碱能剂量依赖性地抑制巨噬细胞经LPS刺激产生TNF-α,这可能是其抗炎、免疫调节作用的机制之一[14]。江西中医药大学李雪梅组独立研制成功了抗癌新药槐定碱及其制剂“盐酸槐定碱注射液”,获国家一类化学新药证书和生产证书,获江西省2007年度科学技术进步奖一等奖(据江西中医药大学新闻,http://news.j xutcm.edu.cn/info/1002/14917.htm)。本研究以EV71敏感的Vero细胞为模型,研究槐定碱是否具有抗EV71病毒的作用,探讨其临床应用的可行性,为寻找治疗手足口病的新药物提供线索。
2 实验材料与方法
2.1 实验材料
Vero细胞购自中科院生物化学与细胞生物学研究所;EV71病毒株由邯郸市疾病预防与控制中心惠赠;DMEM培养基、胰蛋白酶、双抗、胎牛血清(FBS)购自Gibco公司;槐定碱购自苏州宝泽堂医药有限公司;TaqDNA聚合酶购自Fermentas公司;TrizolReagent购自Takara公司;cDNA反转录试剂盒购自TOYOBA公司;EV71和18sPCR引物由上海捷瑞生物技术服务有限公司合成,其序列见表1。

表1 所用EV71和18S引物序列
2.2 实验方法
2.2.1 Vero细胞的培养与计数方法
取液氮冻存的Vero细胞管,置于42℃水浴中迅速解冻,低速离心后吸出上清液,用完全培养液(DMEM培养基中加入1%青霉素和链霉素,10% FBS)吹起后移入细胞培养瓶或培养板中,在CO2浓度5%、37℃条件下培养12h,吸出原培养液,PBS冲洗3次;加入等量新鲜培养液继续培养,观察细胞的生长状态。当细胞汇合率达90%左右时,吸出原培养液,用D-Hanks缓冲液冲洗3次,加入2.5%胰蛋白酶-EDTA,37℃消化2min,轻轻吹打使细胞脱离培养瓶壁,加入等量完全培养液终止消化,于800~1000rpm下离心5min;吸去上清液,加入5mL完全培养液,使细胞悬浮并充分分散,平均分装到2-3个新的细胞培养瓶中,补充培养液至适量体积,在37℃、5%CO2条件下进行传代培养。采用血球计数板计数法计数细胞,细胞浓度=四大格中的细胞总数×稀释倍数/4。
2.2.2 EV71病毒的培养、检测和TCID50测定
EV7l病毒株用无血清DMEM进行10倍比梯度稀释;接种于96孔板中的Vero细胞(5×103/孔)生长至90%左右 (约10h)时,加入不同稀释度的EV71病毒稀释液50μL,每个梯度重复8孔,以未加病毒的细胞作为阴性对照。于37℃,5%CO2条件下培养7d,期间连续观察细胞病变,统计细胞完全病变的孔数。按Behrens-Karber公式计算病毒滴度TCID50:logTCID50=L-d(S-0.5),其中:L=实验中使用的最低稀释度的log值;D=稀释梯度的log值;S=出现CPE的细胞孔所占的比例之和。
当CPE达75%以上时收取病毒裂解液,提取病毒RNA,用RT-PCR法检测。反应体积为20μL,反应条件为95℃预变性3min;95℃变性20s,45℃退火25s,72℃延伸30s,30个循环;后72℃延伸10min;目的片段预期长度为226bp。以18sRNA作为内标,反应条件为94℃预变性5min;94℃变性30s,58℃退火 30s,72℃延伸 45s,30个循环;后 72℃延伸10min。反应结束后,取10μLPCR反应产物,1%琼脂糖凝胶电泳检测目的片段。
◎23价疫苗:2岁以上有基础疾病(比如艾滋,肾炎啥的免疫力低下)的儿童才打,正常的健康宝宝不要打,有报道正常儿童打过几年后反而会对肺炎球菌的免疫有问题。
2.2.3 槐定碱的细胞毒性检测
接种Vero细胞(1×105个/mL)于96孔板,每孔100μl,培养24h,吸去原培养液,加入含有不同浓度槐定碱(0.015、0.03125、0.0625、0.125、0.25、0.5、1、2 mg/mL)的维持培养液,以未加化合物组的培养细胞组为阴性对照,以DMEM培养液为空白对照。每个浓度3复孔。各组均在37℃、5%CO2条件下孵育48h后,去除培养液,加入DMSO150μL,轻轻震荡以溶解结晶,用酶标仪测定490nm处吸光度值(A490),计算细胞存活率(%)。
2.2.4 槐定碱在不同侵染时期的抗病毒作用
接种Vero细胞于96孔板(1×105个/mL,每孔100μl)中,培养24h后分为6组。组Ⅰ:加入病毒,同时加入槐定碱(0.03125、0.0625、0.125、0.25、0.5、1mg/mL)。并据本组数据计算槐定碱对于EV71病毒的半抑制浓度(IC50);组Ⅱ:将病毒与槐定碱混合后于37℃作用2h,随后重悬病毒加入96孔板中;组Ⅲ:加入病毒并吸附2h后,吸去病毒液并加入槐定碱;组Ⅳ:用槐定碱预处理细胞2h后,加入病毒;组Ⅴ:空白对照组(不做任何添加);组Ⅵ:阴性对照组(加入病毒,不加药物处理)。各组细胞继续培养48h后吸尽培养液,每孔加入5mg/mL的MTT溶液10μl,37℃下继续孵育4h,小心去除培养液,参照2.2.3测定其A490,计算细胞存活率(%)。除组Ⅰ外各组的毒量均按IC50加入,每浓度重复3孔。
2.2.5 槐定碱对病毒吸附、穿入及RNA复制的抑制实验
参照2.2.4的方法细胞培养24h后分为三组:组Ⅶ:置于4℃预冷1h,加入EV71病毒,随即加入含有槐定碱(浓度同2.2.4)的维持培养液,4℃静置孵育3h,弃去全部培养液,用PBS冲洗3次以去除尚未吸附的病毒,加入完全培养液;组Ⅷ:将96孔板在4℃预冷1h并加入病毒,继续静置3h,随即加入含有不同浓度槐定碱(浓度同2.2.3)的维持培养液,置于37℃培养,使病毒最大限度穿入细胞。每10min为间隔,以pH11的PBS冲洗细胞以终止病毒穿入,随后立即加入pH3的PBS冲洗细胞以中和碱性PBS,加入完全培养液;组Ⅸ:处理与2.2.4中组Ⅳ相同。空白对照和阴性对照组与2.3.4相同。各组均继续培养48h,第Ⅶ、Ⅷ两组参照2.2.3用MTT法测定A490,计算细胞存活率;第Ⅸ组用RT-PCR法半定量检测EV71病毒RNA(参照2.2.2),每个浓度重复3孔。
2.2.6 数据处理
数据均用GraphpadPrism5.0软件处理。并用单因素方差分析法进行统计和误差分析。
3 结果与分析
正常Vero细胞的形态如图1(A)所示,EV71病毒感染引发的细胞CPE反应如图1(B)所示,病毒基因组RT-PCR结果如图1(C)所示。被病毒感染的细胞表现为圆缩、分散、胞浆内颗粒增加、折光性增强、从培养板上脱落漂起等征状。经PCR扩增得到了EV71病毒特有的226bp条带。用Behrens-Karber法计算出该病毒株的 TCID50值为 1×10-4.25/100μL,即病毒液稀释104.25倍后,每孔添加100μl可引起50%的细胞产生CPE反应。即病毒滴度为1×105.25TCID50/mL,在此滴度下Vero细胞被病毒感染48h后可完全漂浮。

图1 EV71病毒导致的Vero细胞CPE反应(40×)及病毒基因组检测结果
3.2 槐定碱对于Vero细胞的毒性
由图2可见:细胞存活率随着槐定碱浓度的增加逐渐降低,说明槐定碱具有一定的细胞毒性。浓度低于31.25μg/mL时,对Vero细胞损伤较小(~10%);浓度达到2mg/mL时仍有约10%细胞存活。计算出槐定碱对于Vero细胞的CC50为1.414mg/mL。
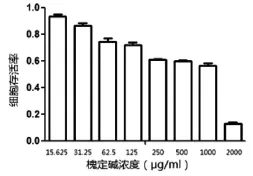
图2 槐定碱对Vero细胞的毒性作用(N=3)
3.3 槐定碱不同处理对EV71病毒的抑制作用
槐定碱对EV71病毒感染后细胞CPE反应的抑制作用参如图3(A~C)所示。在感染的不同时期给药(第Ⅰ~Ⅳ组)对病毒抑制(对细胞保护)的检测结果参如图3(D~G)所示(N=3)。
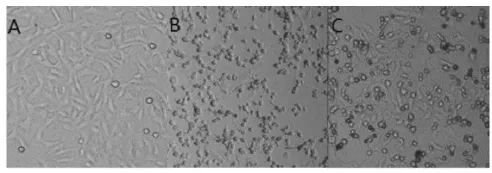
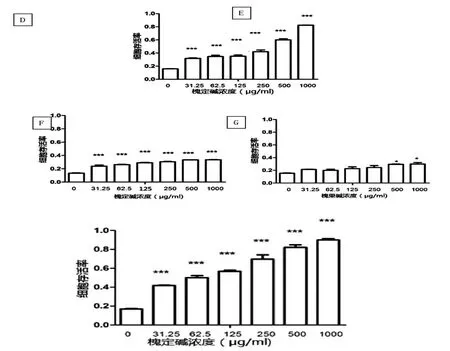
图3 槐定碱不同处理对EV71病毒的作用
3.4 槐定碱对EV71病毒吸附、穿入和复制的抑制作用
病毒危害细胞的过程大致可以分为吸附、穿入和复制。图4-A(组Ⅶ)显示:31.25μg/mL的槐定碱对于病毒吸附即具有较好的抑制作用(p<0.001),且抑制作用与浓度正相关。图4-B(组Ⅷ)显示槐定碱对病毒穿入的抑制作用较弱。图4-B(组Ⅸ)显示:较低浓度槐定碱(62.5μg/mL)对于病毒RNA复制即具有明显的抑制作用,其抑制作用与浓度正相关。

图4 槐定碱对EV71病毒吸附、穿入和复制的抑制作用
4 讨论与结论
Vero细胞是非洲绿猴肾细胞,对EV71病毒感染较为敏感,以成为病毒学研究的常用细胞体系。我们选用体外培养的Vero细胞体系,探究了槐定碱抗EV71病毒的作用,并对其抗EV71病毒的机制进行了初步探讨。尽管培养细胞体系中的实验结果与临床还有相当距离,但也为该药物的临床应用提供了有益的线索。
中药及其提取物的抗EV71病毒已有许多相关研究,见表2。本研究发现:槐定碱可有效抑制EV71病毒对 Vero细胞的感染,其 IC50值为0.35mg/mL,该值优于丹参提取液的IC50值。而槐定碱对于 Vero细胞的半致死浓度 (CC50值)为1.346mg/mL,远高于IC50值,说明该药物细胞毒性较低,而安全性较高。

表2 部分抗EV71病毒药物的IC50值
EV71病毒感染细胞大致包括病毒吸附、脱衣壳、病毒遗传物质进入细胞(穿入)、病毒RNA复制、衣壳蛋白合成和病毒组装等关键步骤。这些关键的步骤都可成为抗病毒化合物研究的作用靶点[22]。本研究主要就病毒吸附、穿入及复制三个方面初步探究了槐定碱抑制EV71病毒对Vero细胞感染的机制。结果表明:低浓度(31.25μg/mL)的槐定碱即可抑制EV71病毒的吸附,而较高浓度(62.5μg/mL以上)的槐定碱还可以抑制病毒RNA的复制。刘晓玲等的研究表明:槐定碱等苦参系列生物碱可有效抑制柯萨奇B3病毒(CVB3)所致的Vero细胞和大鼠原代心肌细胞病变抑制作用、病毒繁殖抑制反应[23]。我们的结果与刘晓玲等的研究结果能够相互印证。
根据本实验可得出如下结论:在体外,槐定碱在病毒感染早期具有较好的抗病毒作用,在感染后期对EV71的复制也具有较强的抑制作用。说明该化合物可能具有一定的预防和治疗作用,作为抗EV71病毒药物的开发潜力较大。
[1] LeeTC,GuoHR,SuHJ,etal.Diseasescausedbyenterovirus 71infection[J].PediatrInfectDisJ,2009,28(10):904-910.
[2] LiangCC,SunMJ,LeiHY,etal.HumanEndothelialCellAc tivationandApoptosisInducedbyEnterovirus71Infection[J]. JournalofMedicalVirology,2004,74:597-603.
[3] ChenTC,LaiYK,YuCK,etal.Enterovirus71triggeringof neuronalapoptosisthroughactivationofAbl-Cdk5signaling [J].CellularMicrobiology,2007,9:2676-2688.
[4] ChenLC,ShyuHW,ChenSH,etal.Enterovirus71Infection InducesFasLigandExpressionandApoptosisofJurkat Cells [J].JournalofMedicalVirology,2006,78:780-786.
[5] Jia C S,Liu J N,Li W B,et al.The cross-reactivity of the en terovirus 71 to human brain tissue and identification of the cross-reactivityrelatedfragments[J].VirolJ,2010,7:47.
[6] AbuBakarS,CheeHY,Al-KobaisiMF,etal.Identificationof enterovirus71isolatesfromanoutbreakofhand,footandmouth disease(HFMD)with fatal cases of encephalomyelitis in Malaysia[J].VirusRes,1999,61(1):1-9.
[7] Ooi M H,Wong S C,Lewthwaite P,et al.Clinical features,di agnosis,andmanagementofenterovirus71[J].LancetNeurol, 2010,9(11):1097-1105.
[8] 金奇.医学分子病毒学[M].北京:科学出版社,2001,606-613.
[9] ZollGJ,MelcherWJ.Generalprimer-mediatedpolymeraLse diagnosticroutineandpersistentinfections.JCIiniMicrobiol, 1992(30):160-165。
[10]Chem JH,Lee CC,Chang C.Synthesis and anti-enteroviral activity of a series of novel,oxime ether-containing pyridyl imidazolidinones[J].Bioorg Med Chem Lea.2004,14(20): 5051-5056.
[11]Liu ML,Lee YP,Wang YF,et,a1.Type I interferons protect mice against enterovirus71 Infection.J Gen Virol.2005.86: 3263-3269.
[12]Sim AC,Luhur A,Tan TM,Chow VT'Poh CL.RNA interfer enceagainstenterovirus71infection.Virology.2005 10,341 (1):72-729.
[13]Tan EL,Tan TM,Tak Kwong Chow V,Poh C.Inhibition of en terovirus71inVirus-infectedmicebyRNAinterference.Mol Ther.2007Nov,15(11):1931-1938.
[14]黄秀梅,李波,沈连忠,等.四种苦豆子生物碱对巨噬细胞产生肿瘤坏死因子α的影响[J].中药药理与临床,2001,17(3):12-14.
[15]LinTY,LiuYC,JhengJR,etal.Anti-Enterovirus71activity screeningofChineseherbswithanti-infectionandinflammationactivities[J].AmJChineseMed,2009,37(1):143.
[16]WuBW,PanTL,LeuYL,etal.AntiviraleffectsofSalviamil tiorrhiza(Danshen)againstenterovirus71[J].AmJChinMed. 2007,35(1):153.
[17]ChangJS,WangKC,ChiangLC.Sheng-Ma-Ge-Gen-Tang inhibitedenterovirus71infectioninforeskinfibroblastcell line[J].JEthnopharmacol,2008,119:104-118.
[18]LinTY,ChuC,ChiuCH.Lactoferrininhibitsenterovirus71 infectionofhumanembryonalrhabdomyosarcomacellinvit ro.J.Infect.Dis.2002,186:1161-1164.
[19]ShihSR,TsaiKN,LiYS,etal.ChanEC.Inhibitionofen terovirus71-inducedapoptosisbyallophycocyaninisolated fromablue-greenalgaSpirulinaplatensis.JMedVirol.2003, 70:119-125.
[20]LinCW,WuCF,HsiaoNW,etal.Aloe-emodinisaninterfer on-inducingagentwithantiviralactivityagainstJapaneseen cephalitisvirusandenterovirus71.[J].IntJAntimicrobA gents,2008,32(4):355.
[21]周娅,王宁萍,赵建宁,槐定碱对小鼠腹腔巨噬细胞功能的影响[J].辽宁中医杂志,2000,27(2)2:84-86.
[22]ChenTC,WengKF,ChangSC,etal.Developmentofantiviral agentsforenteroviruses[J].Antimicrob.Chemother.2008,62, 1169-1173.
[23]刘晓玲,张勇,刘小雷,苦参系列生物碱体外抗CVB3病毒活性[J].沈阳药科大学学报,2006,23(11):724-730.
S859
△
:魏昌瑛,男,指导老师。Email:512667205@qq.com.

