共存碳源对克雷伯氏菌NIII2发酵蔗糖产絮凝剂的影响
白雪蕊, 聂麦茜, 谢铮胜, 宋勃轩, 聂红云
西安建筑科技大学环境与市政工程学院, 陕西 西安 710055
共存碳源对克雷伯氏菌NIII2发酵蔗糖产絮凝剂的影响
白雪蕊, 聂麦茜*, 谢铮胜, 宋勃轩, 聂红云
西安建筑科技大学环境与市政工程学院, 陕西 西安 710055
研究了共存碳源对克雷伯氏菌NIII2以蔗糖为主要碳源发酵产絮凝剂的影响。实验结果表明:柠檬酸为共存碳源时,克雷伯氏菌NIII2分泌絮凝剂过程中容易产酸,使得絮凝剂的产量和碳源转化率都较低。当丁二酸、乙酸、乳酸为共存碳源时,发酵液pH均高于7.5,絮凝剂产量有所提高,最高可达10.87g/L,碳源转化率也较高,为43.48%。与柠檬酸为共存碳源相比,当投加丁二酸时,克雷伯氏菌NIII2所产微生物絮凝剂中蛋白质与糖含量比值提高了33%,絮凝剂的Zeta电位值由-60.00 mV升高至-28.07 mV,絮凝剂分子粒径广泛分布在0~300 μm之间且大粒径分子所占比例增加,聚合度加大,絮凝剂表面形貌呈现结块团状无定型结构,从而提高絮凝剂的活性和性能。该微生物絮凝剂投加量为4.0 mg/L,对2 g/L高岭土的SS去除率可达97.3%。
共存碳源; 克雷伯氏菌NIII2; 微生物絮凝剂; 碳源转化率
微生物絮凝剂是微生物分泌的次生大分子代谢产物[1,2],主要有蛋白质类、多糖类、DNA、糖蛋白类[3-6],具有絮凝活性高、生物降解性好、无毒、无二次污染等优势,因此在采油废水、食品工业、发酵工程等领域有着很大的应用前景。但因其活性官能团数量和种类众多、分子结构复杂多变,且在发酵产品的生产中,微生物絮凝剂的生产和应用成本高,目前仍未见大规模的工业化产品。
发酵和基因工程生产生物制品时,共因子操作(manipulation of co-factor)[7]是一种常用的获得目标产物并提高其产量的重要方法,其在微生物发酵产絮凝剂的研究中,尚未全面和系统地被研究。本论文选取糖代谢过程中的中间产物作为共存碳源,利用共因子操作方法研究共存碳源的可利用性及其比例对克雷伯氏菌NIII2发酵产絮凝剂特性的影响,以期利用该菌株高产高活性絮凝剂,同时获得稳定的发酵工艺条件。
1 材料与方法
1.1 材料
1.1.1 菌种来源
克雷伯氏菌NIII2由实验课题组从城市生活污水处理厂的活性污泥中分离筛选,利用16S rDNA序列分析鉴定并保存[8]。
1.1.2 培养基的配制
种子液培养基:3 g牛肉膏,10 g蛋白胨,5 g NaCl,1 L蒸馏水,调节pH至7.5,用高压水蒸气锅121 ℃灭菌45 min。
发酵培养基:20 g蔗糖,2.5 g NaNO3,0.2 mL 1 mol/L CaCl2,2 mL 1 mol/L MgSO4,2 mL 1 mol/L微量元素溶液,30 mL 1mol/L磷酸盐缓冲溶液,1 L蒸馏水。分别加入丁二酸、柠檬酸、乙酸、乳酸,调节pH 至7.5,用高压水蒸气锅121 ℃灭菌30 min。
1.2 方法
1.2.1 种子液制备
无菌条件下,从NIII2菌保存平板上挑取单克隆于100 mL已灭菌的种子液培养基中,150 r/min,30 ℃条件下恒温振荡培养24 h,备用。
1.2.2 絮凝剂发酵与提取
无菌条件下,将2%(V/V)NIII2菌种子液接种于100 mL发酵培养基中,150 r/min,30 ℃条件下恒温振荡72 h后,在4 ℃,10 000 r/min的条件下高速冷冻离心10 min并且除去沉淀。按1∶3(V/V)将所得发酵液与无水乙醇迅速混合均匀,收集上浮絮体即为微生物絮凝剂。将其冷冻干燥后研成粉末,分装保存备用。
1.3 分析方法
1.3.1 絮凝剂产量和碳源转化率的测定
将所得絮凝剂冻干后进行称量,以g/L发酵培养基计算絮凝剂产量;碳源转化率[9]的计算:
CCR=a/(b+c)×100%
式中:CCR为碳源转化率;a为絮凝剂产量(g/L);b为蔗糖投加量(g/L);c为共存碳源投加量(g/L)。
1.3.2 絮凝剂结构组分的测定
糖含量的测定:采用苯酚-硫酸法测定所产絮凝剂的糖含量。
蛋白含量的测定:采用Folin-酚法测定所产絮凝剂的蛋白质含量。
粒径分布的测定:取1mL 5 g/L絮凝剂水溶液,使用激光粒度分布测定仪(LS230/SVM+型,美国贝克曼库尔特)测定所产絮凝剂的粒径分布。
荷电特性的测定:取1mL 80 mg/L絮凝剂水溶液,使用Zeta电位测定仪(Zeta Size Nano-ZS,马尔文仪器有限公司)多次测量测定其Zeta电位并取平均值。
红外光谱的测定:将絮凝剂粉末与KBr以1∶100(mg∶mg)混匀研成粉末并进行压片,使用傅里叶红外光谱分析仪(IR Prestige-21,日本岛津出品)测定所产絮凝剂纯品的红外光谱。
外貌形态的分析:取约10 mg提纯后的微生物絮凝剂固体粉末,置于样品柱上喷金(Bal-Tec SCD005 Sputter Coater),然后在JSM 6510LV 扫描电镜上进行表面扫描。
絮凝活性的测定:对高岭土SS的絮凝率:取40 mL 2 g/L高岭土乳浊液于50 mL比色管中,加入0.2 mL 0.1 mol/L的CaCl2溶液,0.2 mL 2 g/L絮凝剂水溶液,定容至50 mL。以0.2 mL蒸馏水作对照实验,快速混合均匀,静置5 min,测1 cm处上清液的OD550。絮凝活性用絮凝率表示:
FR=(A0-A末)/A0×100%
式中:FR为絮凝率;A0、A末分别为对照和样品的OD550。
2 结果与讨论
2.1 共存碳源对NIII2菌发酵产絮凝剂特性的影响
2.1.1 共存碳源对NIII2菌发酵产絮凝剂产量的影响
以蔗糖为主要碳源,外加如图1所示的共存碳源,72 h后测定发酵液最终pH和产量,结果如图1所示。从图1可看出,P值(0.041)<0.05,共存碳源存在下,NIII2菌产絮凝剂有显著性差异。当柠檬酸共存时,发酵过程易产酸性物质,且收获絮凝剂时,发酵液pH由初始7.5降至6.08,同时使NIII2菌所得絮凝剂产量较低,仅约为6.5 g/L。而以丁二酸、乙酸、乳酸共存时,发酵液pH均高于7.5,尤其是丁二酸共存时,发酵液pH由初始7.5升至8.25,发酵过程明显产碱性化合物,絮凝剂产量也可高达并稳定在9.5~10.9 g/L范围内。该产量是目前报道的NIII2菌分泌微生物絮凝剂的最高稳定产量。与前期利用NIII2菌发酵单一碳源相比,絮凝剂的产量提高约4 g/L。从图1还可看出,NIII2菌利用碳源发酵产絮凝剂过程中酸性基团(羧基、酚羟基等)的产生不仅会使发酵液pH降低,而且会抑制NIII2菌分泌絮凝剂,而碱性基团的形成则有利于NIII2菌分泌次生代谢产物絮凝剂。
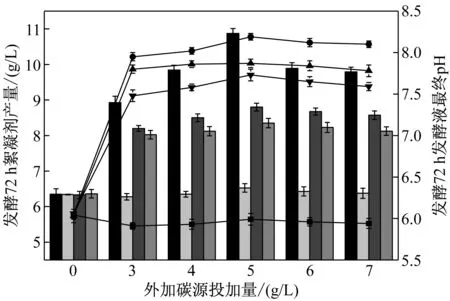

图1 共存碳源对NIII2菌分泌絮凝剂产量的影响
2.1.2 共存碳源对NIII2菌产絮凝剂时碳源转化率的影响
通过碳源物料比(共存碳源与蔗糖投加量的比值)分别计算所产絮凝剂的碳源转化率,结果如表1所示,P值(0.001)<0.05,共存碳源存在下,NIII2菌产絮凝剂的碳源转化率有显著性差异。由表1结果看,当柠檬酸共存时,NIII2菌将总碳源合成转化为絮凝剂的效率均低于30.20%(与单一碳源发酵相近);当乙酸和乳酸为共存碳源时,碳源转化率有所提高;而当丁二酸共存时,可使碳源转化率明显提高,可达43.48%。因此,NIII2菌能快速利用糖代谢过程的中间产物丁二酸分泌合成絮凝剂,从而使碳源转化为絮凝剂的效率大幅提高,生产和应用成本的降低,更加有利于微生物絮凝剂的工业化生产。
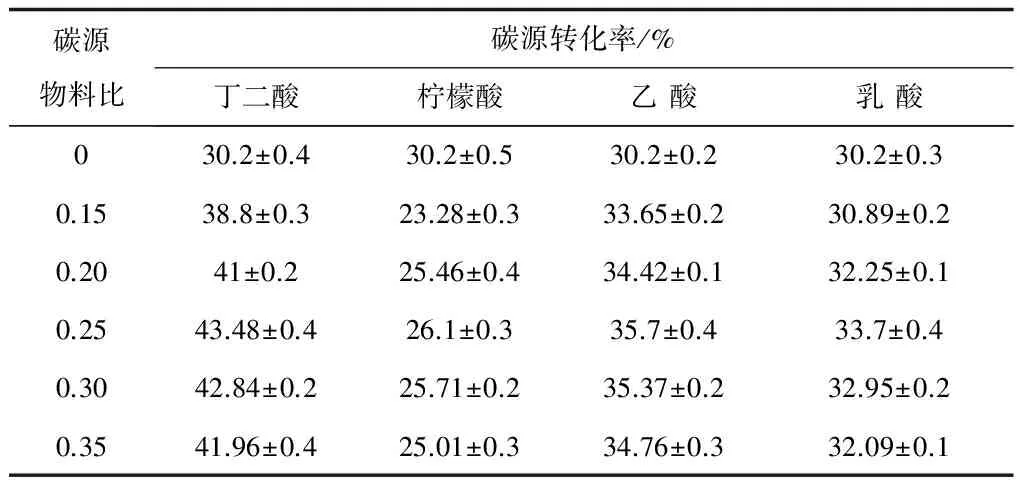
表1 共存碳源对NIII2菌合成絮凝剂时碳源转化率的影响
2.2 共存碳源对NIII2菌所产絮凝剂结构及其组分的影响
2.2.1 共存碳源对NIII2菌所产絮凝剂组分的影响
按文献[9]的方法对所产絮凝剂进行成分分析,测定絮凝剂中蛋白质与糖的含量,并计算蛋白质与糖含量的比值,结果如图2所示,P值(0.824)>0.05,共存碳源存在下,NIII2菌产絮凝剂蛋白与糖含量无显著性差异,NIII2菌所产絮凝剂中蛋白质和糖的比值与所使用共存碳源种类密切相关,而共存碳源的投加量则影响较小。由图2结果看,当发酵培养基中投加柠檬酸钠时,NIII2菌所产絮凝剂蛋白含量较低,其蛋白质与糖含量比值约为0.55。当乙酸和乳酸共存时,所产絮凝剂的蛋白质含量则提高,蛋白质与糖含量的比值分别约为0.71和0.68。而丁二酸为共存碳源时,絮凝剂中蛋白含量提高明显,使蛋白质与糖含量的比值最高可达0.88。因此,NIII2菌能快速利用丁二酸启动蛋白质合成胞外分泌物,蛋白质与糖含量的提高,增加了微生物絮凝剂中大分子官能团的数量,絮凝剂的产量随之提高,絮凝活性也得到提高。

图2 共存碳源对NIII2菌所产絮凝剂蛋白质与糖含量比值的影响
2.2.2 共存碳源对NIII2菌产絮凝剂红外光谱的影响
测定共存碳源存在下所产絮凝剂的红外光谱,结果如图3所示。由图3结果看,~3 240 cm-1处中等强度、且较宽的吸收带为-OH和-NH伸缩振动峰,絮凝剂中有分子间和分子内氢键存在,其中羟基主要来自于糖环,氨基主要来自于蛋白质;与柠檬酸、乙酸、乳酸共存时相比,丁二酸为共存碳源时此峰最为明显,即蛋白质含量最高。 ~2 920 cm-1处吸收带为C-H不对称的伸缩振动吸收峰,并且吸收峰较小,说明发酵所产絮凝剂分子中C-H键的数量较少。~1638 cm-1处宽峰是由仲酰胺基(-NHC=O-)的C=O 键伸缩振动造成的,可以看出絮凝剂分子中蛋白肽链主要为无规则卷曲和螺旋状;~1 373 cm-1、~1 232 cm-1所看到的不太尖的吸收峰是C—H 的变角振动;~1 076 cm-1、~1 031 cm-1处较强的吸收峰,说明共存碳源存在下所产絮凝剂为以O-链接的糖蛋白结构;当乙酸、丁二酸为共存碳源时此峰较大,说明絮凝剂分子中糖的含量有所提高。红外光谱图测定结果与图2中所测蛋白质与糖的含量结果吻合。

图3 共存碳源对NIII2菌产絮凝剂红外吸收特性的影响
2.2.3 共存碳源对NIII2菌产絮凝剂粒径分布的影响
共存碳源存在下所得絮凝剂的粒径分布如图4所示,可得出,共存碳源对NIII2菌分泌所产絮凝剂粒径有显著影响。柠檬酸共存时,90%的絮凝剂分子粒径在25 μm以下,大粒径分子较少。丁二酸、乙酸、乳酸为共存碳源时,絮凝剂分子粒径明显变大且分布广泛,大粒径所占比例增加而小粒径所占比例大大减少,表明聚合度较大的絮凝剂比例提高。尤其是丁二酸共存时,65%的絮凝剂分子粒径分布在150 μm ~300 μm,仅有28%分布在0 μm ~115 μm,而25 μm以下所占比例仅约10%。因此,投加共存碳源可使NIII2菌所产絮凝剂粒径分布广泛,絮凝剂聚合度明显变大,且大粒径分子比例的增大使其有足够的空间位点和较强的网捕作用,更加彻底有效地除去胶粒。
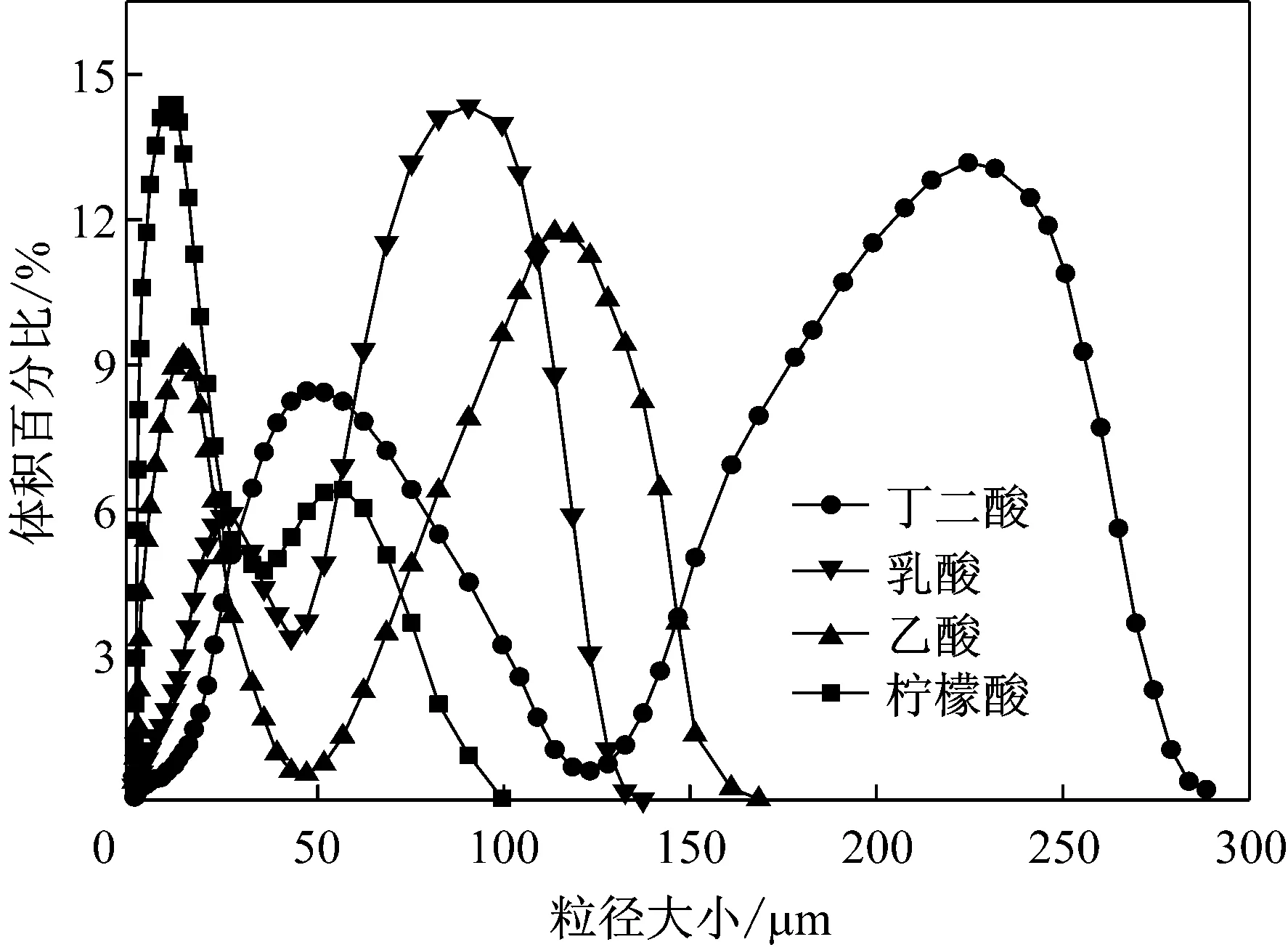
图4 共存碳源对NIII2菌产絮凝剂粒径分布的影响
2.2.4 共存碳源对NIII2菌所产絮凝剂活性及荷电特性的影响
分别测定共存碳源存在下所产絮凝剂的絮凝活性和Zeta电位[10],结果如图5所示,P值(0.006)<0.05,共存碳源存在下,NIII2菌产絮凝剂絮凝活性存在显著性差异。由图5结果看,当投加柠檬酸时,所产絮凝剂Zeta电位较低,低于-60.0 mV,可能由于所产絮凝剂中含有羧基或其他酸性官能团,当乙酸和乳酸为共存碳源时,所产絮凝剂Zeta电位值有小幅提高,而丁二酸为共存碳源时,所产絮凝剂Zeta电位明显提高,约为-28.07 mV。同时,该絮凝剂活性也是最高。与柠檬酸、乙酸、乳酸等共存碳源相比,前者所产絮凝剂处理高岭土所产生的SS时,絮体形成和沉淀速度快,处理后水样很快澄清透明。可见,共存碳源不仅影响絮凝剂中蛋白质含量,同时对所产絮凝剂荷电特性影响较大,进而影响絮凝活性。图5中絮凝活性与图2中所测蛋白质与糖含量的比值结果一致,所以絮凝剂活性随蛋白质与糖含量的比值的增高而变大。
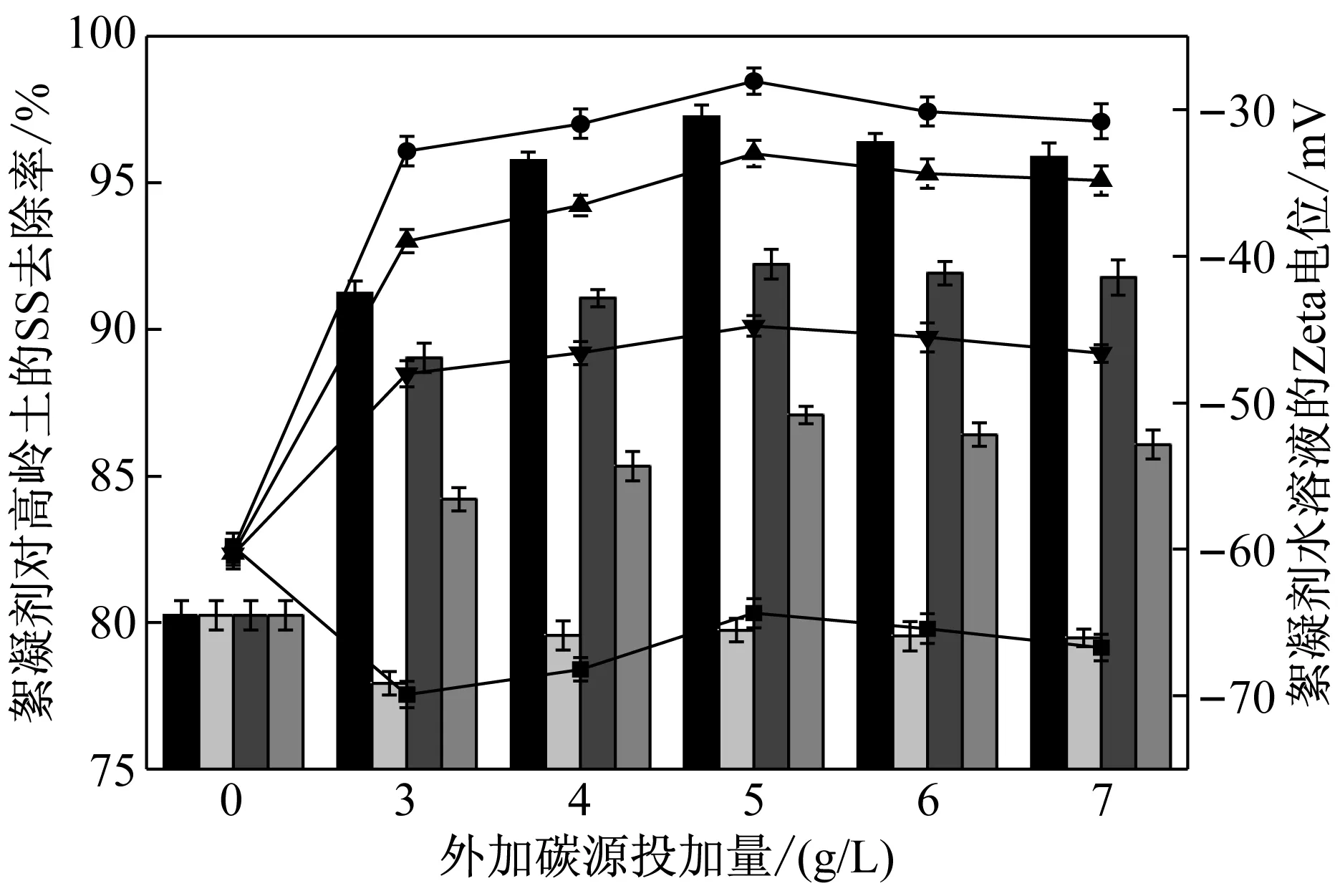

图5 共存碳源对NIII2菌所产絮凝剂活性及荷电特性的影响
2.3 共存碳源对NIII2菌所产絮凝剂表面形貌的影响
利用扫描电镜拍摄共存碳源存在下絮凝剂的表面结构,结果如图6所示。由图6结果看,不同种类的共存碳源存在下,NIII2菌所产絮凝剂表面形貌不同。当柠檬酸钠共存时(如图6b),NIII2菌所产絮凝剂的表面存在大量的细小结晶状,这与絮凝剂蛋白含量少,小分子粒径所占比例越大有关。乳酸共存时(如图6d),NIII2菌所产絮凝剂表面形态与柠檬酸为共存碳源时相似,只是线状结晶含量减少,出现少量颗粒状结晶。乙酸共存时(如图6c),NIII2菌所产絮凝剂表面线状结晶消失,均为颗粒状结晶。而丁二酸共存时(如图6a),NIII2菌所产絮凝剂由于蛋白含量较高,大分子粒径所占比例越大,因此微生物絮凝剂的表面呈现无定型的块团状分布。


a.丁二酸 b.柠檬酸 c.乙酸 d.乳酸
图6 共存碳源对NIII2菌产絮凝剂扫描电镜图
3 结论
3.1 当发酵培养基中投加柠檬酸时,发酵液pH降低,同时使所得絮凝剂产量和碳源转化率较低。而NIII2菌以丁二酸、乙酸、乳酸为共存碳源时,72 h后发酵液pH均提高,絮凝剂产量也可高达并稳定在9.5~10.9 g/L范围内。尤其是丁二酸为碳源时,最终pH由7.50升至8.25,絮凝剂产量可达最高10.87 g/L,碳源转化率高达43.48%。
3.2 与柠檬酸共存相比,丁二酸、乙酸、乳酸为共存碳源时,能使絮凝剂中蛋白质与糖含量比值分别提高33 %、16 %、13 %,并提高絮凝剂的荷电特性,使絮凝剂分子粒径广泛分布于0~300 μm范围内,且小粒径分子所占比例减小,大粒径分子所占比例提高,聚合度增大,絮凝剂表面呈现不规则分布,块团状无定型结构,从而稳定絮凝剂活性和性能。当该絮凝剂投加量为4.0 mg/L时,可使2 g/L高岭土的SS去除率达到97.3%。
[1] Nwodo UU, Green E, Okoh AI. Bacterial Exopolysaccharides: Functionality and Prospects [J]. Int. J Mol Sci, 2012,13(30):14002-14015.
[2] Xiong YY, Wang YP, Yu Y,etal. Production and characterization of a novel bioflocculant from Bacillus licheniformis [J]. Appl Environ Microbiol., 2010, 76(9): 2778-2782.
[3] Takeda M, Kurane R, Koizumi J,etal. A Protein Bioflocculant Produced byRhodococcuserythropolis. Agricultural and biological chemistry, 1991, 55(10): 2663-2664.
[4] 马放,刘俊良,李树更等. 复合型微生物絮凝剂的开发. 中国给水排水,2003,19(4): 1-4.
[5] 孟强,梁雪琴,陈华等. 壳聚糖对嘧啶核苷类新型抗真菌抗生素发酵液絮凝除菌作用的研究. 工业微生物,2010,40(5): 45-48.
[6] Luo P, Luo GY, Cai JW,etal. Optimum Culture Condition for Microbial Flocculantproducing Bacteria. China Water & Wasterwater, 2005, 20(6): 24-26.
[7] San KY, Bennett GN, Berríos-Rivera SJ,etal. Metabolic engineering through cofactor manipulation and its effects on metabolic flux redistribution inEscherichiacoli. Metab Eng,2002,4(2):182-192.
[8] 贾建慧.产微生物絮凝剂优良菌的筛选及絮凝特性研究.西安: 西安建筑科技大学硕士学位论文, 2006.
[9] 王薇. 产絮菌合成生物絮凝剂特性及絮凝成分解析. 哈尔滨: 哈尔滨工业大学博士学位论文, 2009.
[10] 吴小杰,何宁,孙道华等. 金属离子对生物絮凝剂REA-11合成的影响. 工业微生物,2006,36(2): 48-51.
Effects of co-carbon source compounds on production of bioflocculant by Klebsiella sp. NIII 2 with sucrose
BAI Xue-rui, NIE Mai-qian, XIE Zheng-sheng, SONG Bo-xuan, NIE Hong-yun
School of Environmental and Municipal Engineering, Xi’an University of Architecture and Technology, Xi’an 710055, China
Effects of co-carbon source compounds on the production of bioflocculant byKlebsiellasp.NIII2 with sucrose were investigated. The results showed that with citrate as co-carbon source compounds in fermentation medium,NIII2 was easy to produce acid, which often resulted in decrease of the bioflocculant yield and carbon conversion rate. With succinic acid, acetate or lactate as co-carbon source, the values of pH were higher than 7.5, the yield could reach the highest of 10.87 g/L and the carbon conversion rate was as high as 43.48%. Compared with citrate as co-carbon source, succinate as co-carbon source could make the ratio of protein and saccharide increase by 33%; Zeta potential flocculation activity was improved from -60.00 mV to -28.07 mV; the particle size of bioflocculant widely distributed in the range of 0~300 μm and the proportion of large particle size was augmented. With the increasing high degree polymerization of the bioflocculant and with flocculation surface rendering agglomerate amorphous structure, it improved the flocculation activity and performance. With a 4.0 mg/L dose of such bioflocculant, the removal rate of the suspended solid in kaolin solution (2 g/L) was up to 97.3%.
co-carbon source;Klebsiellasp.NIII2; microbial flocculant; carbon conversion rate
10.3969/j.issn.1001-6678.2016.06.007
陕西省重点科技创新团队建设计划(编号:2013KCT-13);国家自然科学基金(编号:51278405)。
白雪蕊(1989~),女,硕士研究生,研究方向为微生物絮凝剂的研究与应用工作。E-mail:Beryl0280@163.com。
*通信作者: 聂麦茜,女,博导,教授。E-mail:niemaiqian@xauat.edu.cn。

