细胞间粘附分子-1在间质性膀胱炎大鼠动物模型膀胱炎症中的作用
张 祥,邵 远,许天源,王先进,沈周俊
(上海交通大学医学院附属瑞金医院泌尿外科,上海 200025)
·基础研究·
细胞间粘附分子-1在间质性膀胱炎大鼠动物模型膀胱炎症中的作用
张 祥,邵 远,许天源,王先进,沈周俊
(上海交通大学医学院附属瑞金医院泌尿外科,上海 200025)
目的 探索间质性膀胱炎(IC)大鼠膀胱组织中细胞间粘附分子-1与膀胱炎症反应的关系及其作为IC治疗新靶点的价值所在。方法 雌性SD大鼠分为对照组、模型组和抗体治疗组,腹腔注射环磷酰胺联合膀胱灌注鱼精蛋白和脂多糖构建IC的大鼠模型,模型鼠膀胱灌注抗ICAM-1抗体进行治疗为抗体组。比较各组大鼠膀胱组织的炎症反应程度、肥大细胞浸润数目以及膀胱组织中P2X3、PGE2、EP2受体、TNF-α和ICAM-1的表达水平。结果 模型组大鼠膀胱组织炎症程度、肥大细胞浸润数目以及P2X3、PGE2、EP2受体、TNF-α和ICAM-1的表达水平均显著高于对照组;当IC模型大鼠给予抗体治疗后,所有指标较模型组均显著显下降,且同对照组相比无显著差异。此外ICAM-1与膀胱组织炎症程度和肥大细胞浸润数目均呈正性相关。结论ICAM-1在IC膀胱组织的炎症反应中起到关键性作用,有望成为治疗IC患者膀胱组织反应的新的靶向分子。
间质性膀胱炎;细胞间粘附分子1;膀胱炎症反应
膀胱疼痛综合症/间质性膀胱炎(bladderpainsyndrome/interstitialcystitis,BPS/IC,以下简称IC)是一种非细菌性的膀胱炎症性疾病,主要表现为耻骨弓上区痛及昼夜的尿急、尿频[1]。根据2009年宋波等[2]的报道,目前中国IC的发病率约为100/10万人。针对IC的病理生理学因素已有众多的相关研究,但其确切的病理生理学机制尚无明确答案。根据既往的研究报道,IC可能是多种因素共同导致的,研究显示嘌呤能受体P2X3、前列腺素E2(prostaglandinE2,PGE2)及其受体EP2、肿瘤坏死因子-α(tumornecrosisfactor-α,TNF-α)和细胞间粘附分子-1(intercellularadhesionmolecule1,ICAM-1)均参与IC膀胱组织的炎症反应[3-6]。
ICAM-1在炎症反应中起到十分重要的作用,主要包括促进肥大细胞激活后释放多种炎症因子,诱导白细胞向炎症区域聚集以及增加血管内皮细胞间隙,引起血浆外渗导致水肿[7]。GREEN等[8]发现在IC患者的膀胱组织中ICAM-1的表达明显增加。SHAO等[5,9]发现膀胱灌注透明质酸能够显著缓解IC患者临床症状,后续的研究表明这一作用与透明质酸显著降低膀胱组织中ICAM-1的表达密切相关。此外研究尚显示ICAM-1和P2X3、PGE2、EP2以及TNF-α之间均存在着直接或者间接的关系[10-12]。因此我们推测ICAM-1在IC中起到关键性的作用,并且有望成为控制IC膀胱炎症反应的治疗新靶点。
在本研究中,我们采用腹腔注射环磷酰胺(cyclophosphamide,CYP)联合膀胱灌注鱼精蛋白(protaminesulfate,PS) 和脂多糖(lipopolysaccharide,LPS)构建IC的大鼠动物模型,因为既往研究显示该动物模型能够显示重度的膀胱炎症、更多的肥大细胞浸润,可模拟临床上重症IC的膀胱组织学表现[5]。在本研究中我们使用该大鼠模型,并给予抗ICAM-1抗体进行干预,以探讨ICAM-1在间质性膀胱炎膀胱组织炎症反应中的作用以及作为治疗靶点的效果。
1 材料与方法
1.1 材料 选用SPF级SD雌性大鼠27只(12周龄,体重250~300g),饲养于上海交通大学医学院附属瑞金医院实验医学研究中心[SCXK(沪)2011-0113]。膀胱灌注用PS(30mg/mL)和LPS(2mg/mL)均购自美国圣路易斯的Sigma公司。抗ICAM-1抗体购自于英国Abcam公司,质量浓度为0.5mg/mL,每只大鼠膀胱灌注 0.1mL。膀胱灌注前采用30g/L的戊巴比妥钠(50mg/kg)腹腔麻醉。
1.2 分组 研究纳入模型组大鼠和抗ICAM-1抗体治疗的模型大鼠各10只,并以7只正常大鼠作为对照。各组处理方式如下。
1.2.1 对照组 大鼠腹腔注射1mL生理盐水,然后以1mL常温生理盐水膀胱灌注。
1.2.2IC模型组 以150mg/kg的比例将环磷酰胺(CYP)溶解在1mL的生理盐水中,注射入大鼠腹腔。膀胱灌注前以3%的无巴比妥钠(50mg/kg)腹腔注射进行麻醉。然后将鱼精蛋白(PS,0.5mL/只)灌入大鼠膀胱中并保留30min,然后以生理盐水冲洗膀胱,再将脂多糖(LPS,0.5mL/只)灌入膀胱内并保持45min,然后用生理盐水将膀胱冲净。将大鼠单独防止在饲养笼内,让其恢复苏醒并自由活动。
1.2.3 抗体治疗组 模型鼠每次膀胱灌注LPS并保持45min后,用生理盐水将膀胱冲洗干净,再向膀胱灌注0.1mL的抗ICAM-1抗体(0.5mg/mL)并保持30min。
所有操作均在48h后重复进行,第4天将大鼠采用颈椎脱臼法处死后进行膀胱组织取材。
1.3 组织学检测 大鼠膀胱组织取材后分为两半,一半存放于液氮中用于相关细胞因子和受体的检测,另一半保存在4%的甲醛溶液中固定。将固定后的膀胱组织制成约5μm厚度的切片,一部分用于HE染色判定膀胱组织的炎症程度,另一部分用甲苯胺兰进行肥大细胞染色,观察浸润最明显的区域的10个视野(×400)的肥大细胞浸润数目,取其中位数作为该标本的浸润数目。
1.4 细胞因子和受体测定 将保存于液氮中的组织剪开搅碎后,置于离心机中充分离心20min(3 000r)后提取组织液,并进行P2X3、PGE2、EP2、TNF-α和ICAM-1的测定,采用ELISA试剂盒(BiosourceInternational,Inc,CA,USA)检测。
1.5 数据分析 采用SPSS20.0进行数据分析,定量的数据采用非参数分析法Kruskal-Wallis进行组间对比检验。相关性检验使用Pearson回归分析法。P<0.05为差异有统计学意义。
2 结 果
模型组大鼠死亡1只,考虑死于麻醉后的窒息,其余组大鼠均无死亡。膀胱组织炎症程度根据HE染色结果分为4个等级,一级:正常膀胱组织学表现,即对照组大鼠膀胱组织学表现;二级:黏膜下层出现不同程度的水肿;三级:出现明显尿路上皮层的变薄或者脱落;四级:以上任意现象,同时伴有黏膜下层的出血或者微血管内的瘀血现象。在对照组大鼠的膀胱组织中无明显炎症反应(图1A),而在IC模型大鼠中可见到明显的尿路上皮层脱落以及黏膜下层的水肿,同时伴有黏膜下层的出血和微血管内的瘀血现象(图1B)。当IC模型大鼠给予抗ICAM-1抗体膀胱灌注后,膀胱组织学表现较模型组大鼠明显改善,尿路上皮层无明显脱落,黏膜下层的水肿也明显减轻,黏膜下层的出血和微血管内的瘀血不可见(图1C)。通过对各组大鼠的膀胱组织炎症程度进行统计学分析后发现模型组大鼠膀胱组织的炎症程度要明显高于对照组,而在给予抗ICAM-1抗体处理后,膀胱组织炎症程度明显下降且达到正常水平(表1)。
甲苯胺兰染色结果显示模型组大鼠膀胱组织中肥大细胞浸润数目显著高于对照组(P<0.001)。当模型大鼠给予抗ICAM-1抗体膀胱灌注后膀胱组织中肥大细胞数目较模型组相比显著下降(P=0.01),而同对照组相比无明显差异(P=0.125,表1,图1D)。
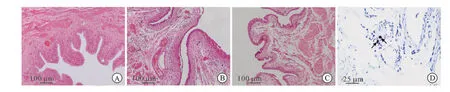
图1 各组大鼠膀胱组织的炎症性改变
A~C:HE染色,×100;D:甲苯胺兰染色,×400;A:对照组,膀胱组织学表现正常;B:模型组,严重的膀胱组织炎症反应;C:抗ICAM-1抗体组:轻度的炎症性改变;D:模型组大鼠膀胱组织中肥大细胞(黑色箭头所指出)。
表1 各组膀胱组织炎症程度和肥大细胞浸润数目
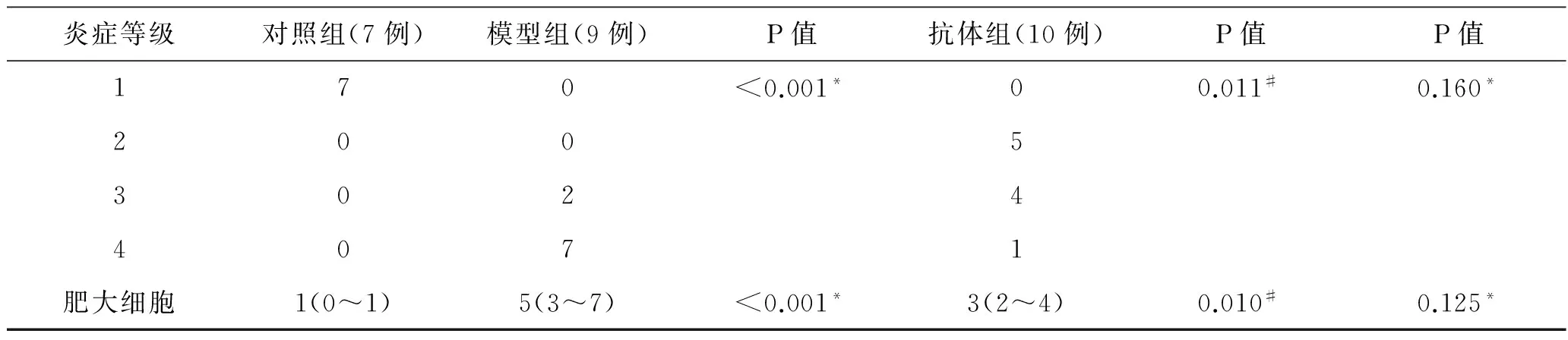
炎症等级对照组(7例)模型组(9例)P值抗体组(10例)P值P值170<0.001*00.011#0.160*200530244071肥大细胞1(0~1)5(3~7)<0.001*3(2~4)0.010#0.125*
注:三组间两两比较采用非参数分析法Kruskal-Wallis检验,P<0.05为差异有统计学意义。*与对照组相比;#与模型组相比。
在膀胱组织中各种细胞因子和受体的检测结果中可以发现,模型组大鼠膀胱组织中P2X3(280.87±0.17)、PGE2(160.35±19.78)、EP2受体(80.21±9.99)、TNF-α(123.14±15.99)和ICAM-1(334.18±41.78)的表达水平均显著高于对照组P2X3(42.11±7.21)、PGE2(15.06±0.02)、EP2受体(5.04±0.01)、TNF-α(10.83±0.16)和ICAM-1(40.28±5.76)(P均<0.001)。与模型组相比较,P2X3(140.46±18.09)、PGE2(18.80±0.79)、EP2受体(8.54±1.50)、TNF-α(21.82±0.84)和ICAM-1(125.06±15.98)在抗ICAM-1抗体组中均出现显著下降,且接近基础水平(与对照组相比无显著差异,图2)。相关性分析结果显示膀胱组织中ICAM-1的表达水平与膀胱组织的炎症程度(r=0.705)和肥大细胞的浸润数目(r=0.680)均呈显著性正相关。

图2 各组大鼠膀胱组织中细胞因子和受体的表达情况 (平均值±标准误)
注:抗体组:模型大鼠+抗ICAM-1抗体膀胱灌注;组间两两比较采用非参数分析法Kruskal-Wallis检验,P<0.05认为有统计学意义;组间比较,*P<0.05,***P<0.001。对照组与抗体组相比较并无明显差异。
3 讨 论
膀胱疼痛综合症/间质性膀胱炎(PBS/IC,以下简称IC)主要表现为尿频、尿急、尿痛,以及耻骨弓上区的疼痛不适感,给患者的正常生活带来了极其严重的困扰,大大降低了患者的生活质量[1]。但是截止到目前针对IC的病理生理学因素尚无确切的结论,从而导致目前临床上尚无十分有效的能够控制IC发生发展的药物。先前的研究表明在IC患者的膀胱组织中ICAM-1呈明显的高表达状态,此外透明质酸膀胱灌注治疗IC与其降低了IC患者膀胱组织中的ICAM-1的表达密切相关[5,8]。ICAM-1是免疫球蛋白超家族中的一员,在炎症反应中的主要作用包括激活肥大细胞并释放多种炎症介质、介导炎症细胞向炎症反应区域聚集加重炎症反应以及增加血管壁通透性导致水肿[13]。基于以上背景研究,我们认为ICAM-1在BPS/IC膀胱组织炎症发生发展的过程中可能起到重要作用,且可能成为治疗膀胱组织炎症的新靶向分子。
BPS/IC的膀胱组织学改变主要表现为尿路上皮层的变薄、黏膜下层的水肿和出血以及肥大细胞的浸润[14]。在本研究中,我们采用腹腔注射CYP联合膀胱灌注PS和LPS构建BPS/IC的大鼠模型,通过HE染色结果可以发现其膀胱组织中出现明显的尿路上皮层的脱落,以及黏膜下层的出血和水肿(图1),膀胱组织中肥大细胞的浸润数目也显著高于对照组(表1)。因此我们认为该大鼠模型基本上能够模拟BPS/IC膀胱组织学改变的特点。在我们给予模型大鼠抗ICAM-1抗体膀胱灌注处理后,膀胱组织的炎症性改变明显减轻,仅出现尿路上皮层的变薄和黏膜下层的水肿,其膀胱组织的炎症程度和肥大细胞的浸润数目较模型组均出现的显著的下降,且同对照组相比并无显著差异。(表1)由此可见阻断ICAM-1对控制膀胱组织的炎症反应具有明显的效果。
既往研究已经证实嘌呤能受体P2X3、PGE2、EP2受体和TNF-α均参与了BPS/IC的病理生理学过程[3-4,6]。三磷酸腺苷通过作用于膀胱组织感觉神经末梢上的P2X3受体可以引起感觉神经纤维的阈值降低从而导致感觉敏感化,引起尿频和膀胱区域的不适感;另一方面三磷酸腺苷还可以通过作用于血管内皮细胞直接促进ICAM-1的表达,从而加重局部的炎症反应[11,15]。研究表明在BPS/IC患者的膀胱组织中PGE2及其受体EP2的miRNA的表达水平均显著增高,而PGE2能够通过EP2受体直接促进ICAM-1的表达[3,10]。ICAM-1在人体内的分泌主要依赖于TNF-α途径和NF-κB途径,而PGE2对于体内TNF-α具有一定的调节作用[16]。由此可见ICAM-1和上述的细胞因子或者受体之间均存在着直接或者间接的关系。在本研究中,当模型大鼠给予抗ICAM-1抗体处理后,膀胱组织中P2X3、PGE2、EP2受体、TNF-α和ICAM-1较模型组均出现了显著下降,且同对照组相比并无显著差距。由此可见抗ICAM-1抗体可以显著抑制BPS/IC模型大鼠膀胱组织中与炎症反应密切相关的细胞因子和受体。因此ICAM-1可以作为控制BPS/IC患者膀胱组织炎症反应的治疗靶向分子。
本研究的局限之处在于未能够检测抗体治疗后与BPS/IC疼痛相关的生理学指标,例如大鼠的痛觉反应与痛阈变化。本研究小组下一步的研究重点将会关注膀胱组织中ICAM-1的表达水平与大鼠疼痛反应和排尿次数的关系,以及阻断ICAM-1生理学作用后,BPS/IC模型大鼠这些生理学指标的改变情况。
综上所述,抗ICAM-1抗体不仅能够从组织学水平上控制BPS/IC模型大鼠的膀胱组织炎症反应,同时还能够从分子学水平上抑制膀胱组织炎症因子表达。因此我们认为ICAM-1在BPS/IC膀胱组织炎症的发生发展中具有十分重要的作用,随着研究深入,有望成为治疗BPS/IC的新靶向分子。
[1]HANNOPM,ERICKSOND,MOLDWINR,etal.Diagnosisandtreatmentofinterstitialcystitis/bladderpainsyndrome:AUAguidelineamendment[J].JUrol,2015,193(5):1545-1553.
[2]BERRYSH,ELLIOTTMN,SUTTORDM,etal.Prevalenceofsymptomsofbladderpainsyndrome/interstitialcystitisamongadultfemalesintheUnitedStates[J].JUrol,2011,186(2):540-544.
[3]WADAN,AMEDAK,FURUNOT,etal.EvaluationofprostaglandinE2andE-seriesprostaglandinreceptorinpatientswithinterstitialcystitis[J].JUrol,2015,193(6):1987-1993.
[4]ZHANGHP,LICL,LUP,etal.ThefunctionofP2X3receptorandNK1receptorantagonistsoncyclophosphamide-inducedcystitisinrats[J].WorldJUrol,2014,32(1):91-97.
[5]SHAOY,LUGL,SHENZJ,etal.Reductionofintercellularadhesionmolecule1mayplayaroleinanti-inflammatoryeffectofhyaluronicacidinaratmodelofseverenon-bacterialcystitis[J].WorldJUrol,2013,31(3):535-540.
[6]RUDICKCN,BRYCEPJ,GUICHELAARLA,etal.Mastcell-derivedhistaminemediatescystitispain[J].PLoSOne,2008,3(5):e2096.
[7]CLARKPR,MANESTD,POBERJS,etal.IncreasedICAM-1expressioncausesendothelialcellleakiness,cytoskeletalreorganizationandjunctionalalterations[J].JInvestDermatol,2007,127(4):762-774.
[8]GREENM,FILIPPOUA,SANTG,etal.Expressionofintercellularadhesionmoleculesinthebladderofpatientswithinterstitialcystitis[J].Urology,2004,63(4):688-693.
[9]SHAOY,SHENZJ,RUIWB,etal.Intravesicalinstillationofhyaluronicacidprolongedtheeffectofbladderhydrodistentioninpatientswithsevereinterstitialcystitis[J].Urology,2010,75(3):547-550.
[10]TAKAHASHIHK,IWAGAKIH,YOSHINOT,etal.ProstaglandinE-2inhibitsIL-18-inducedICAM-1andB7.2expressionthroughEP2/EP4receptorsinhumanperipheralbloodmononuclearcells[J].JImmunol,2002,168(9):4446-4454.
[11]SEIFFERTK,DINGW,WAGNERJA,etal.ATPgammaSenhancestheproductionofinflammatorymediatorsbyahumandermalendothelialcelllineviapurinergicreceptorsignaling[J].JInvestDermatol,2006,126(5):1017-1027.
[12]COOKEB,STAHLJL,MILLERST,etal.Isolationofhumanconjunctivalmastcellsandepithelialcells:tumornecrosisfactor-alphafrommastcellsaffectsintercellularadhesionmolecule1expressiononepithelialcells[J].InvestOphthalmol&VisualSci,1998,39(2):336-343.
[13]SETHR,RAYMONDFD,MAKGOBAMW.CirculatingICAM-1isoforms:diagnosticprospectsforinflammatoryandimmunedisorders[J].Lancet,1991,338(8759):83-84.
[14]KIMHJ.Updateonthepathologyanddiagnosisofinterstitialcystitis/bladderpainsyndrome:Areview[J].IntNeurourolJ,2016,20(1):13-7.
[15]ANDERSSONKE.Purinergicsignallingintheurinarybladder[J].AutonomicNeurosci:Basic&Clinical,2015,191:78-81.
[16]COLLINST,READMA,NEISHAS,etal.Transcriptionalregulationofendothelialcelladhesionmolecules:NF-kappaBandcytokine-inducibleenhancers[J].FASEBJ,1995,9(10):899-909.
(编辑 王 玮)
The role of intercellular adhesion molecule 1 in inflammatory response of bladder tissue in a rat model of interstitial cystitis
ZHANG Xiang,SHAO Yuan,XU Tian-yuan,WANG Xian-jin,SHEN Zhou-jun
(DepartmentofUrology,RuiJinHospital,SchoolofMedicine,ShanghaiJiaotongUniversity,Shanghai200025,China)
ObjectiveToevaluatetherelationshipbetweenintercellularadhesionmolecule1 (ICAM-1)andbladdertissueinflammationandthevalueofICAM-1actingasanewtherapeutictargetinaratmodelofinterstitialcystitis(IC).MethodsICratmodelswereinducedbycombinationofintraperitonealcyclophosphamidewithintravesicalprotamine/lipopolysacharide. 0.1mLanti-ICAM-1antibodywasdrippeclintorats’bladderfollowinglipopolysacharideinantibodygroup.BladdertissueswerepreparedforhistologyevaluationincludinginflammationgradeandinfiltrationofmastcellsandtheexpressionsofP2X3,PGE2,EP2receptor,TNF-αandICAM-1.ResultsICratmodelspresentedenhancedinflammationgradeandincreasednldmberofmastcellscomparedtothecontrolgroup(P<0.001),whichweresignificantlyblockedbyanti-ICAM-1antibody.TheexpressionlevelsofP2X3,PGE2,EP2receptor,TNF-αandICAM-1wereremarkablyhigherthanthoseofthecontrolgroup.AfterICratsweretreatedbyintravesicalanti-ICAM-1antibody,thelevelsofallcytokinesandreceptorsweresignificantlydecreasedandreducedtobaseline.ConclusionICAM-1canplayanimportantroleinbladderinflammationofICandmaybeusedasanewtherapeutictargetforIC.
interstitialcystitis;intercellularadhesionmolecule1;bladderinflammation
2016-05-04
2016-08-03
国家自然科学基金面上项目(No. 81270846)
沈周俊,教授,主任医师,博士研究生导师.E-mail:shenzj6@sina.com
张祥(1988-),男(汉族),硕士在读.研究方向:膀胱非感染性炎症.E-mail:15556186590@163.com
R
A
10.3969/j.issn.1009-8291.2016.12.015

