新型循环肿瘤细胞计数与上皮/间质型探针标记技术在膀胱癌中的临床应用
张瑞赟,金 迪,曹 明,陈海戈,薛 蔚,黄翼然
(上海交通大学医学院附属仁济医院泌尿科,上海 200127)
·临床研究·
新型循环肿瘤细胞计数与上皮/间质型探针标记技术在膀胱癌中的临床应用
张瑞赟,金 迪,曹 明,陈海戈,薛 蔚,黄翼然
(上海交通大学医学院附属仁济医院泌尿科,上海 200127)
目的 本研究旨在探索在膀胱肿瘤中,新型循环肿瘤细胞(CTC)计数技术与基于RNA原位杂交的上皮/间质型探针标记技术的临床应用价值,初步探索上皮-间质转化在循环肿瘤细胞的作用与膀胱肿瘤肌层浸润的关系。方法 本研究纳入2015年5月至10月我院诊治的膀胱癌患者(cT1~4aN0M0)115名,同时纳入25名健康志愿者作为对照组。采用改良的CanPatrolTM法分离富集CTC,应用上皮型(Epi)探针(EpCAM、CK8/18/19)和间质型(Mes)探针(Twist、Vimentin)通过RNA原位杂交(RNA-ISH)对分离得到的CTC细胞进行EMT标记。结果 115名膀胱癌患者中93例(81%)患者为CTC阳性,健康志愿者共检测到CTC 0个(P<0.001)。对CTC进行RNA-ISH,发现肌层浸润型膀胱癌患者外周血CTC(P=0.049)、混合型CTC(P=0.018)及间质型CTC(P<0.001)的检出阳性率显著高于非肌层浸润性膀胱癌。pT1患者外周血CTC(P<0.001)、上皮型CTC(P=0.001)与混合型CTC(P<0.001)显著高于pTa患者。结论 新型循环肿瘤细胞(CTC)计数与基于RNA原位杂交的上皮/间质型探针标记技术可较敏感的检测出膀胱癌患者循环肿瘤细胞。间质表型CTC可能与肿瘤肌层浸润相关,提示EMT与膀胱肿瘤肌层浸润可能存在相关性。
膀胱癌;循环肿瘤细胞;上皮间质转化;肿瘤浸润; RNA原位杂交
膀胱癌(bladder carcinoma,BC)是泌尿系统最常见的恶性肿瘤,位居世界范围内恶性肿瘤发病率第五位,每年全球新发病例约336 000例,死亡132 000例[1]。在我国,男性膀胱癌发病率位于全国恶性肿瘤的第七位且发病率逐年上升。70%的患者在初诊时为非肌层浸润性膀胱癌(nonmuscle invasive bladder cancer,NMIBC),预后较好,但30%的患者为肌层浸润性膀胱癌(muscle invasive bladder cancer,MIBC),50%肌层浸润性膀胱癌的接受根治手术前既已发生微转移灶,即使接受积极治疗亦不可避免地在2年内发生远处转移[2]。
研究表明实体瘤在最初的转移进程中,肿瘤细胞从原发病灶脱落,突破一系列屏障,进而趋化性移动进入淋巴管和血液循环形成循环肿瘤细胞(circulating tumor cells,CTCs)[3]。CTCs从原发病灶或转移病灶脱落进入血液循环的过程中,由于血液中机械剪切力、免疫监视或其他监管机制的作用,大部分肿瘤细胞会发生凋亡或被吞噬,有极小部分肿瘤细胞在血液循环中能够抵御凋亡存活下来,形成微小转移病灶,进一步发展成为临床转移灶[4-5]。肿瘤细胞脱落、侵袭并进入血液循环可能是肿瘤转移的最初阶段[4]。有研究表明对于转移性膀胱癌,CTC阳性的患者预后差于CTC阴性的患者,而对于局部进展期膀胱癌,根治手术前CTC阳性的患者预后要差于阴性的患者,但与肿瘤分期的关系仍然不明确[6-7]。
近期的研究表明,上皮间质转化过程(epithelial-mesenchymal transition,EMT)在CTCs侵袭中具有重要作用:CTCs具有上皮细胞表型、间质细胞表型和上皮-间质混合细胞表型以及循环微小瘤栓(Circulating tumor microemoli,CTM)等不同类型,其中间质型CTCs能够抵御失巢凋亡和耐受细胞毒性药物,比单个肿瘤细胞具有更强的侵袭转移潜能和耐药能力[4,7-9]。本研究基于应用CanPatrolTM,在CTCs计数技术上应用RNA原位杂交的上皮/间质型探针标记技术,探索上皮-间质转化在循环肿瘤细胞细胞中的作用与膀胱肿瘤肌层浸润的关系。
1 资料与方法
1.1 临床资料 本研究纳入标准:初发高危膀胱肿瘤,临床分期为cT1~4aN0M0,病理类型为尿路上皮癌。排除标准为:复发的膀胱肿瘤,临床分期为cTa,影像学显示肿瘤临近脏器侵犯、淋巴结转移或远处转移,有TURBT术或根治性全膀胱切除术禁忌证,病理类型为非尿路上皮癌,合并其他恶性肿瘤。
研究纳入2015年5月至2015年10月在我院诊治的115例膀胱肿瘤患者,在行首次TURBT术前采10 mL外周血。研究同时纳入25例健康志愿者作为对照组。
1.2 CTCs检测 膀胱肿瘤患者在TURBT术前使用EDTA抗凝采血管采集10 mL外周血。对照组健康志愿者使用相同EDTA抗凝采血管采集10 mL外周血。血样在4 h内进行按改良的CanPatrolTM进行预处理[9]。CTC细胞分离采用改良的CanPatrolTM分离技术,技术细节如CanPatrolTM报道文献,严格按照产品说明书操作[9]。通过8 μm直径纳米膜筛孔过滤后,获得分离的CTC细胞。针对分离所得CTC细胞,使用多重RNA-原位杂交技术进行标记鉴定。使用的特异性捕获探针包括上皮型探针(EpCAM,CK8/18/19)、间质型探针(Twist,Vimentin)与CD45。多重RNA-原位杂交具体流程为:①使用特异性捕获探针与目标mRNA进行杂交;②使用扩增探针与捕获探针进行杂交,为杂交信号的放大做准备;③使用标记有荧光基团的标记探针与扩增探针进行杂交,产生荧光信号;④利用自动识别系统阅读荧光。所使用探针序列与材料为CanPatrolTM技术标准方案,细节如文献[9]所示。CD45阳性细胞考虑为血细胞,不计入CTC。上皮型探针阳性间质型探针阴性CTC为上皮型CTC,上皮型探针阳性间质型探针阳性性CTC为混合型CTC,上皮型探针阴性间质型探针阳性性CTC为间质型CTC,如图1所示。
1.3 统计学方法 本研究采用SPSS®21.0(IBM Corp,NY,USA)软件进行统计学分析。分类变量通过Fisher’sexacttest与Pearson’schi-squaredtest进行检验。连续变量通过Mann-WhitneyU-test进行检验。P<0.05差异具有统计学意义。
2 结 果
2.1 临床病理结果 115例患者均顺利完成CTC检测及TURBT术,基本情况如表1所示。其中46例患者接受保留膀胱治疗,69例患者TUR术后接受即刻根治性全膀胱切除术。术后病理根据WHO2004年分级标准,低级别尿路上皮癌6例(5%),高级别尿路上皮癌109例(95%)。根据肿瘤是否侵犯膀胱肌层分类,NMIBC 62例(54%),MIBC 53例(46%)。根据2009年UICC膀胱癌TNM分期标准,pTa 17例(15%),pT1 37例(32%),pTis 8例(7%),pT2 29例(25%),pT3 20例(17%),pT4 4例(3%),pN1 9例(8%),病理合并脉管癌栓9例(8%)。
2.2 CTCs检测结果 对照组25例健康志愿者外周血皆未检测到CTC。115例患者10 mL外周血中检测CTC,93例(81%)患者CTC阳性,其中68例(59%)上皮型CTC阳性,76例(66%)混合型CTC阳性,43例(37%)间质性CTC阳性。共检测到622个CTC,中位数为6个(范围:1~66个),平均数为(5.56±8.17)个,其中上皮型173个(28%),混合型322个(52%),间质型127个(20%)。
2.3 CTCs与病理分期相关 对照组、NMIBC、MIBC患者CTC阳性率与数量如图2所示。NMIBC与MIBC患者体内CTC阳性率与数量显著高于对照组(P<0.001)。NMIBC患者外周血中,46例(74%)CTC阳性,32例(52%)上皮型CTC阳性,35例(56%)混合型CTC阳性,14例(23%)间质性CTC阳性。MIBC患者外周血中,47例(89%)CTC阳性,36例(68%)上皮型CTC阳性,41例(77%)混合型CTC阳性,29例(55%)间质性CTC阳性。MIBC患者外周血总CTC(P=0.049)、混合型CTC(P=0.018)与间质性CTC(P<0.001)阳性率较NMIBC患者显著升高,上皮型CTC未见显著差异(P=0.076)。MIBC患者外周血总CTC数量(P<0.001)、混合型CTC数量(P<0.001)与间质性CTC数量(P=0.002)较非肌层浸润性膀胱癌显著升高,上皮型CTC数量未见显著差异(P=0.075)。
不同病理状态与特征的CTC检测阳性率如图3 所示。对于NMIBC,pT1患者外周血CTC(P<0.001)、上皮型CTC(P=0.001)与混合型CTC(P<0.001)阳性率较pTa患者显著升高,间质性CTC(P=0.211)未见显著差异。对于MIBC,不同病理分期(pT2、pT3、pT4)的CTC阳性率与各亚型CTC阳性率未见显著差异。
病理证实肿瘤侵犯脉管系统(LVI+)的患者与未侵犯(LVI-)的患者CTC阳性率与各亚型CTC阳性率未见显著差异。在接受根治性全膀胱切除术患者中,术后病理证实肿瘤淋巴结转移(pN+)与无淋巴结转移(pN-)患者,CTC阳性率与各亚型CTC阳性率未见显著差异。
表1 患者临床资料

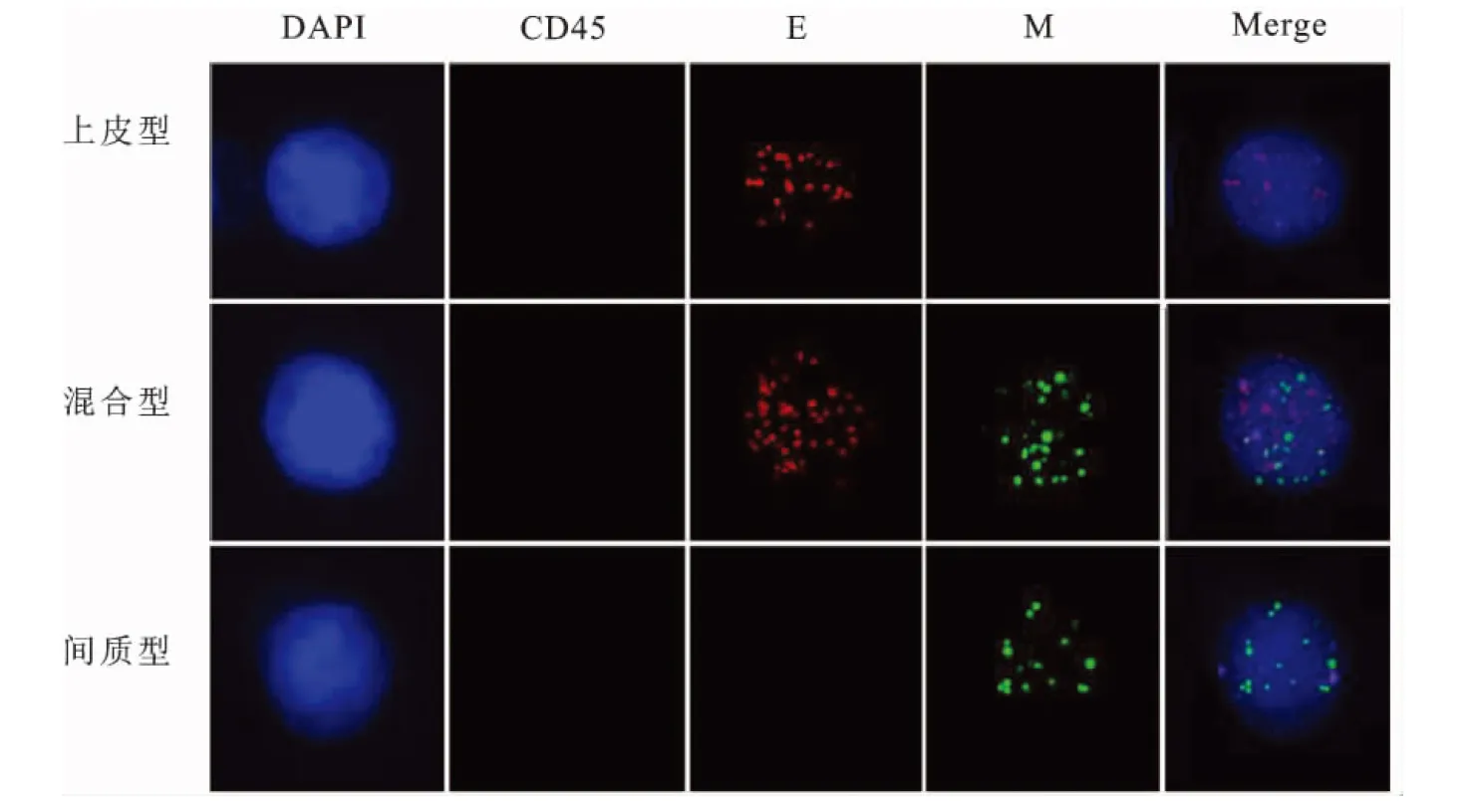
图1 不同EMT分型CTC镜下照片
DAPI:4′,6-diamidino-2-phenylindole;E:上皮RNA探针EpCAM,CK8/18/19;M:间质RNA探针Twist、Vimentin;Merge:融合照。

图2 对照组(健康志愿者)、非肌层浸润性膀胱癌(pT<2)、肌层浸润性膀胱癌(pT≥2)的外周血CTC阳性率与数量
A:肌层浸润性膀胱癌患者外周血总CTC(P=0.049)、混合型CTC(P=0.018)与间质性CTC(P<0.001)阳性率较非肌层浸润性膀胱癌显著升高,上皮型CTC未见显著差异(P=0.076);B、C、D、E:肌层浸润性膀胱癌患者外周血总CTC(P<0.001)、混合型CTC(P<0.001)与间质性CTC(P=0.002)数量较非肌层浸润性膀胱癌显著升高,上皮型CTC数量未见显著差异(P=0.075)。

图3 不同病理参数与其CTC阳性率比较
A:非肌层浸润性膀胱癌中,固有层浸润患者(pT1)外周血CTC(P<0.001)、上皮型CTC(P=0.001)与混合型CTC(P<0.001)阳性率较肿瘤局限黏膜层患者(pTa)显著升高,间质性CTC(P=0.211)未见显著差异;B:肌层浸润性膀胱癌中,不同病理分期(pT2、pT3、pT4)CTC阳性率未见显著差异;C:脉管系统侵犯(LVI+)患者与未侵犯(LVI-)患者CTC阳性率未见显著差异;D:接受根治性全膀胱切除患者,术后病理证实肿瘤淋巴结转移(pN+)与无淋巴结转移(pN-)患者,CTC阳性率未见显著差异。
3 讨 论
约50%的肌层浸润性膀胱癌在术前即发生微转移,利用精准检测技术提前预判微转移灶,为临床干预提供指导是目前研究的热点[3]。CTC检测技术被广泛应用于各种实体瘤的诊断、治疗监测及转移预测中。然而在膀胱癌中,有关CTC的研究较少,应用较局限,结论仍有争议。MSAOUEL和KOUTSILIERIS[10]对于膀胱癌中CTC的研究进行荟萃分析,发现膀胱癌患者外周血可以较敏感的检测到CTC,而晚期膀癌患者体内可检出CTC数量显著较高。目前对于膀胱癌中CTC的研究主要局限于应用CellSearch®系统。在NMIBC中,GAZZANIGA等[11]报道了对44例NMIBC进行外周血CTC检测,结果发现CTC阳性的患者术后复发间隔时间显著较短,且与病理混合原位癌及较高T分期相关。GRADILONE等[12]发现对于T1G3的膀胱肿瘤,外周血所检测到的CTC多表达Survivin,且CTC阳性的患者无疾病生存期显著较短。对于非转移性MIBC,RINK等[13]研究表明在全膀胱术前CTC阳性的患者预后显著较差,然而CTC数量与病理分期无显著相关。FLAIG等[6]研究证明对于转移性膀胱癌,CTC阳性的患者预后显著较差,而对于局限性MIBC,CTC与预后及病理分期无显著关联。以上研究都旨在探索CTC对于膀胱癌的分期与预后的指导作用,然而收到样本量、队列设计等限制,未证明肿瘤肌层浸润与CTC的相关性。
在膀胱肿瘤中,EMT被认为是肿瘤转移重要的环节[4-6]。如何通过评价CTC的EMT表型成为了目前研究的热点。TODENHÖFER等[15]通过对CTC分离并提取mRNA逆转录cDNA,并通过PCR检测cDNA中EMT相关基因(PI3Kα、Twist1和AKT2)发现,EMT相关基因表达与临床分期相关,且常表达于上皮类标记物阴性患者。此结果提示在CTC中,EMT相关基因有表达,且表达具有一定特征性,为后续在CTC单细胞水平进行EMT表达检测提供了基础。
本研究立足于改良的CanPatrolTM技术,将上皮间质转化(EMT)通路相关基因RNA探针整合入CTC检测中,在前期其他实体瘤检测中取得了良好的效果[9,16]。本研究首次在膀胱肿瘤患者外周血内检测分离CTC,并在CTC单细胞水平进行EMT相关基因表达进行检测。研究结果发现通过CanPatrolTM法分离并进行EMT分型可较敏感的分离出膀胱肿瘤患者外周血内的CTC细胞。对照组健康志愿者无一例检出CTC,符合实验预期,无假阳性结果。
本研究旨在探讨外周血CTC与EMT表型对于膀胱肿瘤分期,尤其是肿瘤肌层浸润的相关性与指导作用。因此本研究队列纳入临床诊断为高危的膀胱肿瘤,临床分期cT1~4aN0M0。115例患者术后病理为pTa~4aN0~1M0,95%为高级别尿路上皮癌,符合实验队列设计预期。所有患者CTC检测的总阳性率为81%,高于其他研究报道,可能的原因为CellSearch®系统利用上皮标记物EpCAM作为CTC标记物,导致一部分高表达间质标记物而低或无表达EpCAM的CTC细胞将不被CellSearch®系统识别,而CanPatrolTM系统可将此类CTC细胞标记识别,并引起CTC检测阳性率升高。YU等[5]在乳腺癌中报道了CTC存在EMT动态变化的现象,并发现存在部分CTC细胞仅表达间质相关基因,证明了仅将上皮标记物EpCAM阳性作为CTC的筛选标记物是不足的。TODENHÖFER等[15]的研究结果揭示了存在一部分高表达PI3Kα、TWIST1和AKT2的CTC细胞,且这部分细胞常低或无表达上皮标记物,佐证了我们的观点。
对CTC进行EMT分型后,上皮型CTC阳性率为59%,混合型CTC阳性率为66%,与通过CellSearch®系统检测的结果相接近。在检测出的622个CTC细胞中,上皮标记物阳性(上皮型和混合型)的CTC占80%。结果表明在CTC中,大多数细胞呈上皮表型或表达上皮相关基因,结果符合肿瘤转移EMT理论[5-6]。37%的患者间质性CTC阳性,间质型CTC占所有检出CTC的20%,结果证明了在膀胱肿瘤患者外周血中,存在其他研究中报道的仅表达间质标记物的CTC细胞。
根据最终病理结果中肿瘤是否侵犯肌层,研究队列中54%为NMIBC,46%为MIBC。结果提示MIBC外周血CTC阳性率与数量显著高于NMIBC,其中间质标记物阳性(混合型与间质型)CTC阳性率与数量较NMIBC患者显著升高,结果提示对于高病理分期的肿瘤,其CTC在EMT表型上也有不同。有文献报导,在乳腺癌、胃癌等其他实体肿瘤中,间质表达阳性的CTC与肿瘤高分期、预后较差相关。在膀胱肿瘤中,EMT通路的激活与肿瘤细胞发生上皮间质转化与肿瘤浸润肌层密切相关。在临床上,MIBC的预后显著较NMIBC差,MIBC的患者常发生远处转移,而90%的NMIBC的患者不会发生远处转移。本研究结果在CTC层面验证了膀胱肿瘤浸润肌层后,其微转移病灶阳性比率与数量显著升高,为后续研究提供了方向。
本研究结果表明对于NMIBC的患者,pT1期患者外周血CTC与上皮标记物阳性(上皮型与混合型)CTC检出阳性率显著高于pTa期患者。pT1期膀胱癌有10%~20%会复发、进展为浸润性癌,此类患者易发生远处转移,而pTa期患者进展率较低,极少发生远处转移,研究结果在CTC层面解释了不同分期的预后差别。而对于MIBC患者,研究未发现不同病理分期的CTC阳性率差异,可能的原因为:对于MIBC患者,CTC阳性率较高,在样本量限制条件下,难以获得统计学上显著差异。
对于病理发现淋巴结转移及肿瘤侵犯脉管的患者,本研究未发现CTC阳性率升高,其可能的原因为:肿瘤淋巴结转移机制与血性转移机制不同,无法应用CTC来评估淋巴结转移情况。
本研究通过对于较大样本的CTC检测与EMT分型,验证了通过CanPatrolTM系统可较敏感的检测出膀胱癌患者循环肿瘤细胞。CTC细胞数量与表达间质型表型RNA阳性的细胞数量可能与肿瘤肌层浸润相关,提示EMT与膀胱肿瘤肌层浸润可能存在相关性。本研究仅为单中心回顾性研究,循证证据级别有限,且因随访时间限制未获得生存相关数据。但我们认为研究结果为进一步探索CTC单细胞层面EMT表型与膀胱肿瘤预后,以及研究肿瘤浸润转移机制奠定了基础,有重要的临床与研究意义。研究组已开展前瞻性研究,针对患者预后判断、治疗监测等进行进一步研究。
[1] WU XR. Urothelial tumorigenesis:a tale of divergent pathways [J].Nat Rev Cancer,2005,5(9):713-725.
[2] KNOWLES M A. Molecular subtypes of bladder cancer:Jekyll and Hyde or chalk and cheese? [J]. Carcinogenesis,2006,27(3):361-373.
[3] GALLAGHER D J,MILOWSKY M I,ISHILL N,et al. Detection of circulating tumor cells in patients with urothelial cancer [J]. Ann Oncol,2008,20(2):305-308.
[4] THIERY JP,LIM CT. Tumor dissemination:an EMT affair. [J]. Cancer Cell,2013,23(3):272-273.
[5] YU M,BARDIA A,WITTNER BS,et al. Circulating breast tumor cells exhibit dynamic changes in epithelial and mesenchymal composition[J]. Science,2013,339(6119):580-584.
[6] FLAIG T W,WILSON S,VAN BOKHOVEN A,et al. Detection of circulating tumor cells in metastatic and clinically localized urothelial carcinoma [J]. Urology,2011,78(4):863-867.
[7] PANTEL K,SPEICHER MR. The biology of circulating tumor cells. [J]. Oncogene,2016,35(10):1216-1224.
[8] ACETO N,BARDIA A,MIYAMOTO DT,et al. Circulating tumor cell clusters are oligoclonal precursors of breast cancer metastasis[J]. Cell,2014,158(5):1110-1122.
[9] WU S,LIU S,LIU Z,et al. Classification of circulating tumor cells by epithelial-mesenchymal transition markers. [J]. PLoS ONE,2015,10(4):e0123976.
[10] MSAOUEL P,KOUTSILIERIS M. Diagnostic value of circulating tumor cell detection in bladder and urothelial cancer:systematic review and meta-analysis [J]. BMC Cancer,2011,11(1):336.
[11] GAZZANIGA P,GRADILONE A,DE BERARDINIS E,et al. Prognostic value of circulating tumor cells in nonmuscle invasive bladder cancer:a CellSearch analysis. [J]. Ann Oncol,2012,23(9):2352-2356.
[12] GRADILONE A,PETRACCA A,NICOLAZZO C,et al. Prognostic significance of survivin-expressing circulating tumour cells in T1G3 bladder cancer. [J].BJU Int,2010,106(5):710-715.
[13] RINK M,CHUN F K,DAHLEM R,et al. Prognostic Role and HER2 Expression of circulating tumor cells in peripheral blood of patients prior to radical cystectomy:a prospective study[J]. Eur Urol,2012,61(4):810-817.
[14] BAUMGART E,COHEN M S,NETO B S,et al. Identification and prognostic significance of an epithelial-mesenchymal transition expression profile in human bladder tumors[J]. Clin Cancer Res,2007,13(6):1685-1694.
[15] TODENHÖFER T,HENNENLOTTER J,DORNER N,et al. Transcripts of circulating tumor cells detected by a breast cancer-specific platform correlate with clinical stage in bladder cancer patients [J]. J Cancer Res Clin,2016,142(5):1013-1020.
[16] GUAN X,MA F,LIU S,et al. Analysis of the hormone receptor status of circulating tumor cell subpopulations based on epithelial-mesenchymal transition:a proof-of-principle study on the heterogeneity of circulating tumor cells[J]. Oncotarget,2016,5(0)[Epub ahead of print]
(编辑 王 玮)
Novelcirculating tumor cells enumeration and epithelial/mesenchymal probe marking technique in the treatment of bladder cancer
ZHANG Rui-yun,JIN Di,CAO Ming,CHEN Hai-ge,XUE Wei,HUANG Yi-ran
(Department of Urology,Renji Hospital,School of Medicine,Shanghai Jiaotong University,Shanghai 200127,China)
Objective To explore the diagnostic use of novel circulating tumor cells (CTCs) enumeration and epithelial/mesenchymal probe marking technique in bladder urothelial cancer (BCa),and to analyze the correlation between CTCs and pathological outcomes.Methods A total of 115 patients with primary diagnosed bladder carcinoma (cT1~4aN0M0) treated during May 2015 and Oct. 2015 were included,and another 25 healthy volunteers served as controls. CTCs were separated with modified CanPatrolTMSystem. RNA in situ hybridization (RNA-ISH) was performed with epithelial tumor cells (Epi+) specific probes (EpCAM,CK8/18/19) and mesenchymal tumor cells (Mes+) specific probe (Twist,Vimentin) on isolated CTCs.Results CTCs were positive in 93 patients (81%) with BCa,while all negative (0%,0) in healthy controls (P<0.001). In RNA-ISH assay,we observed that patients with muscle invasive bladder cancer had significantly higher positive rates of CTCs (P=0.049),Epi+Mes+ CTCs (P=0.018) and Epi-Mes+ CTCs (P<0.001) compared with non-muscle invasive bladder cancer. Further analysis showed that the pT1 patients had significantly higher positive rate of CTCs (P<0.001),Epi+Mes-CTCs (P=0.001) and Epi+Mes+ CTCs (P<0.001) than pTa patients.Conclusion The novel CTCs enumeration and RNA-ISH based epithelial/mesenchymal probe marking technique could be a sensitive detection method for patients with bladder cancer. The increase of Mes+CTCs might be associated with muscle invasion,which suggested EMT could be related with invasion and metastasis in muscle invasive bladder cancer.
bladder cancer; circulating tumor cell; epithelial mesenchymal transition; tumor invasion; RNA-ISH
2016-09-18
2016-10-18
上海市自然科学基金(No.16ZR1420300),国家自然科学基金(No.81402084,81472378,81272841)
黄翼然,教授.E-mail:hyrrenji2@aliyun.com
张瑞赟(1990-),男(汉族),博士在读.研究方向为泌尿系肿瘤.E-mail:zhangruiyun4337@163.com
R737
A
10.3969/j.issn.1009-8291.2016.12.003

