microRNA调控膀胱癌侵袭转移机制的研究进展
古亚楠,畅朋康 综述,贺大林,吴开杰 审校
·综 述·
microRNA调控膀胱癌侵袭转移机制的研究进展
古亚楠,畅朋康 综述,贺大林,吴开杰 审校
(西安交通大学第一附属医院泌尿外科,陕西西安 710061)
膀胱癌是泌尿系统最常见的恶性肿瘤,可分为非肌层浸润型与肌层浸润型膀胱癌,其中肌层浸润型膀胱癌的高侵袭性、高转移性表型是患者致死的主要病因。一系列复杂分子机制参与其中,其中microRNA通过与靶基因3′非翻译端靶向结合在其中扮演重要角色。其不仅可能成为生物标记物用于未来诊断,且有可能成为治疗膀胱癌潜在的分子靶点。因此,本文将对膀胱癌侵袭转移相关的microRNA研究的最新进展做一综述,以期为膀胱癌的防治提供崭新的思路。
膀胱癌;侵袭转移;microRNA;靶基因
膀胱癌是泌尿系统最常见的恶性肿瘤,其中肌层浸润型膀胱癌易远处转移,预后较差。多种复杂分子机制参与膀胱癌的侵袭、转移过程,包括小分子核糖核苷酸(microribonucleicacid,microRNA)异常表达和调控。microRNA是真核细胞中一类长度为18~25nt的非编码蛋白的小分子RNA,主要是通过其种子区(5′端2~8个核苷酸序列)与下游靶基因3′-非翻译端(3′-UTR)结合而调节靶基因的表达,从而调控细胞的增殖、分化、凋亡、迁移和侵袭等过程。目前,多种异常表达的microRNA相继被发现与膀胱癌的侵袭、转移密切相关,为膀胱癌的诊断和治疗研究提供了崭新的思路。本文将就膀胱癌侵袭、转移相关的microRNA做一综述,并重点介绍其具体的分子调控机制(图1)。
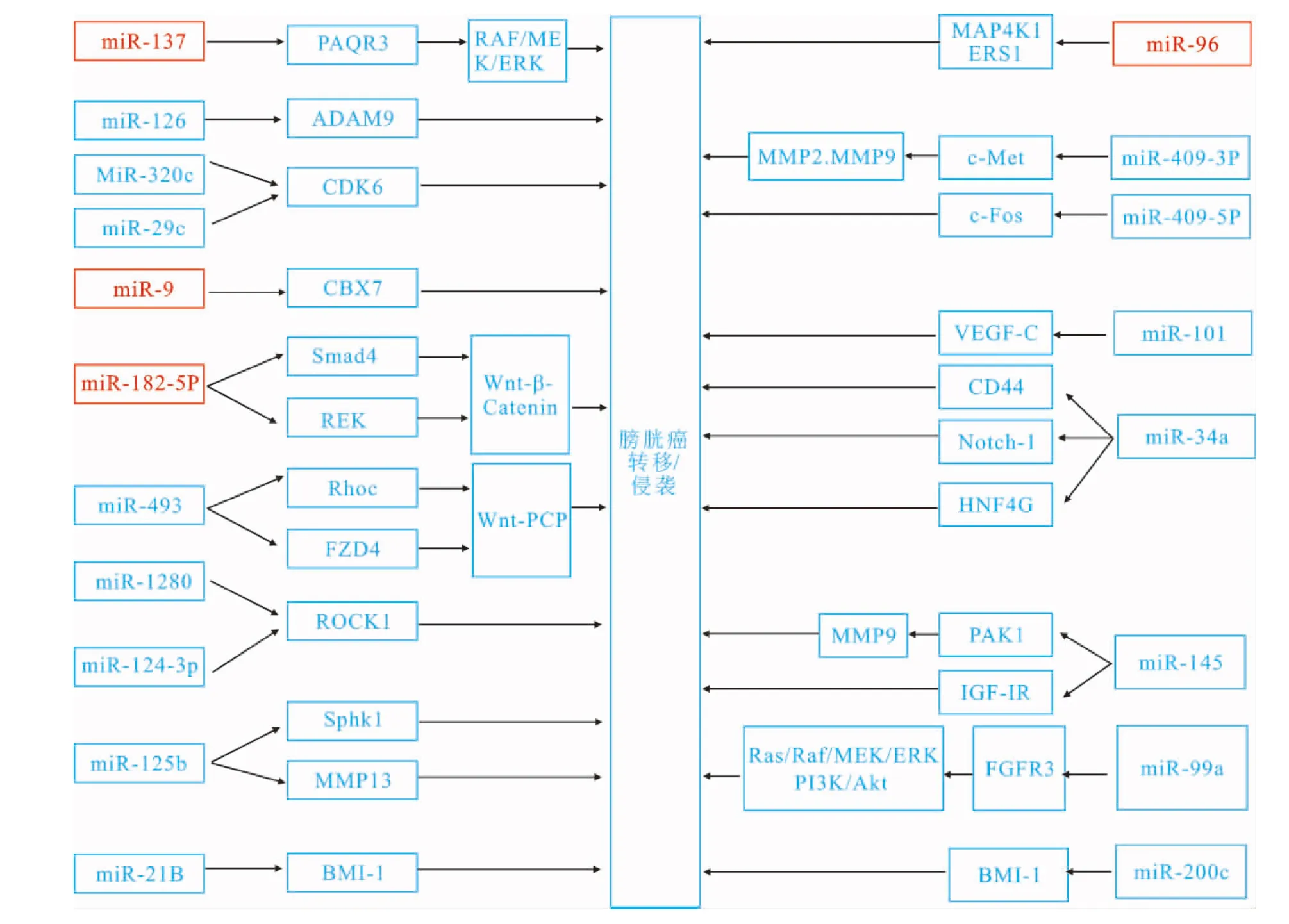
图1MicroRNA调控膀胱癌侵袭转移机制的示意图
注:图中红色提示为上调的microRNA,其他为下调的mircoRNA。miR:小分子核糖核苷酸。
1 抑制膀胱癌侵袭转移的microRNA
1.1MiR-125bMiR-125b的生物学功能复杂,高度依赖于细胞类型,迄今为止,ERBB2/ERBB3、BAK1、CYP24、NR2A、肿瘤坏死因子α(tumornecrosisfactor,TNF-α)、Bcl2修饰因子(Bcl2modifyingfactor,BMF)、Smo和p53均已被确定是miR-125b的靶点。miR-125b在乳腺癌、卵巢癌、骨肉瘤和膀胱癌等多种肿瘤组织中表达降低,而在前列腺肿瘤组织中表达升高。在膀胱癌T24和EJ细胞中,miR-125b可靶向基质金属蛋白酶(matrixmetalloproteinase13,MMP13)来降低细胞迁移和侵袭能力。有意义的是,MMP13在正常尿路上皮细胞中无表达,而在膀胱癌细胞特别是肌层浸润型膀胱癌细胞中高表达,提示其可能作为癌症治疗重要的靶点[1]。此外,ZHAO等[2]通过萤光素酶报告基因法证实miR-125b可直接作用于鞘氨醇激酶1(sphingosinekinase1,SPHK1)的3′UTR,下调SPHK1,抑制细胞生长、迁移和促使细胞G1期阻滞,而SPHK1过度表达恰恰又与膀胱癌预后密切相关。
1.2MiR-1280 在膀胱癌细胞中过表达miR-1280不仅可诱导细胞G2-M期阻滞和细胞凋亡,还可抑制膀胱癌细胞迁移和侵袭,并降低ROCK1和RhoC蛋白的表达。荧光素酶报告基因实验证实,在膀胱癌中致癌基因ROCK1是miR-1280的直接靶点,从而间接抑制其上游Rho的活性,而Rho/ROCK途径是调节肌动蛋白细胞骨架重组和肿瘤细胞转移的关键分子[3]。此外,该研究还提示miR-1280在膀胱癌诊断和预后预测方面的重要性。例如,miR-1280高表达的膀胱癌患者具有较高的总生存率,而低表达则提示患者预后不佳。
1.3MiR-34aMiR-34a在癌症研究中被形容为“明星”microRNA,在许多人类癌症中充当重要的抑癌分子。MiR-34a的CpG甲基化失活会导致膀胱癌的风险增加,提示miR-34a可能与膀胱癌的发生和发展有关。MiR-34a也是p53通路下游非常重要的miRNA,其表达影响细胞凋亡、细胞周期阻滞、衰老和癌症细胞敏感性。此外,在肌层浸润型膀胱癌中表面粘附分子CD44可分为标准亚型和变体亚型,分别只表达于间充质细胞和上皮细胞,作为一种癌干细胞标记物,其在癌症的发生和进展方面扮演重要角色。CD44已被证实在前列腺癌、膀胱癌和肾癌中是miR-34a的直接靶标。在膀胱癌,miR-34a可以通过靶向作用于CD44来抑制血管形成,继而降低细胞迁移和侵袭[4]。同时,miR-34a还可以通过靶向Notch1抑制膀胱癌细胞迁移和侵袭浸润。Notch信号通路与细胞间通讯密切相关,在浸润型膀胱癌中Notch1受体异常活化,而抑制Notch1表达可降低癌细胞的增殖。另外,研究还发现,miR-34A可直接针对HNF4G3′-UTR,抑制HNF4G在膀胱肿瘤中的表达,降低克隆形成和侵袭能力[5]。除此之外,miR-34a还可能通过靶向多种p53信号通路下游基因,包括SIRT-1、CDK6、E2F3和Bcl-2影响膀胱癌细胞的化疗敏感性[6]。总之,miR-34a在膀胱癌细胞中具有多种分子靶点,参与多种信号通路的调控。
1.4MiR-99aMiRNA-99a表达与多种肿瘤密切相关,包括食管癌、肾癌。在食管鳞状细胞癌miR-99a可以通过作用于mTOR信号促进细胞凋亡,在肾细胞癌中,miR-99a诱导细胞G1期阻滞,抑制肿瘤发展。同样,miRNA-99a也会影响膀胱癌细胞的增殖、迁移和侵袭,WU等[7]通过将miRNA-99a在T24和EJ细胞系中过表达,测定细胞活力迁移与侵袭能力,荧光素酶报告基因实验发现,miRNA-99a通过作用于成纤维细胞生长因子受体3(fibroblastgrowthfactorreceptor,FGFR3)抑制癌细胞的增殖、迁移和侵袭。FGFR3属于结构相关的酪氨酸激酶受体族,参与各种生物学过程包括增殖、分化、迁移和凋亡。研究指出,>70%低分化膀胱肿瘤出现FGFR3突变,而FGFR3的活化被认为是刺激Ras/Raf/MEK/ERK通路(也称为有丝分裂原活化蛋白激酶途径)和PI3K/Akt通路的重要分子,是治疗膀胱癌的重要靶点。
1.5MiR-124-3p研究表明,在膀胱癌组织中miR-124-3p频繁甲基化。与非肿瘤组织相比,癌组织中miR-124-3p甲基化水平升高,miR-124-3p表达下调,使得膀胱癌细胞周期失控。因此,miR-124修复可能是一种有效的抗癌策略。实验发现,过表达miR-124-3p不仅可引发膀胱癌细胞G1期阻滞,还可抑制癌细胞运动和侵袭能力。更重要的是,miR-124可直接靶向Rho/ROCK[8]。另外,miR-124-3p还在上皮细胞间质转化(epithelialmesenchymaltransition,EMT)中起重要作用,并调控下游基因如MMP2、MMP9、c-Met等表达。EMT被认为是肿瘤侵袭、转移中的关键步骤,上皮细胞通过失去粘附、紧密连接、极性及细胞-细胞间接触并重塑细胞骨架,促进细胞运动、浸润和转移。实验表明,miR-124类似物可逆转T24细胞系的EMT,例如下调间质标记物纤连蛋白、N-钙黏蛋白和波形蛋白的表达,增强上皮标记物β连环蛋白的表达。此外,miR-124-3p可降低p38蛋白的磷酸化,而在以前的研究中,p38蛋白激酶的活化被证明可调节MMP2、MMP9和c-Met的活性。
1.6MiR-320cMiR-320c表达与多种肿瘤发生密切相关,如膀胱癌、乳腺癌、急性骨髓性白血病和结肠癌。研究表明,miR-320c能抑制T24和UMUC-3膀胱癌细胞系的生长和迁移,抑制细胞克隆形成,引发G1期阻滞。WANG等[9]用RT-PCR比较了不同膀胱正常黏膜和癌组织中miR-320c的表达水平,发现miR-320的表达在肌层浸润型膀胱癌中显著降低,提示miR-320降低可能与肿瘤侵袭性和预后相关,他们采用TargetScan分析发现,miR-320c可直接靶向CDK6基因3′-UTR,抑制膀胱癌细胞增殖和运动性。而CDK6作为一个重要的细胞周期调节物,是诱导G1期级联反应的重要分子,它可以使Rb磷酸化并有效地连通CDK4和周期蛋白D1,是诱导G1/S期停滞和抑制细胞增殖的一个重要介质。
1.7MiR-101MiR-101在前列腺、结直肠癌、肝癌、胃癌等多种肿瘤组织中表达降低,在膀胱肿瘤组织中降低尤为显著。LEI等[10]利用TargetScan分析发现,血管生成因子-C(vascularendothelialgrowthfactor-C,VEGF-C)为miR-101的潜在靶基因。而过表达miR-101慢病毒转染T24和5637膀胱癌细胞系,可发现miR-101的过表达可抑制膀胱癌细胞的迁移和侵袭,此外,其还证明了miR-101负调控VEGF-C蛋白的表达。VEGF是血管生成的重要刺激物,影响内皮细胞的增殖和运动性,并增加血管通透性。其中VEGF-C被认为是一种重要的淋巴管生成分子,可显著增加淋巴管的渗透性,并可通过FLT4/VEGFR-3和KDR/VEGFR-2受体酪氨酸激酶,引起淋巴管内皮细胞增殖和淋巴脉管的选择性增生。膀胱癌主要通过淋巴扩散,VEGF-C与淋巴扩散密切相关。
1.8MiR-145MiR-145通过调节多个肿瘤形成相关基因如胰岛素样生长因子-1受体(insulin-likegrowthfactor1receptor,IGF-1R)和c-Myc抑制肿瘤生长、细胞侵袭和转移。我们研究所前期的研究发现,与正常的膀胱组织相比,膀胱癌组织中miR-145表达减少,PAK1蛋白表达上调,并证实miR-145可直接靶向作用于PAK1[11]。PAK1是膀胱癌良好的预后标志物,PAK1mRNA的表达与膀胱癌分期和复发的风险紧密相关。因为PAK1不仅可促进细胞骨架重构、细胞运动、细胞浸润、细胞生长和细胞存活,还可诱导EMT,启动膀胱癌细胞侵袭。而miR-145恰恰可以抑制膀胱癌细胞侵袭以及PAK1和MMP-9的表达。此外,ZHU等[12]还证明miR-145可作用于IGF-IR抑制膀胱癌细胞生长和侵袭。
1.9MiR-200c在膀胱癌中,癌基因BMI-1是miR-200c一个直接的靶点,上调miR-200c可通过BMI-1和E2F3抑制肿瘤的发生和发展[13]。BMI-1编码来自两个不同基因产物(p16蛋白INK4A和p14ARF),其中p14ARF可使细胞周期进程停滞,并通过稳定p53促进细胞凋亡。此外,BMI-1还在干细胞中起着关键的作用,上调BMI-1的表达已被证明与许多人类癌症有关,包括膀胱癌,同时高表达BMI-1已被证明与膀胱癌预后不良相关。
1.10 其他 在人膀胱癌组织和细胞系中,miR-409-3p表达下调;而过表达miR-409-3p可显著减少癌细胞的迁移和侵袭力,但不影响细胞本身活力。MiR-409-3p可通过靶向c-Met抑制膀胱癌细胞的迁移和侵袭,MMP2和MMP9可能是miR-409-3p下游的关键效应蛋白[14]。此外,膀胱癌组织miR-490-5p表达下调,其表达水平与膀胱癌病理分级呈负相关。在膀胱癌细胞,过度表达的miR-490-5p通过G1期阻滞显著抑制细胞的增殖,而c-fos是miR-490-5p的靶分子[15]。另外,miR-29C可通过作用于CDK6抑制膀胱癌细胞的增殖、迁移和侵袭,有望在未来成为膀胱癌的治疗靶标[16]。还有,在浸润型膀胱癌细胞中引入miR-126可显著降低ADAM9在mRNA和蛋白质水平的表达,恢复miR-126的表达在浸润型膀胱癌中可能成为潜在的治疗方法[17]。UENO等[18]还发现miR-493的表达在膀胱癌组织显著降低,将miR-493转染到T24和J82细胞可降低细胞的生长和迁移能力,其潜在的靶基因是RhoC与FZD4。而CHENG等[19]发现在膀胱肿瘤组织与正常邻近组织相比,miR-218表达下调,体内外实验证明,过表达miR-218抑制膀胱癌细胞增殖、迁移和侵袭,荧光素酶报告基因分析表明,BMI-1是miR-218的直接耙标。MiR-218调节BMI-1及其下游靶基因PTEN的表达,参与AKT的磷酸化。
2 促进膀胱癌侵袭转移的microRNA
2.1MiR-137MiR-137在肿瘤进展中的角色有争议,XIU等[20]通过定量逆转录聚合酶链反应(polymerasechainreaction,PCR)发现,与正常膀胱组织细胞相比,膀胱癌细胞系miR-137过表达,迁移和侵袭实验发现miR-137过表达显著促进T24细胞的迁移和侵袭,而PAQR3是miR-137在膀胱癌的直接靶点。PAQR3作为一种崭新的肿瘤抑制基因,PAQR3沉默可显著增强膀胱癌细胞的增殖,PAQR3过表达则显著抑制膀胱癌细胞增殖和侵袭能力。
2.2MiR-182-5p与正常组织,膀胱肿瘤中miR-182-5p表达显著升高,并与膀胱癌患者生存期有关。Smad4和RECK是miR-182-5p潜在的靶基因。在膀胱癌细胞中RECK与Smad4的表达可降低膀胱癌细胞的增殖、迁移和侵袭的能力,增加细胞凋亡[21]。而转染miR-182-5p可使这些靶基因(Smad4和RECK)3′UTR活性显著降低。同时,miR-182-5p也增加了核β-catenin的表达,而Smad4抑制核β-catenin的表达。因此,miR-182-5p可沉默RECK和Smad4基因,活化膀胱癌Wnt信号传导途径。
2.3 其他 另外,还有一些microRNA在膀胱癌组织表达上调,例如miR-9靶向CBX7、miR-96靶向MAP4K1和ERS1增强肿瘤细胞的侵袭,并提示膀胱癌患者预后差。此外,miR-129、miR-133b和miR-518C上调也很常见,其下游具体靶分子尚未见报告[22]。
3 结 语
综上所述,在膀胱癌中有关microRNA的研究已很多,尤其是与膀胱癌进展相关的microRNA不断被发现,其参与膀胱癌侵袭转移的复杂分子机制也逐渐被揭示。但是,目前的研究大多局限于实验室阶段,microRNA直接应用于临床诊断和治疗还有待进一步研究。但庆幸的是,近年来对尿液标本中进行microRNA检测的非侵入性诊断技术不断成熟,并已有研究发现多种microRNA联合检测可有助于对患者预后的预测。因此,在膀胱癌对microRNA开展更为深入的研究,势必为膀胱癌的诊断、治疗提供全新的思路。
[1]WUD,DINGJ,WANGL,etal.MicroRNA-125binhibitscellmigrationandinvasionbytargetingmatrixmetallopeptidase13inbladdercancer[J].OncolLett,2013,5(3):829-834.
[2]ZHAOX,HEW,LIJ,etal.MiRNA-125binhibitsproliferationandmigrationbytargetingSphK1inbladdercancer[J].AmJTranslRes,2015,7(11):2346-2354.
[3]MAJIDS,DARAA,SAINIS,etal.MicroRNA-1280inhibitsinvasionandmetastasisbytargetingROCK1inbladdercancer[J].PLoSOne,2012,7(10):e46743.
[4]YUG,YAOW,XIAOW,etal.MicroRNA-34afunctionsasananti-metastaticmicroRNAandsuppressesangiogenesisinbladdercancerbydirectlytargetingCD44 [J].JExpClinCancerRes,2014,33(1):779.
[5]SUNH,TIANJ,XIANW,etal.MiR-34ainhibitsproliferationandinvasionofbladdercancercellsbytargetingorphannuclearreceptorHNF4G[J].DisMarkers,2015,2015:879254.
[6]SHiZ,WEIQ,ZHANGM,etal.MicroRNAsinBladderCancer:ExpressionProfiles,BiologicalFunctions,Regulation,andClinicalImplications[J].CritRevEukaryotGeneExpr,2014,4(1):55-75.
[7]WUD,ZHOUY,PANH,etal.MicroRNA-99ainhibitingcellproliferation,migrationandinvasionbytargetingfibroblastgrowthfactorreceptor3inbladdercancer[J].OncolLett,2014,7(4):1219-1224.
[8]XUX,LIS,LINY,etal.MicroRNA-124-3pinhibitscellmigrationandinvasioninbladdercancercellsbytargetingROCK1 [J].JTranslMed,2013,11:276.
[9]WANGX,WUJ,LINY,etal.MicroRNA-320cinhibitstumorousbehaviorsofbladdercancerbytargetingCyclin-dependentkinase6 [J].JExpClinCancerRes,2014,33(1):69.
[10]LEIY,LIB,TONGS,etal.MiR-101suppressesvascularendothelialgrowthfactorCthatinhibitsmigrationandinvasionandenhancescisplatinchemosensitivityofbladdercancercells[J].PLoSOne,2015,10(2):e0117809.
[11]KOUB,GAOY,DUC,etal.MiR-145inhibitsinvasionofbladdercancercellsbytargetingPAK11 [J].UrolOncol,2014,32(6):846-54.
[12]ZHUZ,XUT,WANGL,etal.MicroRNA-145directlytargetstheinsulin-likegrowthfactorreceptorIinhumanbladdercancercells[J].FEBSLett,2014,588(17):3180-3185.
[13]LIUL,QIUM,TANG,etal.MiR-200cinhibitsinvasion,migrationandproliferationofbladdercancercellsthroughdown-regulationofBMI-1andE2F3 [J].JTranslMed,2014,12:305.
[14]XUX,CHENH,LINY,etal.MicroRNA-409-3pinhibitsmigrationandinvasionofbladdercancercellsviatargetingc-Met[J].MolCells,2013,36(1):62-68.
[15]LANG,YANGL,XIEX,etal.MicroRNA-490-5pisanoveltumorsuppressortargetingc-FOSinhumanbladdercancer[J].ArchMedSci,2015,11(3):561-569.
[16]ZHAOX,LIJ,HUANGS,etal.MiRNA-29cregulatescellgrowthandinvasionbytargetingCDK6inbladdercancer[J].AmJTranslRes,2015,7(8):1382-1389.
[17]JIAAY,CASTILLO-MARTINM,BONALDM,etal.MicroRNA-126inhibitsinvasioninbladdercancerviaregulationofADAM9 [J].BrJCancer,2014,110(12):2945-2954.
[18]UENOK,HIRATAH,MAJIDS,etal.TumorsuppressormicroRNA-493decreasescellmotilityandmigrationabilityinhumanbladdercancercellsbydown-regulatingRhoCandFZD4 [J].MolCancerTher,2012,11(1):244-253.
[19]CHENGY,YANGX,DENGX,etal.MicroRNA-218inhibitsbladdercancercellproliferation,migration,andinvasionbytargetingBMI-1 [J].TumorBiol,2015,36(10):8015-8023.
[20]XIUY,LIUZ,XIAS,etal.MicroRNA-137upregulationincreasesbladdercancercellproliferationandinvasionbytargetingPAQR3 [J].PLoSOne,2014,9(10):e109734.
[21]HIRATAH,UENOK,SHAHRYARIV,etal.OncogenicmiRNA-182-5ptargetsSmad4andRECKinhumanbladdercancer[J].PLoSOne,2012,7(11):e51056.
[22]XIED,SHANGC,ZHANGH,etal.Up-RegulationofmiR-9targetCBX7toregulateinvasionabilityofbladdertransitionalcellcarcinoma[J].MedSciMonit,2015,18(21):225-230.
(编辑 王 玮)
2016-02-24
2016-04-24
国家自然科学基金(No.NSFC81572516)
吴开杰,副教授.研究方向:膀胱癌侵袭转移的基础与临床研究.E-mail:kaijie_wu@163.com
古亚楠(1994-),女(汉族),硕士在读.E-mail:gw19941031@163.com
R
A
10.3969/j.issn.1009-8291.2016.12.019

