原料灭菌处理对刺参饲料发酵效果的影响及发酵饲料在幼参保苗期的规模化应用效果评价
■姜 燕 廖梅杰* 王印庚 李 彬 张 正 荣小军邹安革
(1.中国水产科学研究院黄海水产研究所青岛海洋科学与技术国家实验室海洋渔业科学与食物产出过程功能实验室,山东青岛 266071;2.蓬莱市安源水产有限公司,山东烟台 265600)
目前,对水产养殖生物鱼、虾、贝等品种营养与饲料方面的研究不断深入,研究内容从最初的配方研究[1]、营养需求研究[2-4]、资源紧缺型原料的替代研究[5-6]发展到更深层次的代谢机理的研究[7-8]。
而刺参(Apostichopus japonicus)作为水产养殖中重要的养殖品种,随着其养殖产业和规模的不断扩大,对饲料的需求量不断加大,其中添加比例较高的鼠尾藻(Sargassum thunbergii)、马尾藻(Sargassum polycystum)[9-11]资源逐渐匮乏。为保证产业的健康发展,业内人士开始着手进行替代资源的开发研究[9,12-13]。在探寻替代或部分替代物的同时有人发现饲料经过发酵处理后投喂刺参能够取得较好的生长[14-15]。发酵饲料作为一种新型的生态健康型饲料,在畜牧养殖业已得到广泛应用[16-20],并且具有良好的前景。但是,与畜牧业相比,微生物发酵饲料在水产养殖业中的应用相对较少[21-23]。
饲料发酵前,将原料进行一定的消毒灭菌处理,可以杀灭饲料本身携带的部分微生物。常见的消毒灭菌方式有物理方式、化学方式、紫外线、电离辐射、滤过除菌等[24]。但是,每种方式对消毒灭菌对象都有各自的要求,并不适用于所有物品。实验中常用的玻璃器皿、培养基等一般采用高温高压的方式进行消毒灭菌,而对日常饮用的牛奶则一般采用巴氏消毒法进行消毒灭菌,这样在保证消毒灭菌的同时又不会使消毒灭菌对象的一些性质发生改变。在饲料的发酵中,一些专家、学者曾对饲料原料的前处理进行了相关的研究[25-27],大部分采用的是高温高压的方式。这种方式对原料的消毒灭菌比较彻底,但是高温高压容易破坏饲料中部分营养,一定程度上影响发酵菌株的生长,进而影响发酵的进程。本文采用65℃湿热灭菌30 min的方式对饲料进行消毒灭菌,在酿酒酵母(Saccharomyces cerevisiae)[28]的作用下研究其对饲料发酵效果的影响;并利用所制备的发酵饲料对稚参进行规模化投喂以期为发酵饲料在刺参保苗养殖中的应用提供基础数据。
1 材料与方法
1.1 饲料的配制及消毒灭菌处理
将饲料原料分别粉碎至200目,按表1中的配比称取相应原料充分搅拌混匀后,装入灭菌袋于65℃下湿热灭菌30 min,并在冷凝干燥器中冷却,密封保存,备用。

表1 发酵原料的配方(以干物质计,g/kg)
1.2 发酵菌液的制备
发酵用菌株为实验室保存的酿酒酵母,采用酵母浸出粉胨葡萄糖培养基(Yeast Extract Peptone Dextrose Medium,YPD)进行发酵菌的活化培养。将活化的酿酒酵母用2%生理盐水配制成108cfu/ml的菌液,按照1%(v/v)的接种量接种于YPD液体培养基中,置于37℃、转速为120 r/min的恒温振荡培养箱中培养10 h并作为饲料发酵用种子液。
YPD培养基:10 g酵母浸出粉、20 g蛋白胨、20 g葡萄糖、20 g氯化钠、15 g琼脂,1 000 ml蒸馏水(液体培养基不加琼脂)。
1.3 养殖试验场地及刺参来源
发酵饲料规模化投喂试验在烟台市安源水产有限公司育苗厂进行,保苗池规格为7.5 m3/池,每个水泥池放置52个附着框。所用的刺参苗种为该公司同一批受精卵孵化的稚参苗,苗种平均规格约为16 000头/kg,试验开始前每池的平均保苗量为3.12 kg/池。
1.4 试验设计
发酵试验共分A、B、C、D四组,即灭菌后发酵饲料(A)、灭菌后未发酵饲料(B)、未灭菌发酵饲料(C)和未灭菌未发酵饲料(D),其中A、B两组的饲料原料经过消毒灭菌处理,C、D两组的原料未经灭菌处理;同时,A、C两组中按10%(V/W)的比例接入酿酒酵母种子液,B、D两组加入等量的2%的生理盐水。每组3个平行,用灭菌海水将配合饲料按照已建立的刺参饲料发酵工艺[将原料配制成含水量为70%的发酵底物(以干物质计),于25℃下发酵3 d][29]进行发酵处理。发酵期间每天按时均匀搅拌,发酵结束取相应饲料样本进行检测。
投喂试验设有试验组(投喂C组发酵饲料)和对照组(投喂D组未灭菌未发酵饲料),每组26个平行,试验周期为35 d。在育苗厂的发酵车间,按照现做现用的原则将配合饲料按照已建立的发酵工艺进行发酵。试验期间连续充氧,水温为23~26℃,盐度为30.61,每天投喂两次(8:00和16:00),投喂前换水1/2。
1.5 检测指标
发酵饲料的评价指标由发酵菌在微生物总量中所占比例、干物质回收率(dry matter recovery,DMR)、粗蛋白含量(the content of crude protein)和感官指标(sensory evaluation)组成[28]。
DMR:根据饲料发酵前后干物质含量计算[30],计算公式为:

式中:W0——发酵前饲料干物质的含量(g);
W1——发酵后饲料干物质的含量(g)。
粗蛋白含量:将饲料样品在65℃下烘干至恒重并过筛,采用凯氏定氮法测定(UDK142全自动凯氏定氮仪,VELP,Usmate,MB,Italy)。
感官指标:由10名研究人员组成的小组分别从气味、颜色、黏度三个方面对发酵饲料的感官物理性状进行相应的评分(评分标准为1.00~5.00分),气味、颜色、黏度三个方面各自的平均值即为发酵饲料感官性状的分值,再通过数据处理进行分析[31-33]。其中,最佳的颜色指标为灰棕色,最佳气味性状为酸香味[34],最佳黏度指标为饲料不成团块,用两手指轻轻一捏略带黏性。
生长指标包括增重率(Weight gate rate,WGR)、特定生长率(Special growth rate,SGR),计算公式分别为:
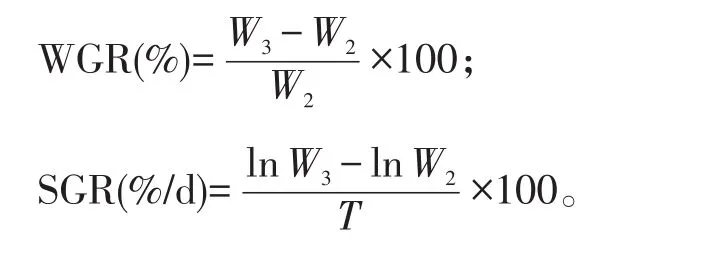
式中:W2——试验开始前每池刺参的初始平均重(kg/池);
W3——试验结束时每池刺参的平均重(kg/池);
T——试验周期,为35 d。
1.6 数据处理
采用SPSS16.0对试验数据进行方差分析,当不同数据间存在显著差异时,进行Tukey多重比较,显著性水平为P<0.05。所有数值均采用“平均值±标准差(Means±S.D.)”表示。
2 结果与分析
2.1 灭菌预处理对发酵后饲料中酿酒酵母占微生物比例的影响
灭菌后发酵饲料(A组)和未灭菌发酵饲料(C组)发酵菌在发酵样品微生物总量中所占比例如图1所示。其中,未灭菌发酵饲料(C组)中发酵菌的比例为(34.60±2.96)%,略高于灭菌后发酵饲料(A组)中发酵菌的比例(34.43±1.29)%,但是两者差异不显著(P>0.05)。由此可见,灭菌预处理对发酵过程中发酵菌的增殖及作用影响不显著。
2.2 灭菌预处理及发酵处理对刺参饲料理化指标的影响
对利用灭菌预处理和发酵处理所制备的4组发酵饲料的干物质回收率测定结果(见图2)表明,灭菌后发酵饲料(A组)干物质回收率最高[(98.09±0.36)%],略高于未灭菌发酵饲料(C组)[(98.07±0.09)%],但两者的差异不显著(P>0.05);然而发酵处理的两个试验组(A组和C组)所制备饲料的干物质回收率显著高于未经发酵处理的B组和D组(P<0.05)。
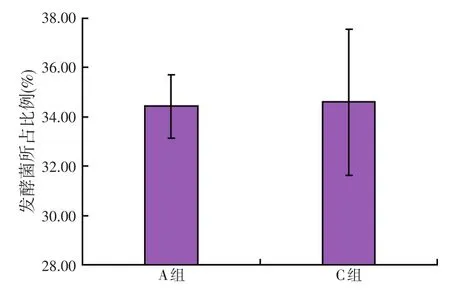
图1 原料灭菌处理对发酵饲料中发酵菌所占比例的影响

图2 不同处理组饲料的干物质回收率
对利用灭菌预处理和发酵处理所制备的4组发酵饲料的粗蛋白含量由大到小排列依次为未灭菌发酵饲料(C组)>灭菌后发酵饲料(A组)>未灭菌未发酵饲料(D组)>灭菌后未发酵饲料(B组)(见图3)。其中,C组与A组的粗蛋白含量分别为(20.33±0.19)%和(20.31±0.09)%,差异不显著(P>0.05),但二者均显著高于未发酵的B组与D组的粗蛋白含量(P<0.05)。
对利用灭菌预处理和发酵处理所制备的4组发酵饲料的各个感官指标的分值结果见表2。在颜色和气味方面,未灭菌发酵饲料(C组)的分值最高,与灭菌后发酵饲料(A组)差异不显著(P>0.05),但显著高于灭菌后未发酵饲料(B组)和未灭菌未发酵饲料(D组)(P<0.05);在黏度方面,4组之间差异均不显著(P>0.05)。

图3 不同处理组饲料中粗蛋白含量

表2 发酵饲料的感官评价
综合以上理化及感官指标可以看出,饲料原料的灭菌预处理对饲料理化指标影响不大,但发酵过程可以显著影响饲料的干物质回收率、粗蛋白含量、颜色和风味,是影响饲料品质的关键因素之一。
2.3 发酵处理饲料投喂刺参苗种对刺参生长及生理的影响
鉴于消毒处理对发酵饲料效果影响不显著,在发酵饲料大规模应用试验中,选取未灭菌发酵饲料(C组)和未灭菌未发酵饲料(D组)进行相应生长效果的对照评估。投喂未发酵饲料的对照组和投喂发酵饲料的试验组刺参在试验初始时的平均体重差异不显著(P>0.05),经过35 d的投喂试验,在试验结束时,投喂未灭菌发酵饲料(C组)的刺参平均每池的末体重显著高于未灭菌未发酵饲料(D组)刺参(P<0.05)(见表3)。投喂发酵饲料(C组)的养殖试验组的增重率和特定生长率分别为(26.14±0.18)%和(2.11±0.04)%/d,相对于投喂未发酵饲料组(D组)的增重率[(25.40±0.18)%]和特定生长率[(2.03±0.04)%/d],两者差异显著(P<0.05)。
在养殖试验过程中,同时观察养殖苗种的生理状态,并随机挑选刺参苗种,解剖观察其肠道以判别其摄食情况。观察结果表明,投喂发酵饲料和未发酵饲料的刺参在体色、刺形、伸展、活力方面几乎无差别,但在肠道充盈度方面稍微有差别,投喂发酵饲料的刺参苗种中平均20%刺参的肠道内容物有间断,而投喂未发酵饲料的刺参苗种中平均25%刺参的肠道内容物有间断(见表4),表明,发酵饲料对刺参苗种摄食有良好的促进作用。

表3 投喂发酵饲料和未发酵饲料对刺参的生长效果的影响

表4 试验过程中刺参的健康状况
3 讨论
3.1 消毒灭菌处理对饲料发酵效果的影响
2013年我国农业部2045号公告《饲料添加剂品种目录(2013)》中明确指出,能够直接饲喂动物的饲料级微生物添加剂菌种有地衣芽孢杆菌(Bacillus licheniformis)、枯草芽孢杆菌(B.subtilis)、酿酒酵母(S.cerevisiae)等29种[35]。饲料原料本身携带的微生物种类较多,有些在一定浓度范围内是刺参的有益菌,如枯草芽孢杆菌、酵母菌等;有些种类微生物虽然不是刺参的直接有益菌,但可以产生氨基酸、酶、维生素等有用代谢产物,促进饲料中大分子营养物质的降解、发酵菌种的生长繁殖;有些种类微生物与发酵菌能够形成颉颃作用,不利于发酵菌的生长、繁殖,但是饲料中发酵菌为优势菌株,有可能对这些微生物的生长产生一定的抑制作用。
将原料进行一定程度的消毒灭菌可以杀灭一些微生物,促使发酵菌快速生长繁殖。但是,这种杀灭是不定向的、不具有选择性的。有可能抑制或杀灭那些与发酵菌没有营养竞争或颉颃作用的微生物,反而使那些直接或间接的与发酵菌存在某种营养竞争或产物抑制的微生物得以存活。也有可能饲料中的微生物适温性好,65℃下湿热灭菌30 min对其影响较小。因此,本试验发酵结束后发酵菌所占比例在经灭菌处理发酵饲料组和未经灭菌处理发酵饲料组之间无明显差异。说明灭菌处理对发酵菌的生长繁殖无明显影响,不同处理组饲料的发酵可以正常进行。
由于酵母菌的粗蛋白含量高达细胞干物质的50%,所以一些酵母细胞常被用来生产或用作饲料蛋白。有研究指出,当有外源氮加入的时候,将酵母菌、酵母菌和黑曲霉的混合菌液分别加入经过高温高压灭菌处理的和未经灭菌处理的鲜苹果渣中进行发酵,通过对产物蛋白含量的分析比较可以看出,未经灭菌处理的产物纯蛋白的增加幅度远高于灭菌处理的[25]。与灭菌处理相比,未经灭菌处理的玉米秸秆的发酵液能有效的促进大豆种子的萌发和胚根的生长[36]。而本试验中的饲料原料采用低温、较长时间的湿热灭菌处理,其中大部分营养成分的特性不会发生变化,可以正常的为微生物代谢提供营养物质。因此,加入发酵菌的两个组中,经过灭菌处理的干物质回收率、粗蛋白含量与未灭菌的差异不显著(P>0.05)。由此可见,对于刺参发酵饲料而言,其饲料原料的杀菌预处理对发酵菌的增殖影响不大,从经济和实用角度出发,在后期发酵饲料规模化制备过程中,可以使用饲料原料直接进行发酵生产,而无需进行原料灭菌预处理。
3.2 发酵处理对饲料发酵效果的影响
饲料中的一些成分在发酵过程中随着微生物的生长代谢被消耗,产生气体被排出,从而使饲料的干物质含量降低[37]。因此,试验结束后饲料的干物质含量有所降低,导致干物质回收率低于100%。另外,饲料在微生物的代谢作用下使得添加发酵菌组的粗蛋白含量显著高于未添加发酵菌的(P<0.05),一定程度上提高了饲料的营养价值。在苹果渣[38]、花生粕[39]、海带[40]等的发酵中,发酵底物的粗蛋白含量均得到明显提高,与本试验结果相一致。水产饲料原料经过微生物发酵处理后,其中的蛋白含量得到明显提高[41],能够替代或部分替代鱼粉,从而减少养殖中对鱼粉的依赖,降低养殖成本。
在发酵过程中,酵母通过自身的生长代谢能够产生芳香类物质,有助于改善饲料的风味[42]。发酵的同时,饲料的颜色、黏度等也会有一定的改变[28]。本试验中,添加发酵菌的两个饲料组在发酵结束后,饲料的颜色、气味都明显优于未添加的。
3.3 发酵饲料对稚参生长的影响
饲料经过发酵处理可以一定程度的改善饲料的风味,从而提高摄食量;同时还可以提高饲料的粗蛋白含量,将大分子有机物部分降解为易被吸收消化的小分子物质,使饲料的营养价值得到提高。因此,在稚参的投喂试验中可以看出,投喂发酵饲料的稚参增重率和特定生长率分别为(26.14±0.18)%、(2.11±0.04)%/d,均显著高于对照组(P<0.05)。两种饲料对养殖刺参健康状况的影响主要表现在肠道充盈度方面,说明刺参对发酵饲料的摄食、消化性能优于未发酵的饲料。魏金涛等[43]在发酵饲料喂养断奶仔猪的研究中发现,发酵饲料能够提高仔猪的日增重,同时饲料经过发酵处理后其营养成分的表观消化率得到明显提高。可见,发酵饲料在提高仔猪生长性能方面起到了重要作用[44-46]。另有研究指出,发酵饲料能够改善奶牛的体况,提高产奶量,同时还能缓解奶牛在泌乳中后期产奶量大幅下降的情况[19,47-48],提高经济效益。水产养殖中,采用发酵豆粕替代鱼粉的应用已比较普遍,替代后能够提高养殖动物的特定生长率,一定程度改善饲料的利用率[49-50]。
4 结论
①通过对发酵饲料各评价指标的对比分析可以看出,消毒灭菌处理对饲料发酵效果的影响不明显,考虑到生产成本问题,在本试验条件下无需对原料进行消毒灭菌处理。
②与未发酵饲料相比,发酵饲料能够明显促进稚参健康、快速生长。

