提升教学品质,力避化学教学中的绝对化
——基于“化学反应速率”的分析与思考
杜林存
提升教学品质,力避化学教学中的绝对化
——基于“化学反应速率”的分析与思考
杜林存
以“化学反应速率”为例讨论了如何在日常化学教学中力避绝对化,从而提升教学品质。化学反应速率的表示方法、固体与水的反应速率、固体用量对化学反应速率影响以及反应速率转化的可行性等方面存在教学绝对化的问题,通过分析这些问题并且提出相关措施,希望以此提升教师对此类问题的关注并避免在日后的教学中出现。
化学教学 绝对化 反应速率
“酸和碱的反应是中和反应”“酸酐是酸性氧化物”“铁粉与稀硝酸的反应产物为硝酸铁”……像上述这样绝对化的措辞在中学化学教学中出现频率较高,表面上似乎总结了一些规律,但仔细分析后会发现许多类似的绝对化语言经不起推敲。长此以往,这些化学教学中的绝对化容易使学生形成非黑即白的狭隘化学观,不利于培养学生批判性思维与创新性思维。
一、“化学反应速率”中的教学绝对化
化学反应速率是化学动力学研究的一个分支,能够用来描述化学反应进行的快慢程度。中学阶段对化学反应速率的初步学习,不仅能够提高学生对化学反应的认知水平,而且还能用该知识去解释一些生产、生活中的现象。随着教学的不断深入,笔者发现,在教授这块内容时存在多处教学绝对化,值得深思。
(一)化学反应速率的表示方法究竟是什么
在《化学反应原理》(江苏教育出版社)中对化学反应速率的表示方法有如下描述:通常用单位时间内反应物浓度(常用物质的量浓度)的减少或者生成物浓度的增加来表示化学反应速率[1]。但在实际教学过程中教师可能过分关注“单位时间内浓度的变化”,忽略了语句中“通常”“常用”这两个词,导致学生对化学反应速率表示方法的理解上出现了偏差,片面地认为化学反应速率的表示方法是唯一的。
许多化学反应在溶液中进行,并且浓度的变化易于测量,用单位时间内浓度的变化来表示化学反应速率更具有广泛性,但绝非唯一。即便有的化学反应是在溶液中进行,也不一定非得采用浓度的变化作为衡量依据。为此,笔者也整理了苏教版化学教材中出现过的一些常见判断化学反应快慢的方法。如下所示:
实例1:测定盐酸与碳酸钙反应生成CO2的反应速率;
方法:测量一定时间内产生CO2气体的体积。
实例2:比较同体积不同浓度的盐酸与等质量的NaHCO3粉末的反应速率;
方法:相同时间内产生气体的多少。
实例3:比较硫代硫酸钠与酸的反应速率;
方法:相同时间内产生固体的多少。
由此可见,化学反应速率的表示方法具有多样性,关键在于针对不同化学反应的特点选择一个方法可行、操作简单的衡量标准。这就需要教师在课堂上对化学反应速率的表示方法作深入透彻的分析,从而避免学生对化学反应速率表示方法认知的绝对化。
(二)固体与H2O真的没有化学反应速率吗
固体在化学反应中必然有化学反应速率,只是其物质的量浓度为定值,因此不常用单位时间内浓度变化来表示固体化学反应速率。但是化学反应速率的表达方式具有多样性,因此可以结合生产、生活以及科学研究的实际情况,选择合适的固体反应速率的表示方法,如:通过记录NiO层厚随时间的变化关系来研究金属镍与氧气的反应速率(单位时间内固体厚度的增加);通过观察等量颗粒大小不同的碳酸钙与等体积等浓度的盐酸反应,依据固体消失的快慢来研究接触面积对化学反应速率影响(单位时间内固体质量或物质的量的变化)。
至于H2O的化学反应速率,需要根据不同情况进行分析。若以气体形式存在,那么它相当于是一种普通的气体,在气相中存在浓度的变化,可以用来表示化学反应速率。若以液态形式存在,那么就得依据不同的体系来判断了。以氯气与水反应为例:,该反应在水中进行,H2O的浓度几乎未发生变化,可视作一个常数,因此一般不用浓度的变化来表示其化学反应速率。再者,即便选择一种合适的表达方式体现水的化学反应速率也无特别的研究意义。又如在含较多乙醇的体系中制备乙酸乙酯:四种物质组成了一个以乙醇为溶剂的液相体系,水在体系中作为一种普通溶质而存在浓度的变化,因此在这里研究水的浓度具有一定的实际意义。浓硫酸在该反应中作为吸水剂,使水在体系中的浓度降低,平衡往正反应方向移动,以此提高产率。基于上述分析思考,H2O的化学反应速率的表达形式还需要具体情况具体分析,不能一概而论。
(三)改变固体的用量化学反应速率一定不变吗
固体在反应过程中虽然不存在浓度的变化,但是改变固体的用量也有可能改变化学反应速率,关键在于用量的改变是否影响固体的接触面积。用相关示意图来表示镁与盐酸的反应。
烧杯乙中的反应相当于在烧杯甲的基础之上增加镁粉的用量,比较图1中甲、乙两烧杯易得,烧杯乙中固体用量的增加使得固体与液体的接触面积增加,从而加快了化学反应速率。然而用量的增加未必使得反应速率加快,按图1中丙、丁两烧杯所示的比例关系,烧杯丁中的镁粉的用量大于烧杯丙中镁粉的用量,但丙中镁粉与盐酸接触面积更大,反应速率比烧杯丁中更快。

图1 盐酸与镁粉反应的示意图
由此可见,固体用量的多少虽然不改变其浓度,但会影响固体与介质的接触面积,从而影响化学反应速率。在实际教学中往往认为固体的用量不改变反应速率,但这必须以固体在介质中接触面积不变作为前提条件,否则结论有失偏颇。
(四)化学反应速率之比一定等于化学计量数之比吗
教材中利用N2O5在四氯化碳中分解的相关数据,让学生归纳出:对于同一个反应,同一时间段内化学反应速率等于化学计量数之比。但在实际教学过程中,教师可能过于注重解题技巧,而忽略了这个规律实际上是利用化学计量数实现不同物质之间物质的量转化的具体应用。如果学生不对其本质有深入理解,盲目利用这一规律,在不同情境中就可能出现问题。如下题:
5.6 g铁粉投入到盛有100 mL 2 mol·L-1稀硫酸的烧杯中,2 min时铁粉刚好溶解(溶解前后溶液体积变化忽略不计),下列表示这个反应的速率正确的是
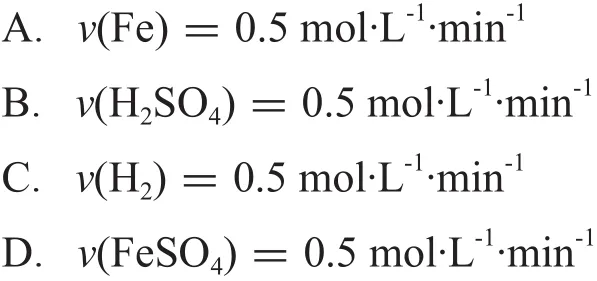
学生利用上述数据能计算出v(H2SO4)=v(FeSO4)=0.5 mol·L-1·min-1,然后利用上述规律多选了A与C。分析其中的原因,是对该规律的理解、应用太过机械与片面。硫酸与硫酸亚铁同处于溶液体系,用计量数进行速率转换自然不会出现问题。但是H2并不属于这个溶液体系,也就是说H2与硫酸及硫酸亚铁并不具有共同的体积,因此无法利用上述规律进行换算。此外,固体铁的浓度是一个定值,也无法用上述规律得到其反应速率。因此“化学反应速率之比等于化学计量数之比”是有前提条件的,需要在理解透彻基础之上再对其进行应用。
二、化学教学绝对化的归因及建言
以“化学反应速率”中存在的教学绝对化为例,笔者进行相关分析与归因并给出相应的建言,以求在今后化学教学中力避教学绝对化,从而提升教学品质。
首先教师要清晰地认识化学的复杂性,人类对于化学的认识尚且不完整,如果不顾化学过程的具体情境,把复杂的化学问题机械化地一刀切,不仅会掩盖化学的特点,而且会导致学生对化学狭隘的认识。其次,教师在授课前应该理清每一个化学知识点的背景、内涵与外延,正如“化学反应速率转化实际上是利用化学计量数实现不同物质之间物质的量转化的具体应用”,这样不仅可以使知识前后统一,避免课堂教学偏离主体,也能让教师的教学更加游刃有余。
另外,教师也要认识到学生对化学知识的认知存在局限性和阶段性,在日常教学时,教师应立足教材,在课堂上尽可能使用规范、严谨的语言,避免得出某些过于肯定的结论,把话说死了、说满了,没有回转的余地,直接导致化学教学的绝对化,降低教学品质。因此不妨采用“通常条件下”“一般情况下”等代替绝对化的词语,为教师今后的教学与学生对化学进一步的认知留下空间。此外,过分注重应试技巧也会导致化学教学绝对化。教师为了学生在考试中少花时间多拿分,往往会人为地去总结一些所谓的正确结论,学生不加思考机械套用,不但限制其思维发展,而且也会让化学教学走进死胡同,降低教学品质。曾有教师笑言“中学化学规律总结越多错误就越多”,看来也不无道理。
基于以上分析与思考,力避化学教学绝对化,留给学生思考的空间和时间,这样才能有效地提升化学教学品质,提升学生的思维品质,促进学生可持续发展。
[1] 王祖浩.普通高中课程标准实验教科书:化学反应原理[M]. 5版. 南京:江苏教育出版社,2014:33.
杜林存 浙江省镇海中学 315200

