高产红曲色素低产桔霉素紫色红曲霉转化子筛选与代谢产物分析
许楚旋,任浩,章婷,冯青青,吴巧玉,蒋冬花
(浙江师范大学化学与生命科学学院,浙江金华321004)
高产红曲色素低产桔霉素紫色红曲霉转化子筛选与代谢产物分析
许楚旋,任浩,章婷,冯青青,吴巧玉,蒋冬花
(浙江师范大学化学与生命科学学院,浙江金华321004)
以红曲米中筛选到的紫色红曲霉Mp-41菌株为出发菌株,利用农杆菌介导T-DNA插入转化技术,构建了含有983株红曲霉转化子的T-DNA插入转化子库。用紫外-可见光扫描方法等从转化子库中筛选出10株红曲色素色价稳定高于原始Mp-41菌株的转化子,薄层层析结合高效液相色谱(HPLC)技术分析了10株转化子发酵液中桔霉素的含量;其中,转化子62的红曲色素色价较高,为95.4 U/mL,是原始Mp-41菌株(色素色价50.7 U/mL)的1.88倍,桔霉素含量稳定低于原始Mp-41菌株。以原始Mp-41菌株和转化子62为试验材料,进行5 L发酵罐发酵并定时取样,HPLC等方法分析生长量和发酵液中各种代谢产物的含量。结果显示,转化子62生长速度稍快于原始Mp-41菌株,红曲色素色价和莫纳可林K的含量分别为120.76 U/mL,63.72 mg/L,是原始Mp-41菌株的1.5倍和1.21倍;而桔霉素含量为1.172 4 mg/L,是原始Mp-41菌株的35.08%。因此,利用T-DNA插入的方法对红曲霉进行育种,能产生稳定的遗传变化,在红曲霉资源的利用上有一定潜力。
红曲霉;红曲色素;桔霉素;发酵;T-DNA
红曲霉(Monascus spp.)是我国酿造微生物中的一个重要的属,至今已有数百年的历史[1]。近几年,红曲霉的许多功效相继被证实,其发酵产物红曲色素、Y-氨基丁酸(γ-Aminobutyric Acid,GABA)[2]、莫纳可林K(Monacolin K)[3]等已被广泛应用于医药保健、食品加工及相关领域中[4-5]。
红曲色素是红曲霉生长过程中产生的次级代谢产物,2个最大吸收波峰分别在410,510 nm附近,即黄色光波和红色光波区;作为一种优良的食品天然色素,其被广泛应用于糕点、罐头、糖果等行业[6-9]。1995年法国学者首先在红曲中发现毒性物质——桔霉素,使红曲产品在国内外销售受到了一定限制[10-11]。因此,提高红曲霉有益代谢产物、降低桔霉素含量,对于保护和利用我国传统微生物资源有重要意义[12-13]。
目前的研究热点是从分子水平探讨红曲色素、桔霉素、Monacolin K等代谢产物之间的相互关系[14-15],但进展比较缓慢,大多数研究成果还不能应用于生产。工业微生物菌种的培育,也不失为一种有效发展红曲霉应用的方式,我国科学家利用紫外、微波、超声波、氯化铝等诱变方法对红曲霉进行育种,取得了一些进展[16-18]。
本研究试图利用实验室构建的红曲霉T-DNA插入转化子库[19-20],经过筛选、发酵、代谢产物检测等,掌握T-DNA转化子与原始菌株发酵产物的动态变化特征,探讨这种红曲霉菌种培育方式在实际生产中的可行性,对开发利用红曲霉这一宝贵资源有一定的理论及现实意义。
1 材料和方法
1.1 试验材料
1.1.1 菌株、质粒与转化子紫色红曲霉(Monascus purpureus)Mp-41菌株(简称Mp-41菌株),为浙江师范大学化学与生命科学学院微生物学实验室前期从红曲米中筛选到的高产红曲色素的优良菌株,作为农杆菌介导T-DNA插入转化子库构建的出发菌株;T-DNA质粒,为含有TrpC高效启动子的pATMT1质粒(图1),具有卡那霉素和潮霉素抗性基因序列[19];T-DNA插入Mp-41菌株的红曲霉转化子983株,作为高产红曲色素低产桔霉素转化子的筛选材料。

1.1.2 培养基PDA培养基:马铃薯200 g,葡萄糖20 g,琼脂20 g,水1 000 mL,pH值6.0~6.5(用于Mp-41菌株和转化子的常规培养、活化和保存)。改良PD液体培养基:马铃薯200 g,葡萄糖20 g,牛肉膏5 g,水1 000 mL,pH值6.0~6.5(用于转化子摇瓶培养和筛选)。PD液体培养基:马铃薯200 g,葡萄糖20 g,水1 000 mL,pH值6.0~6.5(用于Mp-41菌株和转化子的一级种子、二级种子培养和5 L发酵罐发酵)。
1.2 试验方法
1.2.1 高产红曲色素、低产桔霉素转化子的筛选以Mp-41菌株为出发菌株,利用实验室建立的农杆菌介导(ATMT)红曲霉转化技术,构建了含有983株转化子的T-DNA插入转化子库[19-20]。
1.2.1.1 菌株的培养将Mp-41菌株和983株转化子分别接种于PDA培养基上活化5 d,用打孔器(孔径0.8 cm)取3个菌饼接入装有40 mL改良PD液体培养基的250 mL锥形瓶中,30℃,200 r/min振荡培养发酵72 h。
1.2.1.2 红曲色素提取和色价检测[20]吸取1 mL的发酵液于5 mL的离心管中,加入2 mL 70%的乙醇,混匀后,调节pH值至6.0~7.0。静置20 min后,5 000 r/min离心10 min,取上清液检测。以70%乙醇溶液做参比,测定其在505 nm处的OD值。按公式计算:色价(U/mL)=稀释倍数×吸光值。
1.2.1.3 桔霉素含量检测[11-12]吸取1 mL的发酵液于5 mL的离心管中,加入2 mL甲醇,混匀后用封口膜封好管口,与磁力搅拌子绑一起,放在60℃的集热式磁力搅拌器内搅拌1h,取出,4℃,3 000 r/min离心15 min;用毛细吸管取上清液点于制好的硅胶板上,用展开剂(甲苯、乙酸乙酯、甲酸的体积比为6∶3∶1)展开,紫外灯下观察Rf值在0.7~0.8之间的黄绿色条带即为桔霉素显色条带。刮取桔霉素条带的硅胶加入甲醇溶解,用HPLC定量检测。
配制梯度浓度的桔霉素标准品用下述色谱条件测定含量并制作标准曲线。Agilent TC-C18液相色谱柱(250 mm×4.6 mm,5 μm),流动相为乙腈∶甲醇∶水=70∶10∶20,荧光检测器(检测波长λex=331nm,λem=500nm),流速为1mL/min,柱温28℃。得出相关系数高的标准曲线后,发酵上清液用相同的色谱条件测定。
1.2.2 T-DNA插入转化子的检测按试剂盒说明书操作,提取PDA培养基上培养5 d的红曲霉菌丝基因组DNA。设计潮霉素抗性基因(hygromycin phosphotransferase gene,hph基因)的上下游引物:hph1:5′-ATGCCTGAACTCACCGCGAC-3′;hph2:5′-CTATTCCTTTGCCCTCGGAC-3′。引物由上海生工公司合成。常规PCR的体系和方法扩增hph基因片段,如扩增条带大小在1 000 bp左右,则证明T-DNA成功插入。
1.2.3 转化子的5L发酵罐发酵产物分析将转化子和Mp-41菌株活化后接入装有150 mL PD种子培养液的250 mL锥形瓶中,30℃,200 r/min摇瓶培养3 d,用作一级种子;再取20 mL菌液接种到新的PD种子培养液中相同条件培养3 d,用作二级种子;取150 mL二级种发酵液接入5L发酵罐中,30℃,pH值5.0,转速200 r/min条件下进行发酵。
1.2.3.1 生长曲线的绘制发酵过程中每隔3 h取样,测定不同时间点Mp-41菌株与转化子菌丝干质量,绘制生长曲线。
菌丝干质量的测定:将所得发酵液过0.177 mm筛网,蒸馏水冲洗菌丝3次,于60℃烘箱中干燥至恒质量后进行称量。
1.2.3.2 红曲色素色价的检测其检测方法同
1.2.1。
1.2.3.3 桔霉素含量检测其检测方法同1.2.1。
1.2.3.4 莫纳可林K含量的检测吸取发酵液1 mL于1.5 mL的离心管中,用保鲜膜包紧管口,煮沸10 min,在4℃,8 000 r/min条件下离心10 min,取上清液用高效液相检测。
色谱条件:AgilentTC-C18液相色谱柱(250mm× 4.6 mm,5 μm),A溶液为乙腈(0.45 μm有机相滤膜过滤),B溶液为pH值2.5的磷酸溶液(0.45 μm水相滤膜过滤)。检测波长为237nm;流速0.6mL/min;柱温50℃。
2 结果与分析
2.1 高产红曲色素、低产桔霉素转化子的筛选
2.1.1 高产红曲色素转化子的筛选用分光光度计检测Mp-41菌株和转化子培养液红曲色素色价,筛选获得了10株红曲色素高于Mp-41菌株的转化子,其中,转化子35,62,552等红曲色素色价显著高于Mp-41菌株,62号转化子红曲色素色价达95.4 U/mL,是Mp-41菌株的1.88倍(表1)。
2.1.2 低产桔霉素转化子的筛选利用甲醇浸提红曲霉转化子发酵液(包括菌丝)中桔霉素,通过薄板层析法,在254 nm紫外光下观察桔霉素条带的明暗程度(图2),初步判别各转化子桔霉素含量的高低;再将桔霉素荧光条带刮下用甲醇溶解,用HPLC精确检测桔霉素含量(表1、图2)。

表1 10株红曲色素色价提高的转化子与桔霉素含量

结果表明,上述10株转化子中35,62,346桔霉素含量相对较低,分别是原始Mp-41菌株的0.61,0.28,0.65倍;97,552桔霉素含量相对较高。综合各转化子发酵液中红曲色素色价和桔霉素含量,最终选定转化子62作为目的菌株进行5L发酵罐发酵产物分析。
2.2 转化子62潮霉素抗性基因PCR验证
将Mp-41菌株和转化子62基因组DNA用引物hph1和hph2进行PCR扩增,结果表明,转化子62在1 106 bp处有清晰条带,片段大小与预期的hph基因片段长度吻合,而Mp-41菌株没有扩增出相应的条带,表明T-DNA已经成功插入到转化子62基因组DNA中(图3)。
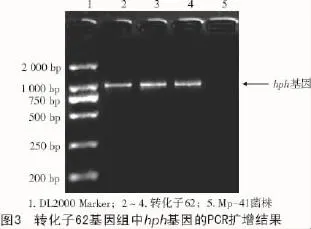
2.3 转化子62发酵罐(5 L)发酵特征和产物的检测
2.3.1 生长曲线每隔4 h取样一次,测定不同发酵时间点Mp-41菌株与转化子62菌丝干质量,绘制生长曲线如图4所示。Mp-41菌株与转化子62的生长曲线变化规律基本类似。在0~24 h为延滞期;28~68 h为对数生长期;64~100 h处于稳定生长期;100 h以后进入衰亡期。转化子62生长速度相对较快,菌丝最大干质量为81.7 g/L,Mp-41菌株为64.4 g/L,转化子62菌丝量为Mp-41菌株的127%。

2.3.2 红曲色素色价随发酵时间的变化每隔4 h取样一次,浸提发酵液中的红曲色素,分光光度法测定吸光值,计算相应红曲色素色价,Mp-41菌株与转化子62色素色价随发酵时间的变化规律基本相似(图5)。0~36 h这2个菌株红曲色素色价均较低,但在40 h后转化子62红曲色素色价开始高于Mp-41菌株;40~80 h这2个菌株的红曲色素均快速增长,100 h左右,色素含量增长趋于平缓。转化子62最高色价达120.76 U/mL,是Mp-41菌株(最高色价为80.61 U/mL)的149.81%(约1.5倍)。

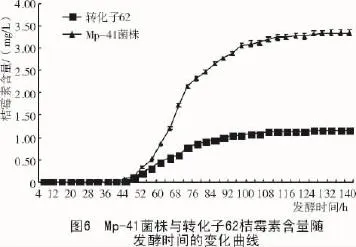
2.3.3 桔霉素含量随发酵时间的变化桔霉素含量随发酵时间的变化曲线如图6所示。转化子62桔霉素最高含量为1.172 4 mg/L,仅为Mp-41菌株(最高含量为3.342 2 mg/L)的35.08%。
2.3.4 莫纳可林K含量随发酵时间的变化莫纳可林K的产生随发酵时间的变化曲线如图7所示。转化子62发酵液中莫纳可林K的最大含量为63.72 mg/L,是Mp-41菌株(最大含量为52.59 mg/L)的121.16%。

3 讨论与结论
通过筛选实验室构建的983株的T-DNA插入转化子库,获得1株编号为62红曲霉转化子,从摇瓶、发酵罐发酵的生长及代谢产物动态变化可以看出,转化子62红曲色素产量稳定高于原始Mp-41菌株,而桔霉素稳定低于原始Mp-41菌株。
转化子62摇瓶中红曲色素色价为95.4 U/mL,5 L发酵罐中红曲色素色价和桔霉素含量分别为120.76 U/mL,1.172 4 mg/L;红曲色素色价是原始Mp-41菌株的1.5倍,桔霉素仅为原始Mp-41菌株的35.08%;转化子62的其他有益代谢产物如莫纳可林K也高于原始Mp-41菌株,为63.72 mg/L,是原始Mp-41菌株的121.16%;生长速度相对较快,菌丝生长量高于原始Mp-41菌株。表明利用ATMT法培育的转化子62性状优于原始Mp-41菌株,并能稳定遗传,用T-DNA插入突变的方法对红曲霉进行育种是可行的。
[1]施安辉.红曲霉、红曲、培养技术及应用[J].山东食品发酵,2013(1):29-33.
[2]秦江辉,周礼红,胡开成,等.高产γ-氨基丁酸的红曲霉菌株选育[J].江苏农业科学,2012,40(3):320-322.
[3]刘颖,林风,郑军荣,等.低桔霉素且产Monacolin K红曲菌株的筛选与鉴定[J].福建农林大学学报:自然科学版,2015,44(5):456-461.
[4]Chen G,Shi K,Song D,et al.The pigment characteristics and productivity shifting in high cell density culture of Monascus anka mycelia[J].BMCBiotechnology,2015,15:72-76.
[5]Hardeep S,Tuli P C,Vikas B,et al.Microbial pigments as natural color sources:current trends and future perspectives[J].Journal of Food Science and Technology,2015,52(8):4669-4678.
[6]FengY,ShaoY,Chen F.Monascus pigments[J].Applied Microbiologyand Biotechnology,2012,96:1421-1440.
[7]侯敏,王艳新,唐帅,等.不同碳源、氮源对红曲发酵产色素的影响[J].山西农业科学2015,43(9):1119-1122.
[8]付荣霞,崔艳,杨树成,等.红曲霉液态发酵条件的优化[J].黑龙江农业科学,2015(7):130-133.
[9]李慧,兰时乐.红曲霉液体深层发酵生产红曲色素条件的研究[J].安徽农业科学,2014,42(19):6360-6363.
[10]Blanc P J,Loret M O,Gomam G.Production of citrinin by various species of Monascus[J].Biotechnology Letters,1995,17(3):291-294.
[11]吉小凤,周育,徐俊锋,等.液相色谱-串联质谱法(LC-MS/MS)测定固态红曲米(粉)中橘青霉素[J].浙江农业学报,2015,27(5):841-847.
[12]杨建,胡川,陈瑶,等.采用响应面优化红曲霉液态发酵产高色价低桔霉素培养基的研究[J].中国调味品,2015,40(8):39-42.
[13]Feng Y L,Shao Y C,Zhou Y X,et al.Effects of glycerol on pigments and monacolin K production by the high monacolin K producing but citrinin free strain Monascus pilosus MS-1[J].European Food Research and Technology,2015,240:635-643.
[14]付桂明,许杨,李燕萍,等.产毒红曲菌中生物合成桔霉素基因-pksCT基因的保守性分析[J].食品科学,2008,29(3):359-363.
[15]邵彦春,李利,杨莎,等.根癌农杆菌介导的定点敲除技术在红色红曲菌中的应用[J].微生物学通报,2009,36(2):231-237.
[16]胡伟莲,戴德慧.红曲霉MY9原生质体诱变育种及遗传稳定性研究[J].食品研究与开发,2013,34(18):78-81.
[17]Kalaivani M,Rajasekaran A.Improvement of monacolin K/citrinin production ratio in Monascus purpureus using UV mutagenesis[J]. Nutrafoods,2014,13(2):79-84.
[18]Balakrishnan B,Karki S,Chiu S H,et al.Genetic localization and in vivo characterization of a Monascus azaphilone pigment biosynthetic gene cluster[J].Applied Microbiology and Biotechnology,2013,97(14):6337-6345.
[19]蔡琪敏,蒋冬花,嵇豪,等.农杆菌介导的紫色红曲霉遗传转化体系的建立和优化[J].微生物学杂志,2010,30(5):68-73.
[20]曹丽凌,齐育平,梁帅帅,等.两株紫色红曲菌根癌农杆菌介导的T-DNA转化子的生物学特性[J].浙江师范大学学报:自然科学版,2013,36(2):217-223.
Screening Monascus Ttransformant of Higher Yield Monascus Pigment with Lower Citrinin and Its Fermented Products Analysis
XUChu-xuan,RENHao,ZHANGTing,FENGQing-qing,WUQiao-yu,JIANGDong-hua
(College ofChemistryand Life Science,ZhejiangNormal University,Jinhua 321004,China)
The Monascus purpureus strain Mp-41 isolated from red yeast rice was used as the original strain for transformation. T-DNA insertion mutation library of M.purpureus strain Mp-41 which contained 983 transformants was established by Agrobacterium fumefaciens-mediated transformation(ATMT)technology.When all transformants incubated in improved PD broths,the fermentation broths were analyzed for production of Monascus pigment and citrinin by using UV visible spectrophotometer and HPLC.10 transformants were found the yield ofMonascus pigment significant higher than that oforiginal strain Mp-41.The production ofMonascus pigment by transformant strain 62(95.4 U/mL)was 1.88 higher than that of the original strain Mp-41(50.7 U/mL),and the yield of citrinin was lower than that of strain Mp-41 stably.Timing sampling and analysis by HPLC for fermentation broth by original strain Mp-41 and transformant 62 in 5 L fermenter,it indicated that the growth rate of transformant 62 was faster than original strain Mp-41, the production ofMonascus pigment,Monacolin Kwere 120.76 U/mL,63.72 mg/L,higher(1.5 and 1.21 times)than that oforiginal strain Mp-41,the yield of citrinin was 1.172 4 mg/L,lower(only 35.08%)than original strain Mp-41 respectively.As a result,breeding Monascus strain by the way of ATMT could generate into stably heredity,the protection and application of Monascus resource had a certain potential.
Monascus purpureus;Monascus pigment;citrinin;fermentation;T-DNA
Q785
A
1002-2481(2016)03-0318-05
10.3969/j.issn.1002-2481.2016.03.12
2015-11-19
国家自然科学基金项目(31270061;31570013)
许楚旋(1996-),女,浙江金华人,在校学生,研究方向:应用微生物。蒋冬花为通信作者。

