血清胃蛋白酶原及胃泌素-17水平与胃癌的相关性研究
陈卿奇,羊文芳,吴素江,许小康
(海南省儋州市第一人民医院:1.消化科;2.检验科;3.神经内科;4.病理科 571799)
血清胃蛋白酶原及胃泌素-17水平与胃癌的相关性研究
陈卿奇1,羊文芳2,吴素江3,许小康4
(海南省儋州市第一人民医院:1.消化科;2.检验科;3.神经内科;4.病理科 571799)
目的 探讨血清胃蛋白酶原(PG)Ⅰ、PGⅡ、PGⅠ/PGⅡ(PGR)及胃泌素-17(GAS-17)水平在胃癌患者中的诊断价值及相关性。方法 选取该院454例胃部疾病患者,104例健康者(对照组),分别检测各组血清PGⅠ、PGⅡ、PGR及GAS-17水平。绘制受试者工作特征(ROC)曲线评价血清PGⅠ、PGⅡ、PGR及GAS-17水平在胃癌和非胃癌组中的诊断价值,并应用Logistic回归模型分析胃癌的独立危险因素。结果 胃癌组、萎缩性胃炎组和非萎缩性胃炎组血清PGⅠ及PGR明显低于对照组(P<0.05),且胃癌组血清PGⅠ及PGR明显低于萎缩性胃炎组、非萎缩性胃炎组和胃溃疡组(P<0.05)。胃癌组血清GAS-17水平明显高于对照组、非萎缩性胃炎组和胃溃疡组(P<0.05)。胃癌组与对照组血清PGⅡ水平比较差异无统计学意义(P>0.05)。进展期胃癌组血清PGⅠ及PGR明显低于早期胃癌组(P<0.05),而血清GAS-17水平明显高于早期胃癌组(P<0.05)。胃癌TNM分期越高,血清PGⅠ水平降低越明显(P<0.05),血清GAS-17水平升高越明显(P<0.05)。ROC曲线显示,血清PGⅠ、PGⅡ、PGR、GAS-17及联合检测对胃癌组的诊断效能优于非胃癌组,且4项联合检测的曲线下面积(AUC)高于单项检测,其灵敏度和特异度分别为83.7%和76.8%。多元Logistic回归分析发现胃癌家族史、不正确的饮食习惯、PGⅠ及GAS-17进入回归模型,其OR值及95%CI分别为6.481(3.562~11.316)、2.843(1.103~6.918)、2.624(1.094~4.521)、1.735(1.046~3.912)。结论 血清PGⅠ、GAS-17及PGR水平变化与胃癌的病程进展及分化程度相关,联合检测有助于提高胃癌的阳性诊断率。
胃癌;胃蛋白酶原;胃泌素-17
胃癌是最常见的主要恶性肿瘤之一,其致死率居全球所有恶性肿瘤的第2位[1]。早期胃癌5年生存率超过90%,而进展期胃癌的5年生存率低于50%,因此提高胃癌的早期诊断率是降低胃癌发生率和病死率的关键。近年研究表明,胃癌的发生与胃肠道激素的表达异常有关,胃泌素-17(gastrin-17,GAS-17)在胃癌的发生、发展过程中具有一定的促进作用,GAS水平升高对癌细胞的生长和恶性转化有一定影响[2]。血清胃蛋白酶原(pepsinogen,PG)可分为胃蛋白酶原Ⅰ(PGⅠ)和胃蛋白酶原Ⅱ(PGⅡ),其水平可间接反映不同部位胃黏膜腺体的组织状态和分泌功能。研究发现,血清PGⅠ水平在早期胃癌和进展期胃癌中存在明显差异[3],PG可作为癌前病变高危人群和胃癌血清筛查指标[4]。本研究对不同胃部疾病患者血清PGⅠ、PGⅡ、PGⅠ/PGⅡ(PGR)及GAS-17进行检测分析,旨在探讨其在胃癌患者中的诊断价值及相关性。
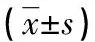
表1 各组血清PGⅠ、PGⅡ、PGR及GAS-17水平的比较
1 资料与方法
1.1 一般资料 选取2013年1月至2015年8月在本院做胃镜检查的门诊及消化科住院的胃部疾病患者454例,根据胃镜检查及组织病理学结果将受检者分为胃癌患者102例和非胃癌患者352例。胃癌分为早期胃癌35例和进展期胃癌67例,其中男62例,女40例,平均年龄(59.42±13.18)岁。非胃癌患者分为3组,萎缩性胃炎组94例,其中男58例,女36例,平均年龄(57.68±13.22)岁;非萎缩性胃炎组143例,其中男81例,女62例,平均年龄(57.41±14.73)岁;胃溃疡组115例,其中男68例,女47例,平均年龄(57.02±13.26)岁。所有研究对象在纳入本研究前1周内无特殊用药史(包括质子泵抑制剂、H2受体拮抗剂及胃黏膜保护剂等),既往无胃部手术史。另选择健康体检证实无胃、肠、心、肝、肾等疾病者104例作为对照组,男63例,女41例,平均年龄(58.16±13.04)岁。各组年龄和性别比较差异均无统计学意义(P>0.05),具有可比性。本研究经医院伦理委员会批准,并获得患者或家属知情同意。
1.2 方法
1.2.1 胃镜及病理检查 分别于胃体、胃窦黏膜各取一块组织标本,所见黏膜病变处至少取两块组织标本,75%乙醇固定后立即送检,并行常规苏木精-伊红(HE)染色。根据WHO胃癌分型和悉尼系统标准进行分级和病理诊断。胃癌TNM分期参照美国癌症联合委员会(AJCC)最新癌症分期标准分为Ⅰ~Ⅳ期,其中Ⅰ期17例,Ⅱ期25例,Ⅲ期36例,Ⅳ期24例。
1.2.2 检测方法 所有研究对象均空腹采集静脉血5 mL,3 500 r/min离心5 min分离血清,-20 ℃冰箱保存待测。酶联免疫吸附试验(ELISA)检测PGⅠ、PGⅡ及GAS-17,试剂盒由芬兰BIOHIT公司提供,酶标仪由奥地利Anthos公司提供,并计算PGR。操作过程严格按照仪器和试剂盒标准进行。
2 结 果
2.1 各组血清PGⅠ、PGⅡ、GAS-17水平及PGR的比较 胃癌组、萎缩性胃炎组和非萎缩性胃炎组血清PGⅠ及PGR明显低于对照组,且胃癌组血清PGⅠ及PGR明显低于萎缩性胃炎组、非萎缩性胃炎组和胃溃疡组,差异均有统计学意义(P<0.05)。胃癌组、萎缩性胃炎组和胃溃疡组血清GAS-17水平明显高于对照组和非萎缩性胃炎组,且胃癌组血清GAS-17水平明显高于胃溃疡组,差异均有统计学意义(P<0.05)。胃癌组和胃溃疡组血清PGⅡ水平明显高于萎缩性胃炎组,而胃癌组血清PGⅡ水平明显低于胃溃疡组,差异均有统计学意义(P<0.05)。见表1。
2.2 早期胃癌组、进展期胃癌组血清PGⅠ、PGⅡ、GAS-17水平及PGR的比较 进展期胃癌组血清PGⅠ及PGR明显低于早期胃癌组,血清GAS-17水平明显高于早期胃癌组,差异有统计学意义(P<0.05);而血清PGⅡ在两组间比较差异无统计学意义(P>0.05)。见表2。
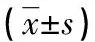
表2 早期胃癌组和进展期胃癌组血清PGⅠ、PGⅡ、PGR及GAS-17水平的比较
2.3 胃癌TNM分期血清PGⅠ、PGⅡ、GAS-17水平及PGR的比较 随着胃癌TNM分期越高,血清PGⅠ水平降低越明显(P<0.05),血清GAS-17水平升高越明显(P<0.05)。血清PGⅡ及PGR在Ⅰ~Ⅳ期比较差异无统计学意义(P>0.05)。见表3。
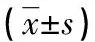
表3 胃癌TNM分期血清PGⅠ、PGⅡ、PGR及GAS-17水平的比较
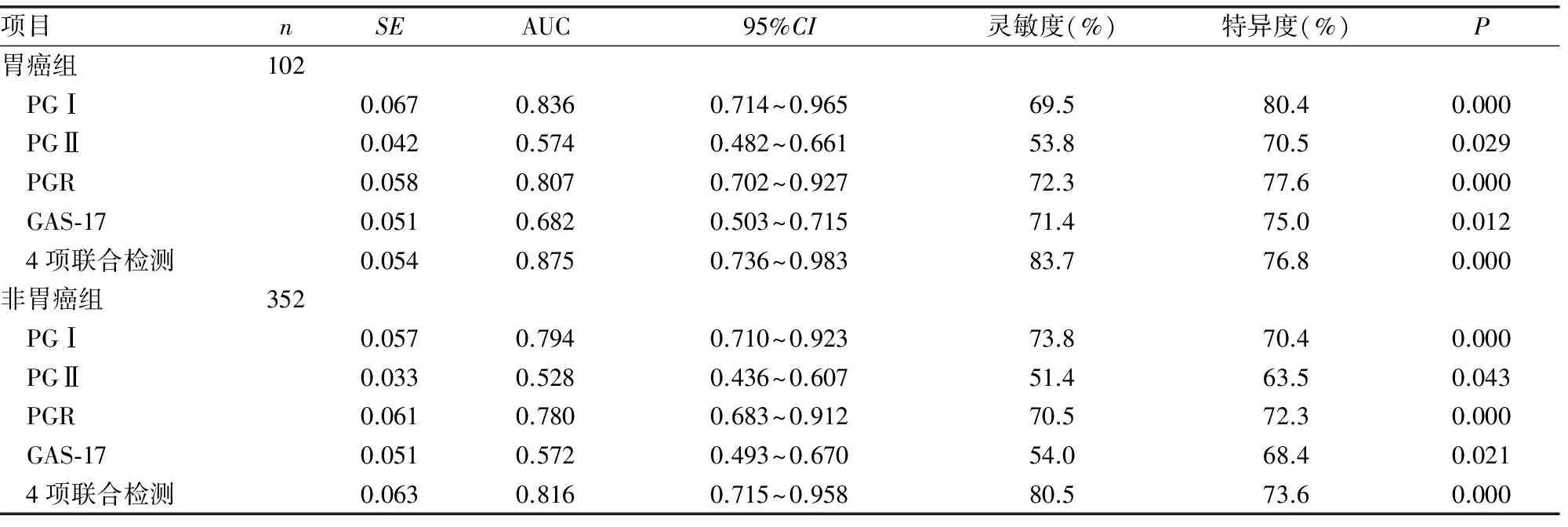
表4 ROC曲线评价血清PGⅠ、PGⅡ、PGR、GAS-17及联合检测对胃癌和非胃癌组的诊断价值
2.4ROC曲线评价血清PGⅠ、PGⅡ、PGR、GAS-17及联合检测对胃癌和非胃癌组的诊断价值 血清PGⅠ、PGⅡ、PGR、GAS-17及联合检测在胃癌和非胃癌组中的AUC分别为0.836、0.574、0.807、0.682、0.875和0.794、0.528、0.780、0.572、0.816,与对照组(AUC=0.5)比较,差异有统计学意义(P<0.05);血清PGⅠ、PGⅡ、PGR、GAS-17及联合检测对胃癌组的诊断效能优于非胃癌组,且4项联合检测的AUC高于单项检测,其灵敏度和特异度分别为83.7%和76.8%,见表4及图1、2。
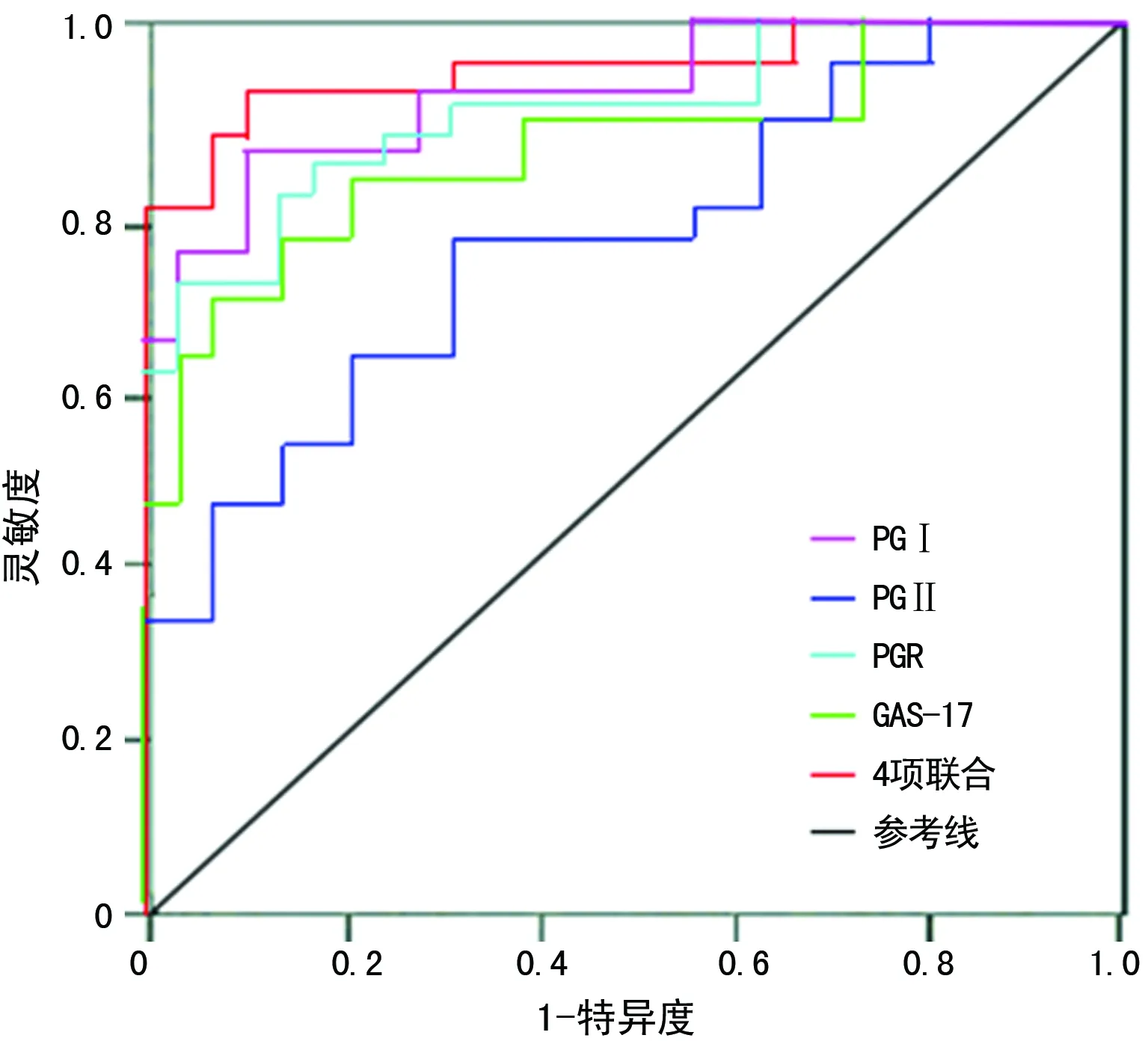
图1 血清PGⅠ、PGⅡ、PGR、GAS-17及联合检测对胃癌组诊断的ROC曲线
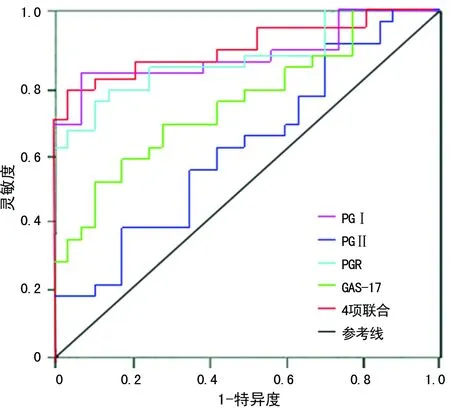
图2 血清PGⅠ、PGⅡ、PGR、GAS-17及联合检测对非胃癌组诊断的ROC曲线
2.5 多元Logistic回归分析胃癌的独立危险因素 以有或无胃癌为因变量,以年龄、性别(男或女)、吸烟史(有或无)、不正确的饮食习惯(有或无)、高血压史(有或无)、糖尿病史(有或无)、胃癌家族史(有或无)、PGⅠ、PGⅡ、PGR及GAS-17为自变量,进行多元Logistic回归分析(α入选=0.1,α剔除=0.15),发现胃癌家族史、不正确的饮食习惯、PGⅠ及GAS-17进入回归模型,其OR及95%CI分别为6.481(3.562~11.316)、2.843(1.103~6.918)、2.624(1.094~4.521)、1.735(1.046~3.912)。见表5。

表5 多元Logistic回归分析胃癌的独立危险因素
3 讨 论
胃癌是我国最常见的恶性肿瘤之一,发病率呈逐年上升趋势,早期胃癌缺乏一定的症状和体征,难以发现,而出现明显的临床症状时,多属于进展期胃癌,其病死率高、预后差。因此,早期诊断对胃癌的治疗及预后具有重要意义。
GAS-17主要由胃窦部G细胞合成和分泌,它通过激活ECL细胞刺激胃酸分泌,释放组织胺,刺激胃肠道上皮细胞增殖。近年来随着对GAS-17研究的不断深入,发现其与胃癌的浸润及转移密切相关[5-6]。高水平的GAS-17与胃癌,尤其是胃底和胃体癌的形成与发展有关,萎缩性胃炎伴随的高胃泌素状态对胃黏膜癌变有促进作用[7]。Mishra等[8]发现GAS-17通过激活丝裂原活化蛋白激酶(MAPK)及JNKl信号途径可能促进胃癌细胞的浸润与转移。PG是一种由375个氨基酸组成的蛋白多肽链,根据其生化和免疫学特性不同分为PGⅠ和PGⅡ。越来越多的研究表明,血清PGⅠ水平、PGR变化与胃黏膜不同部位的病变和严重程度相关,是筛查胃癌癌前病变及诊断胃癌的参考指标[9-10]。有研究认为胃癌可导致胃黏膜主细胞丢失,胃底腺数量减少或被幽门腺所取代,主细胞数量减少,胃黏膜分泌功能受损,血清PGⅠ水平下降,而血清PGⅡ水平由于分泌PGⅡ的细胞分布较广及幽门腺化生等因素保持稳定甚至有轻度增加,导致PGR下降[11-12]。
本研究结果显示,胃癌组、萎缩性胃炎组和非萎缩性胃炎组血清PGⅠ及PGR明显低于对照组,且胃癌组血清PGⅠ及PGR明显低于萎缩性胃炎组、非萎缩性胃炎组和胃溃疡组;而胃癌组血清GAS-17水平明显高于对照组、非萎缩性胃炎组和胃溃疡组。Narita等[13]研究发现进展期胃癌患者中PGⅠ基因受损突变增加,导致PGⅠ水平严重降低。胃癌的发生、发展过程中血清GAS-17水平逐渐升高,可能与胃泌素对胃黏膜的营养作用,以及胃泌素通过与其受体结合,启动细胞内多种信号转导途径通路密切相关[14]。进展期胃癌组血清PGⅠ及PGR明显低于早期胃癌组,血清GAS-17水平明显高于早期胃癌组;血清PGⅡ在两组间比较,差异无统计学意义(P>0.05)。Sun等[15]研究表明,由于PGⅡ基因具有多态性,所以胃癌患者对PGⅡ合成分泌影响不大。随着胃癌TNM分期越高,血清PGⅠ水平降低越明显,血清GAS-17水平升高越明显。TNM分期越高血清GAS-17水平越高,可能是癌细胞浸润破坏B淋巴细胞致胃酸分泌减少,反馈性引起GAS-17分泌增多。上述结果提示,血清PGⅠ、PGⅡ、GAS-17水平及PGR能够反映胃黏膜功能状态及变化,PGⅠ和GAS-17与胃癌的分化程度相关,对胃癌筛查具有一定意义。
ROC曲线结果显示,血清PGⅠ、PGⅡ、PGR、GAS-17及联合检测对胃癌组的诊断效能优于非胃癌组,且4项联合检测的AUC高于单项检测,其灵敏度和特异度分别为83.7%和76.8%。国内外关于血清学指标对胃癌的研究,结果存在差异,其原因可能与检测方法、试剂及研究对象、种族、饮食习惯、居住环境等因素有关。Hosseini等[16]的研究结果显示,胃癌患者血清PGⅠ水平无明显变化,而PGⅡ、GAS-17水平及PGR均升高,但其灵敏度和特异度均较低。日本学者对血清PG变化在胃癌筛查中的价值进行了大量的研究,认为血清PGⅠ≤70μg/L和PGR≤3时在胃癌筛查中灵敏度和特异度较高,分别为80%和70%[17]。多元Logistic回归分析结果显示,胃癌家族史、不正确的饮食习惯、PGⅠ及GAS-17是胃癌的独立危险因素。Kang等[18]对胃癌患者胃泌素水平的检测分析,发现由非萎缩性胃炎到萎缩性胃炎到胃癌,胃泌素的生成逐渐增多,高水平的GAS-17是预测胃癌发生的危险因素。Jiang等[19]研究表明,胃癌家族史及不良生活习惯是胃癌发生的危险因素。
综上所述,血清PGⅠ、PGⅡ、PGR及GAS-17水平与胃癌的发生、发展相关,可作为胃癌的筛查手段。胃癌家族史、不正确的饮食习惯、PGⅠ及GAS-17是胃癌的独立危险因素,联合PGⅡ和PGR检测可提高其灵敏度和特异度,对胃癌的早期诊断及治疗具有重要意义。
[1]TakahashiT,SaikawaY,KitagawaY.Gastriccancer:currentstatusofdiagnosisandtreatment[J].Cancers(Basel),2013,5(1):48-63.
[2]Nejadi-KelarijaniF,RoshandelG,SemnaniS,etal.Diagnosticvaluesofserumlevelsofpepsinogensandgastrin-17forscreeninggastritisandgastriccancerinahighriskareainnorthernIran[J].AsianPacJCancerPrev,2014,15(17):7433-7436.
[3]TerasawaT,NishidaH,KatoK,etal.PredictionofgastriccancerdevelopmentbyserumpepsinogentestandHelicobacterpyloriseropositivityinEasternAsians:asystematicreviewandmeta-analysis[J].PLoSOne,2014,9(10):e109783.
[4]KishikawaH,KimuraK,ItoA,etal.Predictorsofgastricneoplasiaincasesnegativeforhelicobacterpyloriantibodyandwithnormalpepsinogen[J].AnticancerRes,2015,35(12):6765-6771.
[5]KimYM,KimIM,NamTJ.CapsosiphonfulvescensglycoproteinreducesAGSgastriccancercellmigrationbydownregulatingtransforminggrowthfactor-β1andintegrinexpression[J].IntJOncol,2013,43(4):1059-1065.
[6]MishraP,SenthivinayagamS,RangasamyV,etal.Mixedlineagekinase-3/JNKlaxispromotesmigrationofhumangastriccancercellsfollowinggastrinstimulation[J].MolEndocrinol,2010,24(3):598-607.
[7]KikuchiR,AbeY,IijimaK,etal.Lowserumlevelsofpepsinogenandgastrin17arepredictiveofextensivegastricatrophywithhigh-riskofearlygastriccancer[J].TohokuJExpMed,2011,223(1):35-44.
[8]MishraP,SenthivinayagamS,RanaA,etal.Glycogensynthasekinase-3betaregulatessnailandbeta-cateninduringgastrininducedmigrationofgastriccancercells[J].JMolSignal,2010,16(7):5-9.
[9]ReshetnikovOV,KurilovihSA,KrotovSA,etal.Physiologicalandclinicalimplicationsofgastricpepsinogens[J].KlinMed(Mosk),2014,92(3):26-30.
[10]GhoshalUC,KumarS,KrishnaniN,etal.SerologicaⅠassessmentofgastricinteslinalmetaplasiaandatrophyusingpepsinogen-Ⅰ,pepsinogen-Ⅱandgastrin-7levelsinalowincidenceareaofgastriccancerendemicforH.pyloriinfection[J].TropGastroenterol,2011,32(4):292-298.
[11]YunL,BinZ,GuangqiG,etal.ClinicalsignificanceincombineddetectionofserumpepsinogenⅠ,pepsinogenⅡandcarbohydrateantigen242ingastriccancer[J].Hepatogastroenterology,2014,61(129):255-258.
[12]SierraR,UneC,RamlrezV,etal.AssociationofserumpepsinogenwithatrophicbodygastritisinCostaRica[J].ClinExpMed,2006,6(2):72-78.
[13]NaritaY,OdaS,TakenakaO,etal.Lineage-specificduplicationandlossofpepsinogengenesinhominoidevolution[J].JMolEvol,2010,70(4):313-324.
[14]XuW,ChenGS,ShaoY,etal.Gastrinactingonthecholecystokinin2receptorinducescyclooxygenase-2expressionthroughJAK2/STAT3/PI3K/Aktpathwayinhumangastriccancercells[J].CancerLett,2013,332(1):11-18.
[15]SunLP,GuoXL,ZhangY,etal.ImpactofpepsinogenCpolymorphismonindividualsusceptibilitytogastriccanceranditsprecancerousconditionsinaNortheastChinesepopulation[J].JCancerResClinOncol,2009,135(8):1033-1039.
[16]HosseiniM,AmoueianS,AttaranzadehA,etal.Serumgastrin17,pepsinogenⅠandpepsinogenⅡinatrophicgastritispatientslivinginNorth-EastofIran[J].JResMedSci,2013,18(3):225-229.
[17]ShimoyamaT,AokiM,SasakiY,etal.ABCscreeningforgastriccancerisnotapplicableina
Japanesepopulationwithhighprevalenceofatrophicgastritis[J].GastricCancer,2012,15(3):331-334.
[18]KangJM,KimN,YooJY,etal.TheroleofserumpepsinogenandgastrintestforthedetectionofgastriccancerinKorea[J].Helicobacter,2008,13(2):146-56.
[19]JiangX,TsengCC,BernsteinL,etal.Familyhistoryofcancerandgastroesophagealdisordersandriskofesophagealandgastricadenocarcinomas:acase-controlstudy[J].BMCCancer,2014,14(4):2407-2414.
Study on correlation of serum pepsinogen,gastrin-17 levels and gastric cancer*
ChenQingqi1,YangWenfang2,WuSujiang3,XuXiaokang4
(1.DepartmentofDigestive;2.DepartmentofLaboratory;3.DepartmentofNeurology;4.DepartmentofPathology,theFirstPeople′sHospitalofDanzhou,Danzhou,Hainan571700,China)
Objective To investigate the diagnostic value and correlation of serum pepsinogen(PG)Ⅰ,PGⅡ,PGⅠ/PGⅡ(PGR)and gastrin-17(GAS-17)level in patients with gastric cancer.Methods A total of 454 cases of patients with gastric diseases and 104 healthy controls were selected to detect the serum levels of PG,PG,PGR and GAS-17 in each group.The diagnostic value of the PG I,PG II,PGR and GAS-17 levels in patients with gastric cancer and non gastric cancer was evaluated by the ROC curve,and the Logistic regression model was used to analyze the independent risk factors for gastric cancer.Results The serum PGⅠ level and PGR in gastric cancer group,atrophy gastritis group and non atrophic gastritis group were significantly lower than those in control group(P<0.05).The serum PGⅠ level and PGR in gastric cancer group were significantly lower than those in atrophy gastritis group,non atrophic gastritis group and gastric ulcer group(P<0.05).The serum GAS-17 level in gastric cancer group was significantly higher than that in control group,non atrophic gastritis group and gastric ulcer group(P<0.05).There was no significant statistical significance in serum PGⅡ level between gastric cancer group and control group(P>0.05).The serum PGⅠ level and PGR in advanced gastric cancer group were significantly lower than those in early gastric cancer group(P<0.05).The serum GAS-17 level in advanced gastric cancer group was significantly higher than that in early gastric cancer group(P<0.05).The TNM staging of gastric cancer was higher,the serum PGⅠ level was decreased more significantly(P<0.05),and the serum GAS-17 level was increased more significantly(P<0.05).ROC curve showed the diagnostic efficiency of serum PGⅠ,PGⅡ,PGR,GAS-17 and combined detection of the four indicators in gastric cancer group was better than that in non gastric cancer group,and the AUC of combined detection of the four indicators was higher than that of single detection,its sensitivity and specificity were 83.7% and 76.8%.Multivariate Logistic regression analysis found that family history of gastric cancer,incorrect eating habits,PGⅠ and GAS-17 were included into the regression model,theORvalue and 95%CIwere 6.481(3.562-11.316),2.843(1.103-6.918),2.624(1.094-4.521),1.735(1.046-3.912).Conclusion Serum PGⅠ,PGR and GAS-17 were correlated with progression and differentiation degree of gastric cancer,and combined detection contribute to improving the positive diagnosis percentage of gastric cancer.
gastric cancer;pepsinogen;gastrin-17
海南省医药卫生科研项目(15A200002)。 作者简介:陈卿奇(1976-),主治医师,本科,主要从事临床消化内科研究。
��·临床研究
10.3969/j.issn.1671-8348.2016.35.013
R735.2
A
1671-8348(2016)35-4938-04
2016-06-11
2016-09-19)
*:P<0.05,与对照组比较;#:P<.05,与胃癌组比较;△:P<0.05,与非萎缩性胃炎组比较;▽:P<0.05,与萎缩性胃炎组比较。

