新生期大鼠反复惊厥后8-OH-dG和CytC的表达与细胞凋亡的关系研究
刘月影,王春红,崔 盈,倪 宏
(1.江南大学附属医院儿科,江苏无锡 214062;2.苏州大学附属儿童医院神经病学研究室,江苏苏州 215003)
新生期大鼠反复惊厥后8-OH-dG和CytC的表达与细胞凋亡的关系研究
刘月影1,王春红1,崔 盈1,倪 宏2
(1.江南大学附属医院儿科,江苏无锡 214062;2.苏州大学附属儿童医院神经病学研究室,江苏苏州 215003)
目的 探讨新生期大鼠反复惊厥后8-羟基-2′-脱氧鸟嘌呤核苷(8-OH-dG)和细胞色素C(CytC)的表达与细胞凋亡的关系。方法 将24只日龄8d的大鼠分为惊厥组和对照组,惊厥组进一步分为惊厥后3h、24h、48h,每组6只。采用吸入三氟乙醚诱导新生期大鼠反复惊厥持续状态模型,酶联免疫吸附试验(ELISA)检测血清8-OH-dG水平,实时荧光定量PCR(RT-PCR)和原位末端标记法(TUNEL)分别检测海马CytC的表达和细胞凋亡。结果 与对照组相比,TUNEL显示惊厥组海马神经元细胞凋亡明显增多(P<0.01),呈棕黄色颗粒。血清8-OH-dG水平在末次惊厥后各时间点均明显高于对照组(P<0.05或P<0.01)。与对照组相比,CytC在末次惊厥后3h、24h增高(P<0.01),48h后下降至正常水平。8-OH-dG、CytC与细胞凋亡呈正相关(r=0.662、0.565,P<0.05)。结论 线粒体损伤可能参与了发育期反复惊厥后脑损伤。
反复惊厥;8-羟基-2′-脱氧鸟嘌呤核苷;细胞色素C;细胞凋亡;新生大鼠
线粒体途径是细胞凋亡的重要途径[1]。当有害物质如活性氧自由基等作用于线粒体,一方面可以使线粒体内膜通透性增高,线粒体肿胀,外膜破裂,线粒体凋亡标志物细胞色素C(CytC)释放至胞质,通过激活Caspase家族诱发细胞凋亡;另一方面可以通过线粒体DNA 链断裂、位点突变、双链畸变及DNA碱基的氧化损伤等形式造成 DNA 损伤,进一步导致细胞凋亡,8-羟基-2′-脱氧鸟嘌呤核苷(8-OH-dG)作为损伤DNA后形成的最常见产物,是DNA损伤的重要指标[2]。线粒体作为细胞内的重要细胞器在癫痫发病中的作用已受到学者的广泛关注[3]。本研究拟通过建立新生期反复惊厥大鼠模型,观察反复惊厥发作后8-OH-dG 和CytC的表达及其与细胞凋亡的关系,探讨线粒体损伤在发育期反复惊厥脑损伤中的意义。
1 材料与方法
1.1 材料
1.1.1 实验动物 24只日龄 8 d 的健康 SD 大鼠,体质量 18.23~21.79 g,由上海斯莱克实验动物有限责任公司提供[许可证号 SCXK(沪)2012-0002]。大鼠分为惊厥组和对照组,惊厥组进一步分为惊厥后3 h、24 h、48 h亚组,每组6只。
1.1.2 主要仪器与试剂 三氟乙醚 (Aldrich Chem.Co.PO.Box355,美国)密封避光保存;8-OH-dG试剂盒(Cayman Chemical Company,美国);TUNEL试剂盒 (Boehringer Mannheim,德国);Trizol(Invitrogen Life Technologies,美国);逆转录酶、核糖核苷酸酶抑制剂(Invitrogen,美国); Light Cycler 2.0 PCR仪(Roche,德国);RT6000型酶标仪(霄杜生命科学有限公司,深圳);引物根据Gene Bank核酸序列,Premier 3.0软件设计,上海生工公司合成。Cyt-C:上游引物为5′-GGT GAT GTT GAA AAA GGC AAG AA-3′,下游引物为5′-TGC TTG CCT CCT TTT TCC A-3′;β-actin:上游引物为5′-GAC AGG ATG CAG AAG GAG ATT ACT-3′,下游引物为5′-TGA TCC ACA TCT GCT GGA AGG T-3′。
1.2 方法
1.2.1 新生期大鼠反复惊厥模型的建立 采用三氟乙醚按照田甜等[4]的方法致反复惊厥,使惊厥持续30 min;每天诱导1次,连续7 d(惊厥组);对照组除不给予三氟乙醚外其他处理与惊厥组相同。
1.2.2 标本的制备和取材 取对照组和反复惊厥后3、24、48 h大鼠各6只,10%水合氯醛麻醉后心脏取血,并立即断头,冰上取一侧海马-80 ℃保存备用于实时荧光定量PCR(RT-PCR)检测CytC表达水平;另一半脑组织立即置于10%的多聚甲醛中固定,用于制作石蜡标本进行苏木精-伊红(HE)、原位末端标记法(TUNEL)染色;取出的血液静置1 h后4 ℃ 1 800 r/min离心10 min,取上清液,分装于EP管中,立即置于-80 ℃保存备用,以酶联免疫吸附试验(ELISA)检测8-OH-dG水平。
1.2.3 TUNEL法检测细胞凋亡 取10%多聚甲醛溶液中固定1周以上的脑组织,常规脱水、透明、浸蜡、包埋,切片,脱蜡,TUNEL法检测细胞凋亡。操作过程按凋亡试剂盒说明书进行,在高倍视野下(×400)选6个不同的视野,计算各个视野的阳性细胞数(胞核呈棕黄色颗粒)。
1.2.4 ELISA法检测血清8-OH-dG水平 检测前取出-80 ℃保存标本,常温解冻,所有标本均为同批测定。各项操作严格按试剂盒说明进行,每份标本重复3次,取其均值。结果基于每次8-OH-dG标准溶液实验的线形校正曲线计算,所得数据以每微克DNA所含的8-OH-dG的皮克数(pg/μg)表示。
1.2.5 RT-PCR法检测CytC mRNA的表达 参照 Trizol试剂说明书,提取海马的总RNA并逆转录cDNA。PCR 扩增采用SYBR Premix ExTaq探针法。PCR 反应用β-actin 作为内参,反应条件:94 ℃预变性5 min,94 ℃变性15 s,60 ℃退火延伸1 min,循环45次。绘制扩增曲线,反应结束后得到各反应管的循环阈值(Ct),将目的基因CytC的Ct值与内参基因β-actin的Ct值相减得到校正的目的基因CytC的Ct值,即△Ct,CytC基因相对表达量以2-△Ct表示。
2 结 果
2.1 凋亡细胞TUNEL染色及计数结果 海马CA1区,对照组少见TUNEL阳性细胞,细胞核呈深染棕褐色(图1A),惊厥组末次惊厥后3h凋亡细胞开始明显表达,高峰表达主要出现于末次惊厥后24h(图1B),末次惊厥后48h可见阳性细胞开始衰减。惊厥组末次惊厥后3、24、48h凋亡细胞数均高于对照组,差异均有统计学意义(均P<0.01),见表1。
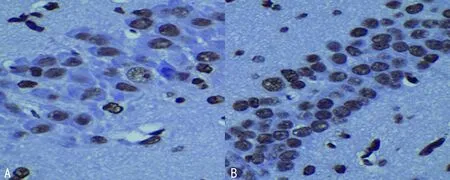
A:对照组;B:惊厥组末次惊厥后24h。
图1 大鼠海马CA1区TUNEL染色凋亡细胞表达(×400)
2.2 血清8-OH-dG水平的动态变化 与对照组相比,惊厥组血清8-OH-dG水平在末次惊厥发作后 3、24、48h均升高(P<0.05或P<0.01);其中末次惊厥后24h增高最明显,见表1。
2.3CytCmRNA表达水平的动态变化 与对照组相比,惊厥组大鼠CytC表达在末次惊厥后3h升高,持续至惊厥发作后24h(P<0.01),在惊厥发作后48h下降至正常水平,见表1。
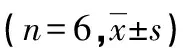
表1 新生期大鼠反复惊厥后不同时间点细胞凋亡情况及8-OH-dG、CytC的表达
*P<0.05,#P<0.01,与对照组比较。
2.4 相关性分析 血清8-OH-dG水平及CytCmRNA表达水平均与凋亡细胞数呈正相关(r值分别为0.662、0.565,P值分别为0.001、0.003)。
3 讨 论
研究表明,细胞凋亡是反复惊厥发作后脑损伤的主要形式[5]。在细胞凋亡的死亡受体、内质网信号和线粒体信号3条途径中,线粒体途径是中枢神经系统疾病较重要的细胞凋亡途径[6]。
线粒体既是能量代谢和细胞呼吸的重要场所,更是细胞凋亡的中心[7]。而CytC是线粒体电子传递链的重要组成部分,其既参与线粒体能量代谢,当其释放到细胞质中又直接参与细胞凋亡的调节。大量实验研究发现CytC从线粒体释放到细胞质是多种细胞凋亡的共同表现,在细胞凋亡过程中起关键作用,敲除CytC基因的细胞能对刺激因素诱导的凋亡具有明显的耐受性[8]。已有研究表明,癫痫发作后N-甲基-D天冬氨酸(NMDA)受体激活,钙超载、活性氧等可引起线粒体的通透性转运孔开放,CytC释放至细胞质[9]。CytC与凋亡蛋白活化因子-1(Apaf-1)及天冬氨酸特异性半胱氨酸蛋白酶(Caspase)-9形成CytC/Apaf-1/Caspase-9复合体,作用于下游的Caspase-3,从而诱发细胞凋亡[10]。本研究发现,CytC在反复惊厥发作后海马组织中表达量明显增加,并在3h时呈现出明显表达,持续至惊厥发作后24h。结合本课题组前期对反复惊厥后Caspase-3表达变化在12h出现峰值的研究结果发现[11],CytC从线粒体中释放后,可进一步激活下游的Caspase-3级联反应诱导细胞凋亡;本研究TUNEL法亦显示在惊厥发作后24h海马CA1区细胞凋亡达到高峰,CytC和凋亡细胞数呈正相关,进一步说明CytC与细胞凋亡有关。但末次惊厥发作后48hCytC已经回落到正常水平,而细胞凋亡仍有轻度升高,提示CytC增高后通过Caspase-3级联反应等机制才能诱导细胞凋亡的发生,存在一定的后续效应,进一步支持上述观点。
氧化应激是导致惊厥发作后脑损伤的重要途径,在动物实验及人体内都证实,惊厥发作后氧化应激与惊厥发作后细胞凋亡有关[12-13]。在机体内存在氧化和抗氧化两大系统,大量的实验证实,在惊厥发作后该系统失衡,氧化系统被激活,抗氧化物酶活性降低,脑防御氧自由基功能受损或降低,机体的总抗氧化能力下降,活性氧产生过多和聚集,进一步诱导细胞凋亡[14]。DNA损伤是氧化损伤的重要表现之一[2],线粒体DNA是DNA的重要组成部分,在机体内发挥重要功能。当机体受到外界刺激时,DNA链上鸟嘌呤G被氧化为8-OH-dG,可导致基因发生G→T突变,8-OH-dG的部位还易发生碱基脱落和DNA链断裂。因此,检测DNA氧化损伤产物 8-OH-dG表达,将为探讨DNA氧化损伤与反复惊厥后脑损伤发生的关系提供生物标志[15]。本实验研究显示,反复惊厥发作后8-OH-dG持续增高至惊厥发作后48h,提示在反复惊厥发作后存在DNA损伤。8-OH-dG与细胞凋亡的相关性分析显示,二者之间呈正相关,但8-OH-dG先于细胞凋亡下降,提示DNA损伤后可能通过一系列的机制才能进一步导致细胞凋亡的发生,与Qiu等[16]的研究结果相似。
综上所述,新生期反复惊厥后存在细胞凋亡,线粒体途径在细胞凋亡过程中发挥重要作用。线粒体损伤及可能的修复途径是一个非常复杂的过程,涉及众多因子的参与,还待更进一步的深入研究,从而为治疗发育期惊厥性脑损伤提供新的思路和治疗靶点。
[1]HiebertJB,ShenQ,ThimmeschAR,etal.Traumaticbraininjuryandmitochondrialdysfunction[J].AmJMedSci,2015,350(2):132-138.
[2]GürlerH,BilgiciB,AkarAK,etal.IncreasedDNAoxidation(8-OHdG)andproteinoxidation(AOPP)bylowlevelelectromagneticfield(2.45GHz)inratbrainandprotectiveeffectofgarlic[J].IntJRadiatBiol,2014,90(10):892-896.
[3]ZsurkaG,KunzWS.Mitochondrialdysfunctionandseizures:theneuronalenergycrisis[J].LancetNeurol,2015,14(9):956-966.
[4]田甜,孙奇,赵东敬,等.新生期大鼠反复惊厥后皮质丛生蛋白的表达及生酮饮食的干预作用[J].中华实用儿科临床杂志,2014,29(9):694-697.
[5]LiLY,LiJL,ZhangHM,etal.TGFβ1treatmentreduceshippocampaldamage,spontaneousrecurrentseizures,andlearningmemorydeficitsinpilocarpine-treatedrats[J].JMolNeurosci,2013,50(1):109-123.
[6]StreckEL,GonöalvesCL,FurlanettoCB,etal.Mitochondriaandthecentralnervoussystem:searchingforapathophysiologicalbasisofpsychiatricdisorders[J].RevBrasPsiquiatr,2014,36(2):156-167.
[7]王佺荃,张文丽,元小冬,等.线粒体在细胞凋亡中的作用[J].中国医学创新,2015,12(6):143-146.
[8]GuaragnellaN,PassarellaS,MarraE,etal.Knock-outofmetacaspaseand/orcytochromecresultsintheactivationofaROS-independentaceticacid-inducedprogrammedcelldeathpathwayinyeast[J].FEBSLett,2010,584(16):3655-3660.
[9]BuddSL,TennetiL,LishnakT,etal.Mitochondrialandextramitochondrialapoptoticsignalingpathwaysincerebrocorticalneurons[J].ProcNatlAcadSciUSA,2000,97(11):6161-6166.
[10]WangQS,SongF,ZhaoX,etal.Expressionchangesofapoptotic-relatedproteinsinnervetissuesofratstreatedwithallylchloride[J].Toxicology,2007,231(1):58-67.
[11]NiH,FengX,XiaoZJ,etal.DynamicpatternofgeneexpressionofZnT-4,caspase-3,LC3,andPRG-3inratcerebralcortexfollowingflurothyl-inducedrecurrentneonatalseizures[J].BiolTraceElemRes,2011,143(3):1607-1615.
[12]PuttacharyS,SharmaS,StarkS,etal.Seizure-inducedoxidativestressintemporallobeepilepsy[J].BiomedResInt,2015(2015):745613.
[13]MorimotoM,SatomuraS,HashimotoT,etal.Oxidativestressmeasurementandpredictionofepilepticseizureinchildrenandadultswithseveremotorandintellectualdisabilities[J].JClinMedRes,2016,8(6):437-444.
[14]TsaiHL,ChangCN,ChangSJ.Theeffectsofpilocarpine-inducedstatusepilepticusonoxidativestress/damageindevelopinganimals[J].BrainDev,2010,32(1):25-31.
[15]OhkawaN,OkumuraA,MiyataR,etal.Cerebrospinalfluidoxidativestressmarkerlevelsandcytokineconcentrationsinaneonatewithincontinentiapigmenti[J].PediatrNeurol,2014,51(5):737-740.
[16]QiuX,CaoL,YangX,etal.Roleofmitochondrialfissioninneuronalinjuryinpilocarpine-inducedepilepticrats[J].Neuroscience,2013,245:157-165.
The relationship between the expression of 8-OH-dG,CytC and apoptosis in neonatal rats with recurrent seizures*
LiuYueying1,WangChunhong1,CuiYing1,NiHong2
(1.DepartmentofPediatrics,AffiliatedHospitalofJiangnanUniversity,Wuxi,Jiangsu214062,China; 2.NeurologyLaboratory,Children′HospitalofSoochowUniversity,Suzhou,Jiangsu215003,China)
Objective To investigate the relationship between the expression of 8-OH-dG,CytC and cell apoptosis in neonatal rats with recurrent seizures.Methods Totally 24 eight-day-old SD rats were randomly divided into two groups:the recurrent seizures group(RS group,30 minutes seizure induced of flurothyl once per day for 7 consecutive days) and control group(CON group,rats were treated without flurothyl).At designated time points(CON group,3,24,48 h after the last seizure in RS group),the hippocampus of six rats from each group were rapidly dissected out after blood drawn from heart.The 8-OH-dG was detected by ELISA method.The expression of CytC and apoptosis were detected by RT-PCR and TUNEL method respectively.Results Compared with the CON group,TUNEL showed that the apoptotic cell counts in RS group were rapidly increased,especially at 24 h after the last seizures[(54.83±7.16)cells/HPFvs. (15.16±2.48)cells/HPF,P<0.01].In RS group,the serum levels of 8-OH-dG were significantly higher than that in CON group,particularly at 24 h after the last seizures[(1.263 83± 0.221 30)pg/μgvs.(0.822 16±0.039 380)pg/μg,P<0.01].The expression level of CytC mRNA significantly increased at 3 h after the last seizures(0.114 36±0.005 28vs. 0.093 01±0.009 79,P<0.01) and at 24 h after the last seizures(0.105 62±0.007 26vs. 0.093 01±0.009 79,P<0.01),then decreased to normal level.There were obviously positive correlation between 8-OH-dG,CytC and apoptosis(r=0.662,0.565;P<0.05).Conclusion The levels of 8-OH-dG and CytC were significantly up-regulated and had positive correlation with apoptosis,suggesting that mitochondrial damage might be involved in the brain injury after the recurrent seizures in neonatal rats.
recurrent seizures;8-OH-dG;CytC ;cell apoptosis;neonatal rats
国家自然科学基金资助项目(81471337);无锡市卫计委科研项目(MS201518)。 作者简介:刘月影(1975-),副主任医师,硕士,主要从事小儿神经系统疾病临床研究。
��·基础研究
10.3969/j.issn.1671-8348.2016.35.004
R
A
1671-8348(2016)35-4908-03
2016-07-12
2016-10-21)

