MicroRNA-199a通过缺氧诱导因子1α抑制胃癌细胞上皮间充质转化
郑 桁,张 伟,王 康
(四川省医学科学院/四川省人民医院胃肠外科,成都 610072)
MicroRNA-199a通过缺氧诱导因子1α抑制胃癌细胞上皮间充质转化
郑 桁,张 伟,王 康
(四川省医学科学院/四川省人民医院胃肠外科,成都 610072)
目的 探讨微小RNA-199a(miR-199a)调节缺氧诱导因子-1α(HIF-1α)表达对缺氧状态下胃癌细胞上皮间充质转化(EMT)的影响及可能的机制。方法 低氧处理胃癌细胞24h,通过转染si-HIF-1α和miR-199amimic,采用实时荧光定量聚合酶链式反应(PCR)检测miR-199a的表达水平,蛋白质印迹法(Westernblotting)检测HIF-1α及相关EMT蛋白的变化,镜下观察胃癌细胞形态。结果 低氧处理后,能下调miR-199amRNA表达,上调HIF-1α和间叶细胞标志蛋白表达,下调E-钙黏素(E-cadherin)蛋白表达。转染miR-199amimic后能抑制HIF-1α的蛋白表达,转染si-HIF-1α和miR-199amimic后能部分逆转低氧的作用,抑制EMT过程的发展。结论miR-199a可能通过降低HIF-1α的表达抑制缺氧状态下胃癌细胞的EMT过程的发生。
微小RNA-199a;缺氧诱导因子-1α;缺氧;上皮间充质转化
缺氧是所有实体肿瘤的共同特征,在肿瘤的起始和发展中起重要作用。缺氧时细胞内高表达的缺氧诱导因子-1α(hypoxia inducible factor-1α,HIF-1α)可诱导肿瘤发生上皮间充质转化(epithelial-mesenchymal transiton,EMT),促进肿瘤细胞异质化和肿瘤血管形成,从而参与肿瘤的浸润、转移。HIF-1α在胃癌组织中的表达明显高于癌旁组织,且HIF-1α的表达与胃癌的分化程度、浸润深度、淋巴结转移和TNM分期有关,HIF-1α可促进EMT的发生,从而促进胃癌的转移[1]。EMT是具有极性的上皮细胞转化为具有间质表型细胞的生物学过程,主要特征有细胞黏附分子表达减少、间质表型细胞标志物表达增加和转录因子表达上调。微小RNA(microRNA,miR)作为一种非编码单链RNA在EMT的发生中也发挥了重要作用。研究发现,结肠癌中miR-199a-5p的下调可以活化EMT相关信号,促进结肠癌的转移和侵袭[2]。本研究用1%氧气(O2)处理胃癌细胞AGS,模拟缺氧环境,观察缺氧对胃癌细胞EMT的影响,并以miR-199a mimic和si-HIF-1α转染胃癌细胞,分析EMT标志蛋白的表达情况及细胞形态的变化,探讨miR-199a调控HIF-1α表达参与缺氧状态下胃癌细胞EMT的作用。
1 材料与方法
1.1 细胞及细胞培养 胃癌AGS细胞购自中国科学院上海生科院细胞中心(来源于ATCC细胞库)。细胞用含10%胎牛血清的RPMI1640培养液,加入100 U/mL青霉素和100 g/mL链霉素双抗,置于37 ℃、5%二氧化碳(CO2)的恒温培养箱中培养。
1.2 仪器与试剂 低氧培养箱购自美国Thermo公司。胎牛血清购自天津灏洋有限公司,RPMI1640培养液购自美国Hyclone公司,lipofectAMINE2000购自美国Invitrogen公司,miR-199a和U6引物、miR-199a mimics、control mimics和si-HIF-1α由广州锐博合成,Trizol、逆转录试剂盒、SyberGreen试剂盒均购自日本TaKaRa公司,二喹啉甲酸(BCA)蛋白定量试剂盒、一抗二抗稀释液、超敏蛋白显影液、β-actin一抗、羊抗兔二抗购自碧云天生物技术所,兔抗人HIF-1α、N-钙黏蛋白、E-钙黏蛋白、SNAIL抗体购自美国Abcam公司。
1.3 方法
1.3.1 寡核苷酸和siRNA转染 按LipofectAMINE2000说明书操作,将miR-199a mimics(50 nmol/L)、mimic对照和si-HIF-1α(100 nmol/L)、si对照分别转染至融合度为50%的胃癌AGS细胞中,无血清培养液培养细胞6 h后更换为完全培养基继续培养24 h,转染后细胞用于后续实验。
1.3.2 AGS细胞中miR-199a mRNA表达的检测 采用实时荧光定量聚合酶链式反应(PCR)检测AGS细胞中miR-199a mRNA的表达。收集不同分组的AGS细胞,磷酸盐缓冲液(PBS)洗涤细胞3次,按Trizol试剂盒说明抽提细胞总RNA,紫外分光光度计检测RNA水平和260与280 nm处的吸光度(A)值比值(A260/A280),取100 ng总RNA按逆转录试剂盒说明书合成cDNA。以cDNA为模板加入miR-199a或U6上下游引物(由广州锐博合成),和SybrGreen进行PCR扩增。条件:第1步,95 ℃ 30 s;第2步,95 ℃ 5 s、60 ℃ 30 s,共40个循环。以2-△△CT值计算各样本中miR-199a的相对表达水平。实验重复3次。
1.3.3 HIF-1α及EMT相关标志蛋白的表达 采用蛋白质印迹法(Western blotting)检测HIF-1α及EMT相关标志蛋白的表达。收集不同分组的AGS细胞,提取总蛋白,BCA检测蛋白水平,按40 g计算蛋白质上样体积,8%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)电泳后转移至聚偏氟乙烯(PVDF)膜上,5%脱脂牛奶室温封闭1 h,一抗4 ℃孵育过夜(HIF-1α稀释比例为1∶500,其余稀释比例为1∶1 000),Tris缓冲生理盐水-吐温溶液(TBST)洗膜3次,二抗(抗兔1∶5 000,β-actin为抗鼠二抗1∶5 000)室温孵育1 h,TBST洗膜3次,化学发光法显影。
1.3.4 倒置光学显微镜下观察AGS细胞形态 收集转染control、1% O2、+miR-199a mimics、+control mimics处理后的AGS细胞,在倒置光学显微镜下随机选择3个视野(×200),观察细胞的形态变化,并进行拍照。
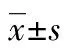
2 结 果
2.1 低氧上调HIF-1α的表达 1%O2处理胃癌细胞24h后,与常氧组比较,低氧可以诱导HIF-1α表达,而si-HIF-1α转染后能明显抑制HIF-1α的表达,si阴性对照组对HIF-1α表达无明显影响,见图1。
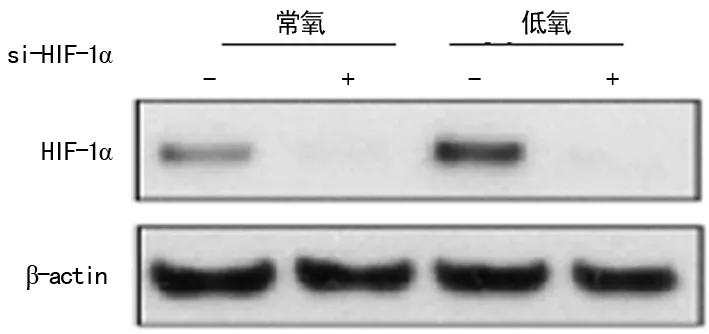
图1 Western blotting检测HIF-1α表达
2.2si-HIF-1α抑制胃癌EMT为了研究HIF-1α对胃癌细胞EMT的影响,将si-HIF-1α转染入AGS细胞内48h后低氧处理24h,WesternBlotting检测胃癌细胞株AGS中上皮细胞标志物E-钙黏素(E-cadherin)和间叶细胞标志物纤维连接蛋白(fibronectin)、波形蛋白(vimentin)、N-钙黏蛋白(N-cadherin)和SNAIL蛋白的表达。结果显示:与常氧组比较,低氧可诱导胃癌细胞间叶细胞标志物表达上调,而转染si-HIF-1α后,间叶细胞标志物表达明显降低,E-cadherin蛋白表达上调,见图2。
2.3 低氧下调miR-199a的表达 1%O2处理胃癌细胞24h后,与常氧组比较,低氧可以下调miR-199amRNA的表达,而转染miR-199amimic后能明显上调miR-199a的表达,mimic对照组对miR-199a表达无明显影响,见图3。
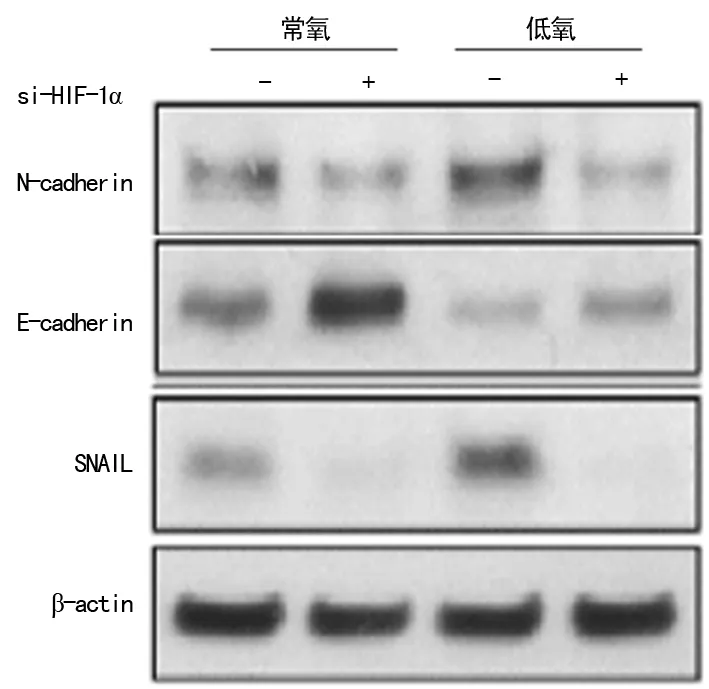
图2 Western blotting检测EMT相关蛋白表达
*:P<0.01,与常氧组比较;#:P<0.01,与低氧组比较;n=3。
图3miR-199amRNA表达

图4 Western blotting检测HIF-1α表达
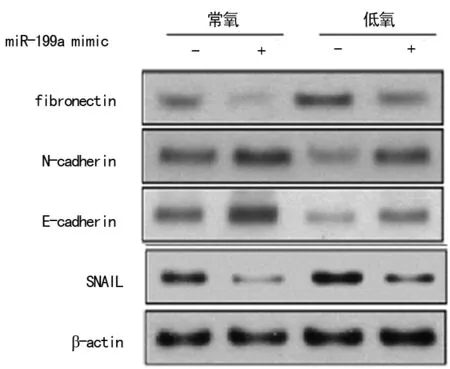
图5 Western blotting检测EMT相关蛋白表达
2.4 过表达miR-199a通过HIF-1α抑制胃癌EMT实验证明,转染miR-199amimic后能明显抑制HIF-1α的表达,见图4,并上调上皮细胞标志物E-cadherin蛋白水平,抑制间叶细胞标志物的表达。mimiccontrol组对上述蛋白表达无明显影响,见图5。
2.5 过表达miR-199a对胃癌细胞形态变化的影响 在倒置光学显微镜下观察发现,低氧24h胃癌细胞中长梭形细胞明显增加,而转染miR-199amimics后细胞由长梭形变为多角形或卵圆形,见图6。
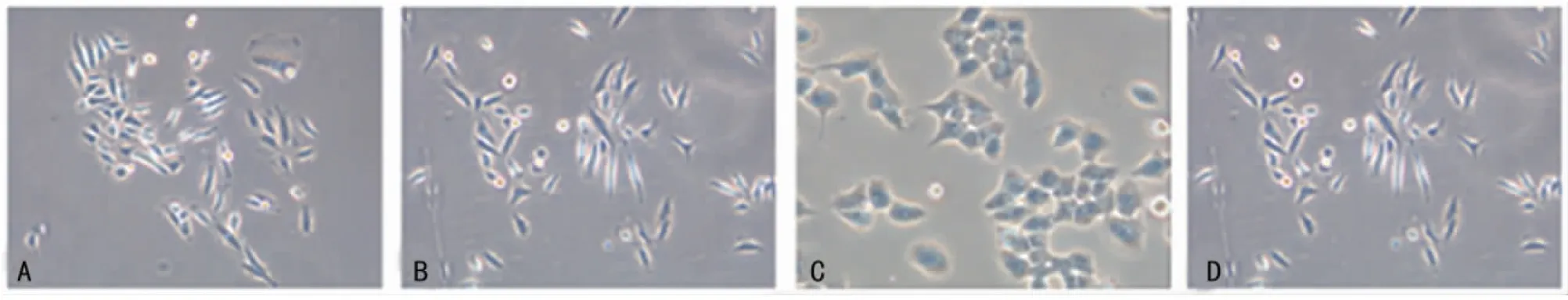
A:常氧组;B:低氧组;C:+miR-199amimics组;D:mimic对照组。
图6 倒置显微镜下观察miR-199amimics转染对低氧处理后胃癌细胞的形态影响(×200)
3 讨 论
胃癌是我国常见的恶性肿瘤之一,严重威胁人们的健康安全。胃癌转移是影响胃癌患者疗效和获得长期生存的关键问题。近年来多项研究证实,多种miRNA在胃癌中的表达异常,导致癌基因的激活和抑癌基因缺失,从而调控癌细胞的增殖和生长。
本研究探讨了低氧对胃癌细胞EMT的影响,1%O2处理后,上皮相关指标E-cadherin表达水平明显下调,而vimentin、N-cadherin和SNAIL蛋白表达水平明显升高,提示EMT的发生,同时细胞内HIF-1α蛋白表达上调,这一结果说明缺氧环境下HIF-1α蛋白表达上调可导致EMT的发生。miRNA能与癌基因或抑癌基因的3′-非翻译区(3′-untranslatedregion,3′-UTR)特异性结合,通过对靶基因mRNA的降解或转录后调控抑制基因的表达,从而在肿瘤的发生、发展中起重要作用。生物信息学预测分析HIF-1α可能为miR-199a的靶基因,目前已有研究通过Westernblotting和双荧光素酶报告基因实验证实HIF-1α为miR-199a的靶基因[3-4],本实验也证明了miR-199amimic可以下调HIF-1α的蛋白表达。在难治性癫痫患者的癫痫组织[5]、酒精性肝病肝窦内皮细胞[6]和多发性骨髓瘤细胞[7]中,miR-199a表达下调,HIF-1α表达上调,过表达miR-199a后可下调HIF-1α。接下来作者检测了在缺氧条件下胃癌细胞中miR-199a的表达水平,结果发现miR-199a在缺氧状态下表达下调,而转染miR-199amimics可部分逆转缺氧导致的EMT相关蛋白的变化,倒置光学显微镜下观察也可见细胞由缺氧状态时的长梭形转变为多角形或卵圆形,说明胃癌细胞EMT减少。这一结果进一步证实,miR-199a能抑制胃癌细胞的EMT过程。
低氧可通过转化生长因子-β(TGF-β)信号通路、Notch信号通路、Wnt信号通路、刺猬信号通路、肝细胞生长因子/肝细胞生长因子受体信号通路及多种转录因子等途径参与肿瘤EMT调控[8]。在缺氧状态下,肿瘤细胞中TGF-β表达增加,低氧可通过直接提高SMAD3mRNA水平影响TGF-β信号通路[9];反之,TGF-β通过SMAD信号通路特异性减少脯氨酰羟化酶的表达,从而间接增强HIF-1α蛋白的稳定性[10]。在肿瘤缺氧微环境中,HIF-1α与Notch信号通路细胞内结构域功能性结合,增强转录活性,提高转录因子SNAIL表达水平,从而导致EMT[11-12],而HIF-1α与Notch信号通路可能是通过HES1依赖的SRC/转录激活子3(STAT3)通路发挥作用[13]。肿瘤低氧环境中,HIF-1α通过N端区域将β-catenin从T细胞因子-4(TCF-4)移除,结合N-乙酰基转移酶基因hARD1使β-catenin失活,虽然HIF-1α可抑制β-catenin的转录活性,但低氧环境对β-catenin诱发的EMT是必要的[14]。Wnt/β-catenin信号能通过增加EMT相关的HIF-1α蛋白活性和抑制肿瘤死亡,加速缺氧诱导的EMT进展[15]。
综上所述,本研究表明在缺氧状态下,胃癌细胞内上调的HIF-1α可诱导EMT的发生,过表达miR-199a可通过抑制HIF-1α从而抑制EMT过程,为胃癌细胞的靶向治疗提供新的线索。
[1]倪小晴,张佐阳,吴继锋.HIF-1α蛋白在胃癌中的表达及其与Wnt信号通路、上皮-间质转化的关系[J].临床与实验病理学杂志,2014,30(2):140-144.
[2]HuY,LiuJ,JiangB,etal.MiR-199a-5plossup-regulatedDDR1aggravatedcolorectalcancerbyactivatingepithelial-to-mesenchymaltransitionrelatedsignaling[J].DigDisSci,2014,59(9):2163-2172.
[3]贾筱琴.miR-199a对肝癌的抑制作用及分子机制研究[D].南京:南京医科大学,2010.
[4]JiangY,ZhuY,WangX,etal.TemporalregulationofHIF-1andNF-κBinhypoxichepatocarcinomacells[J].Oncotarget,2015,6(11):9409-9419.
[5]JiangG,ZhouR,HeX,etal.ExpressionlevelsofmicroRNA-199andhypoxia-induciblefactor-1alphainbraintissueofpatientswithintractableepilepsy[J].IntJNeurosci,2016,126(4):326-334.
[6]YeligarS,TsukamotoH,KalraVK.Ethanol-inducedexpressionofET-1andET-BRinliversinusoidalendothelialcellsandhumanendothelialcellsinvolveshypoxia-induciblefactor-1alphaandmicrorNA-199[J].JImmunol,2009,183(8):5232-5243.
[7]RaimondiL,AmodioN,DiMartinoMT,etal.Targetingofmultiplemyeloma-relatedangiogenesisbymiR-199a-5pmimics:invitroandinvivoanti-tumoractivity[J].Oncotarget,2014,5(10):3039-3054.
[8]郭晓川,石燕,陈丽,等.缺氧诱导因子对肿瘤细胞上皮-间质转化的诱导机制[J].2015,36(1):90-93.
[9]AliA,ZhangP,LiangfangY,etal.KLF17empowersTGF-β/SmadsignalingbytargetingSmad3-dependentpathwaytosuppresstumorgrowthandmetastasisduringcancerprogression[J].CellDeathDis,2015(6):e1681.
[10]vanZijlF,MairM,CsiszarA,etal.Hepatictumor-stromacrosstalkguidesepithelialtomesenchymaltransitionatthetumoredge[J].Oncogene,2009,28(45):4022-4033.
[11]IshidaT,HijiokaH,KumeK,etal.NotchsignalinginducesEMTinOSCCcelllinesinahypoxicenvironment[J].OncolLett,2013,6(5):1201-1206.
[12]SahlgrenC,GustafssonMV,JinS,etal.Notchsignalingmediateshypoxia-inducedtumorcellmigrationandinvasion[J].ProcNatlAcadSciUSA,2008,105(17):6392-6397.
[13]LeeJH,SukJ,ParkJ,etal.NotchsignalactivateshypoxiapathwaythroughHES1-dependentSRC/signaltransducersandactivatorsoftranscription3pathway[J].MolCancerRes,2009,7(10):1663-1671.
[14]LimJH,ChunYS,ParkJW.Hypoxia-induciblefactor-1alphaobstructsaWntsignalingpathwaybyinhibitingthehARD1-mediatedactivationofbeta-catenin[J].CancerRes,2008,68(13):5177-5184.
[15]ZhangQ,BaiX,ChenW,etal.Wnt/β-cateninsignalingenhanceshypoxia-inducedepithelial-mesenchymaltransitioninhepatocellularcarcinomaviacrosstalkwithhif-1αsignaling[J].Carcinogenesis,2013,34(5):962-973.
MicroRNA-199a inhibits EMT process in AGS cell by regulating HIF-1α gene expression
ZhengHeng,ZhangWei,WangKang
(DepartmentofGastrointestinalSurgery,SichuanAcademyofMedicalSciences/SichuanProvincialPeople′sHospital,Chengdu,Sichuan610072,China)
Objective To investigate the effect of microRNA-199a(miR-199a) on hypoxia epithelial-mesenchymal transition(EMT) of gastric carcinoma by regulating hypoxia inducible factor-1α(HIF-1α) gene expression and its probable mechanism.Methods After hypoxia for 24 h,si-HIF-1α and miR-199a mimic were transfected to gastric cancer cells.The expression levels of miR-199 was detected by using quantitative real-time PCR.The levels of HIF-1α and related protein in EMT were examined by Western blotting.Gastric cancer cell morphology were observed with an inverted microscope.Results After hypoxia,the expression levels of miR-199a mRNA and E-cadherin protein were decreased,and the expression levels of HIF-1α and mesenchymal cell marker protein were increased.After transfection of miR-199a mimic,the expression of HIF-1α was inhibited.Then,the transfection of si-HIF-1α and miR-199a mimic could partially reverse the effect of hypoxia and inhibit the development of EMT process.Conclusion miR-199a could suppress the transition process and EMT process under hypoxia,it is may be achieved by down-regulating HIF-1α gene expression.
miR-199a;hypoxia inducible factor-1α;hypoxia;epithelial-mesenchymal transiton
郑桁(1974-),主治医师,硕士,主要从事胃肠外科及胃肠肿瘤方面的研究。
��·基础研究
10.3969/j.issn.1671-8348.2016.35.006
R
A
1671-8348(2016)35-4914-03
2016-05-18
2016-08-06)

