CD1a在鞍区病变表达的临床病理学分析
黄亮亮,吴海波,孙思柏
(安徽省立医院病理科,安徽 合肥 230001)
CD1a在鞍区病变表达的临床病理学分析
黄亮亮,吴海波,孙思柏
(安徽省立医院病理科,安徽 合肥 230001)
目的 探讨CD1a在鞍区病变的表达情况及在病理诊断中的应用意义。方法 回顾性分析194例鞍区肿瘤及非肿瘤性病变的CD1a免疫组织化学染色情况。结果 CD1a在15例Rathke′s 囊肿内的正常垂体细胞、3例增生的腺垂体组织和28例朗格汉斯细胞组织细胞增生症均100%的弥漫性强阳性表达,但在76例垂体腺瘤仅7例灶性阳性。CD1a在6例垂体生殖细胞肿瘤、62例颅咽管瘤、1例颗粒细胞瘤和3例垂体细胞瘤均不表达。结论 CD1a可用于鉴别正常垂体细胞、腺垂体增生和垂体腺瘤,前两者呈弥漫性阳性,后者不表达或呈灶性阳性;由于正常垂体细胞表达CD1a,当有垂体炎时不要误诊为朗格汉斯细胞组织细胞增生症。
CD1a;垂体腺瘤;朗格汉斯细胞组织细胞增生症;病理学
CD1a是一种表面糖蛋白,可表达于胸腺皮质细胞、朗格汉斯细胞和树突状细胞,目前也有表达于成熟多克隆T细胞的报道[1]。但CD1a在垂体部位的正常和增生组织以及发生肿瘤时的表达情况尚未见有报道。现回顾性分析近6年来送检的垂体部位的标本,对其临床病理特点和CD1a的表达情况进行分析探讨,以明确CD1a在该部位病理诊断的应用价值和意义。
1 资料与方法
1.1 材料 收集安徽省立医院南区2010年5月至2016年7月垂体部位的送检标本共194例。
1.2 方法 所有标本用10%福尔马林固定,石蜡包埋,切片厚度5 μm,均经HE染色光镜下观察及辅助免疫组织化学明确诊断。免疫组织化学采用EnVision二步法,所有切片均由两位病理学专家复查后确诊。所用抗体CD1a、S100及EnVision试剂盒均购自福州迈新生物技术开发有限公司。所有免疫组织化学染色均设阳性对照。
2 结果
2.1 临床资料 所有194例标本中Rathke′s 囊肿15例,腺垂体增生3例,垂体腺瘤76例,其中表达促肾上腺皮质激素(ACTH)8例,促甲状腺激素(TSH)3例,卵泡刺激素(FSH)20例,生长激素(GH)9例,催乳素(PRL)16例,多激素垂体腺瘤20例,分别是TSH+FSH+PRL 2例,GH+PRL 6例,ACTH+TSH+FSH+PRL 1例,FSH+促黄体生成素(LH)2例,TSH+FSH 1例,TSH+GH 1例,LH+GH+PRL 1例,此外还有无激素腺瘤6例。非垂体腺瘤性肿瘤包括朗格汉斯细胞组织细胞增生症 28例,颅咽管瘤 62例,生殖细胞肿瘤 6例,垂体细胞瘤 3例,颗粒细胞瘤1例,见表1。
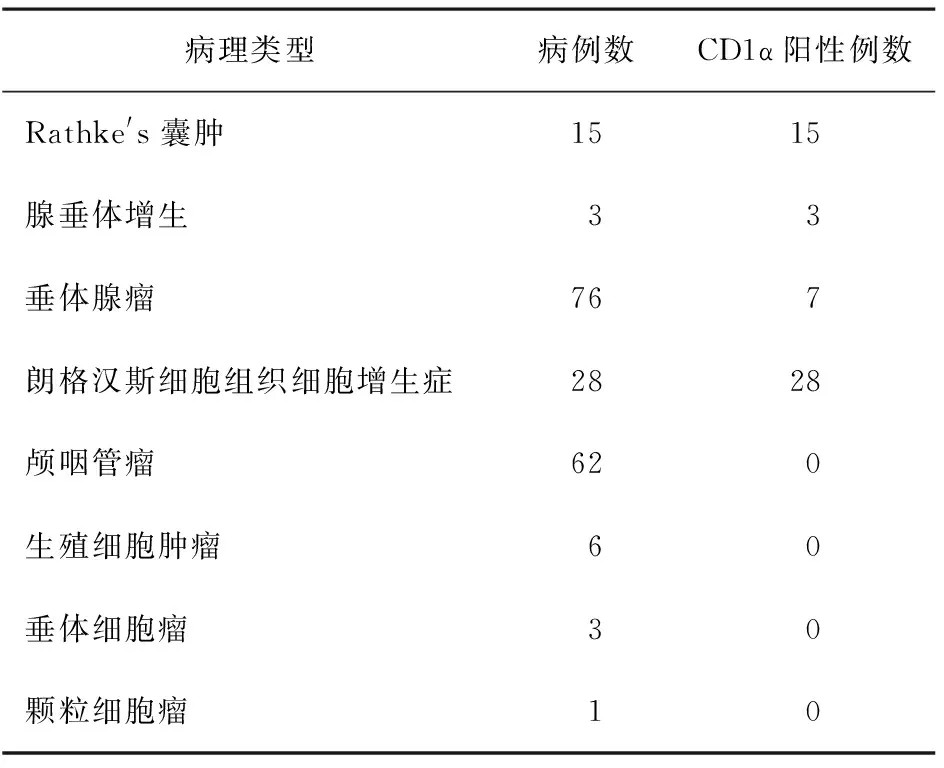
表1 CD1a在鞍区病变的表达情况
2.2 病理检查
2.2.1 组织学形态 Rathke′s 囊肿的囊肿壁被覆纤毛或柱状上皮,偶尔有杯状细胞和鳞状上皮化生。囊壁外均可见少量正常垂体组织(图1),常见多种炎细胞浸润。腺垂体增生为弥漫性或局灶性,病灶中除增生的细胞外常混杂多种其他激素细胞,间质小血管丰富,形态上很难与垂体腺瘤区别(图2)。所有的垂体腺瘤形态较一致,瘤细胞相似于正常垂体前叶细胞大小,呈弥漫性片状或呈梁索状、巢状、假腺样或乳头状排列,间质疏松,富含小血管(图3)。朗格汉斯细胞组织细胞增生症可见瘤细胞核呈折叠、分叶状或肾形,核仁不明显,常伴有较多的嗜酸性粒细胞及数量不等的淋巴细胞、巨噬细胞和浆细胞等浸润(图4)。颅咽管瘤可分为造釉细胞瘤型和乳头型两种,光镜下在疏松的纤维间质中可见上皮细胞岛和囊腔,常见胆固醇结晶和角化物形成(图5)。鞍区的生殖细胞肿瘤包括生殖细胞瘤、胚胎性癌、畸胎瘤、卵黄囊瘤和绒毛膜癌等,与发生于其他部位的肿瘤形态一致。垂体细胞瘤较罕见,由长梭形的双极细胞呈束状排列,或排列成旋涡状结构。颗粒细胞瘤细胞体积较大,胞浆丰富颗粒状,弱嗜酸性,细胞核圆形,小而深染,不见核分裂像。间质血管丰富。
2.2.2 免疫组织化学 CD1a在Rathke′s 囊肿壁的正常垂体组织(图6)和增生的腺垂体组织(图7)均呈弥漫阳性。在76例垂体腺瘤中CD1a仅表达于7例,均呈局灶性阳性表达(图8),且可见S100表达,呈散在或弥漫性阳性表达。7例CD1a阳性的垂体腺瘤分别是ACTH腺瘤2例、PRL 1例、FSH腺1例、GH腺瘤1例、多激素腺1例、无激素腺瘤1例。朗格汉斯细胞组织细胞增生症均表达CD1a和S100,呈弥漫阳性表达(图9)。但CD1a不表达于颅咽管瘤(图10)、生殖细胞肿瘤、垂体细胞瘤和颗粒细胞瘤。
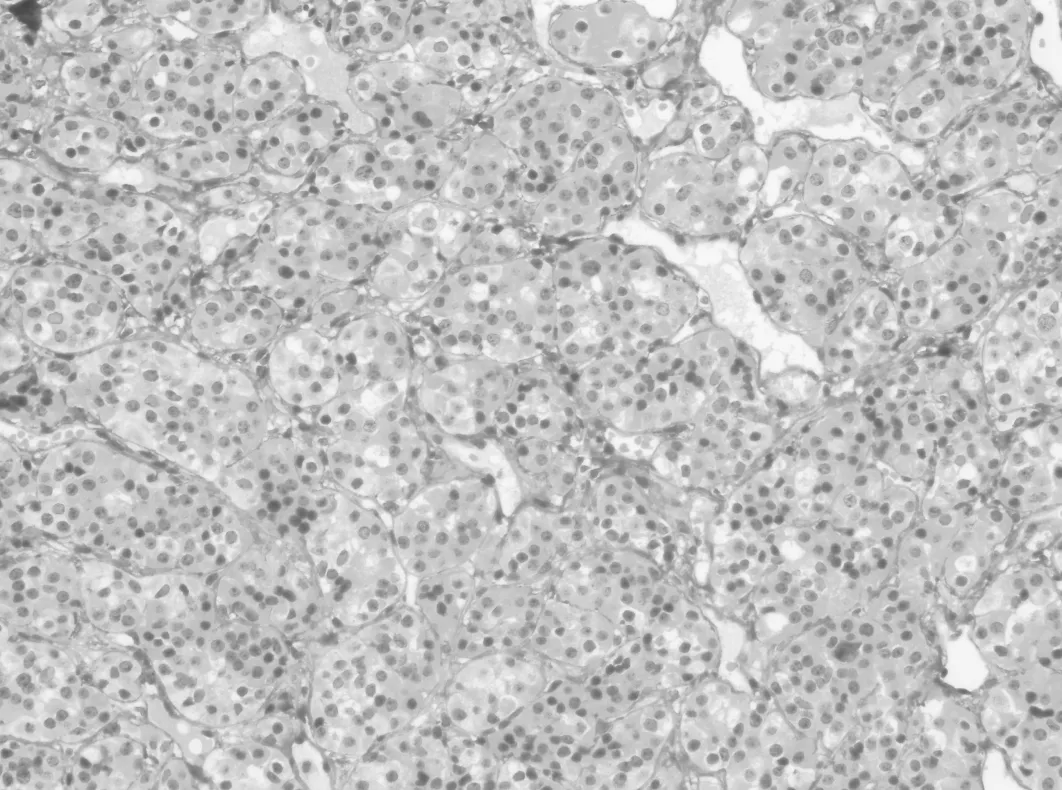
图1 正常垂体组织(HE×200)
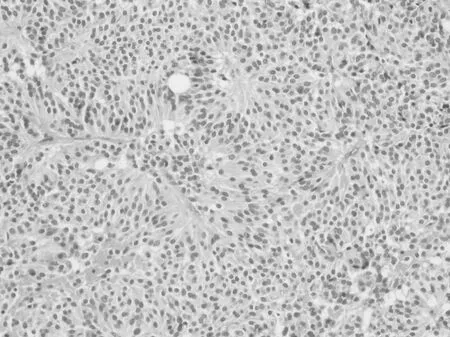
图3 垂体腺瘤(HE×200)

图4 朗格汉斯细胞组织细胞增生症(HE×200)
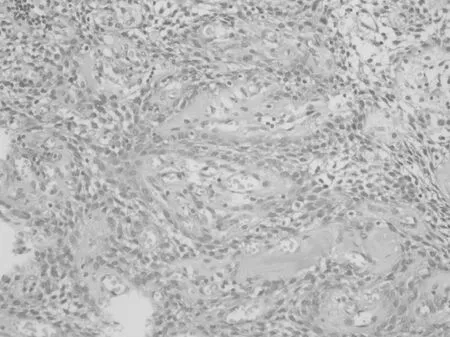
图5 颅咽管瘤(HE×200)
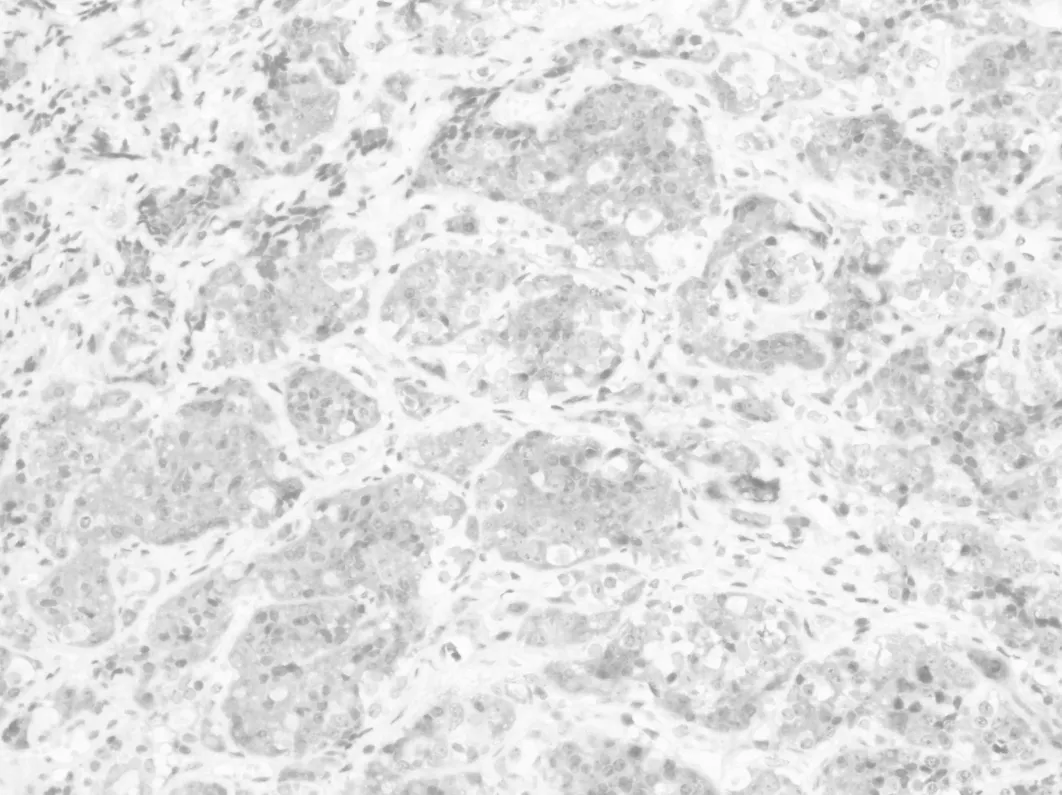
图6 正常垂体细胞弥漫性表达CD1a(EnVision×200)
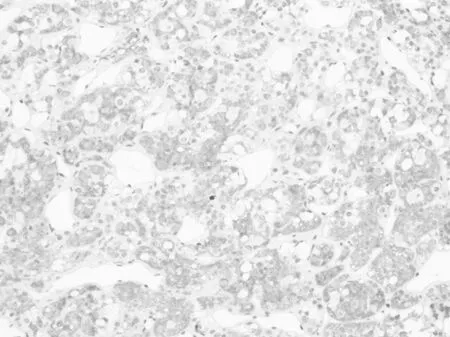
图7 腺垂体增生组织弥漫性表达CD1a(EnVision×200)
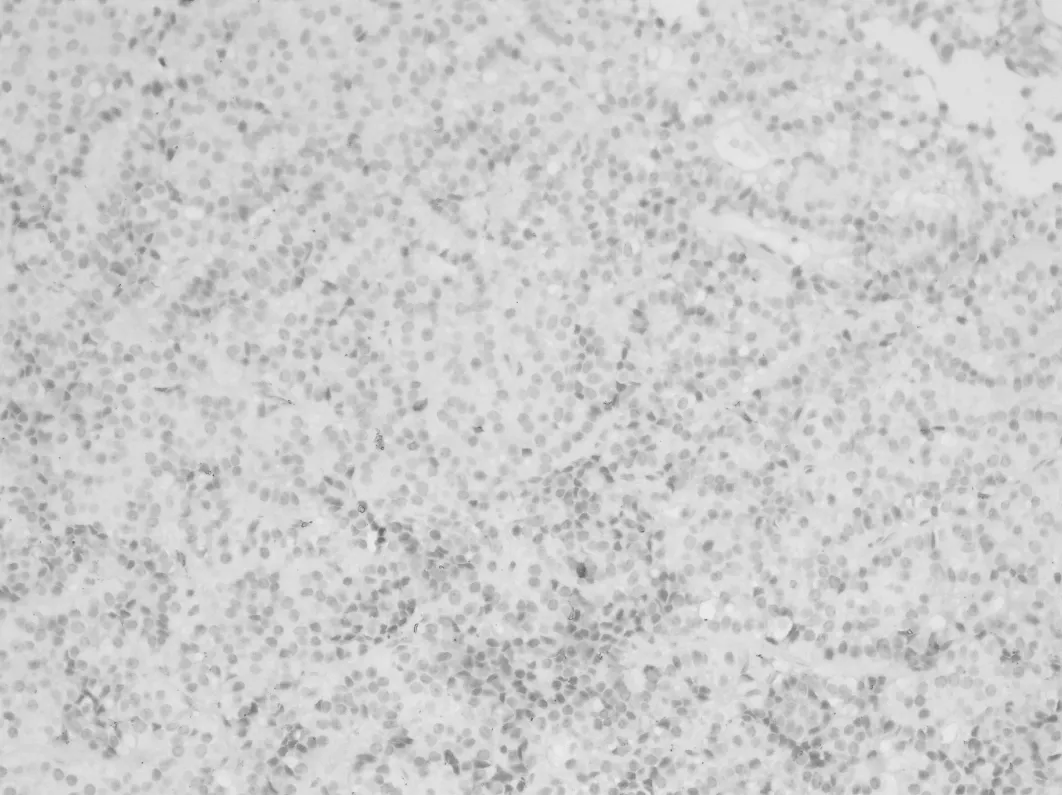
图8 垂体腺瘤灶性表达CD1a(EnVision×200)
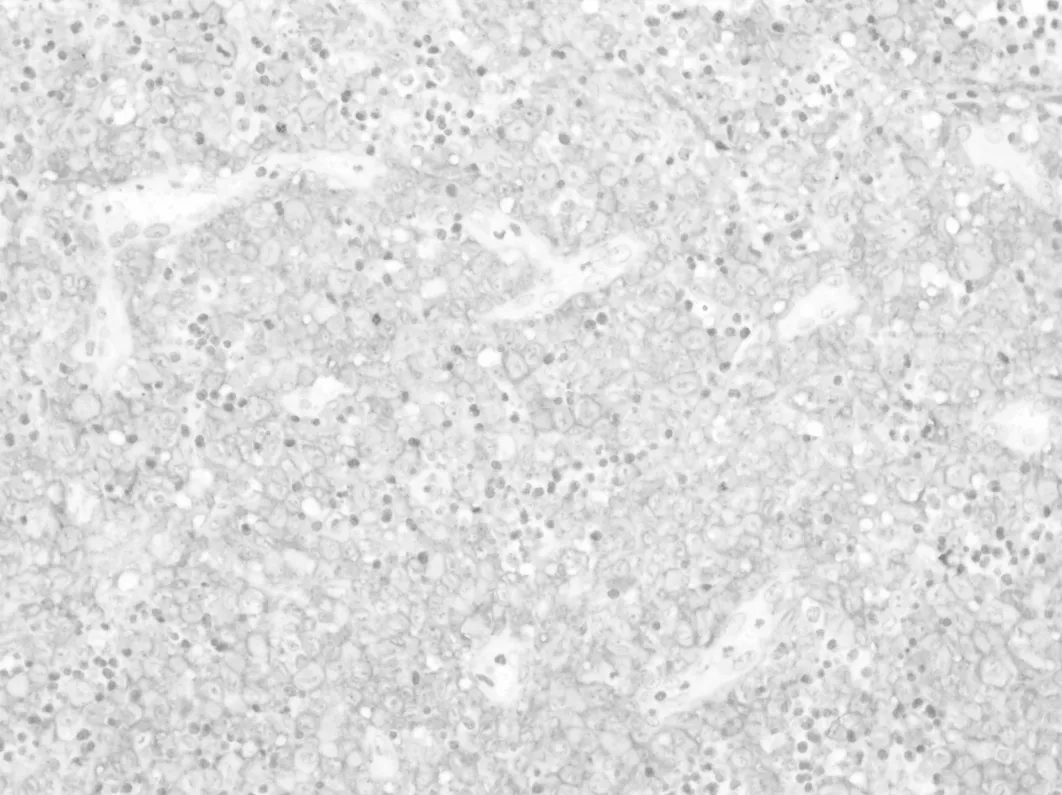
图9 朗格汉斯细胞组织细胞增生症弥漫性表达CD1a(EnVision×200)
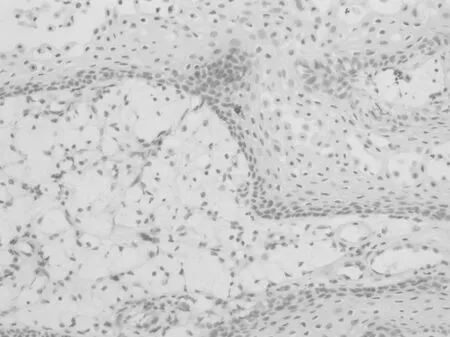
图10 颅咽管瘤不表达CD1a,散在阳性的朗格汉斯细胞(EnVision×200)
3 讨论
3.1 CD1a的表达谱系 CD1家族分子在结构上相似于主要组织相容性复合体Ⅰ(main histocompatibility complex Ⅰ,MHC Ⅰ),但两个分子家族介导不同的免疫功能。MHC Ⅰ将肽提呈给T细胞,而CD1分子提呈脂质给自然杀伤细胞和其它CD1限制性T细胞[2]。CD1a是一种表面糖蛋白,高表达于朗格汉斯细胞,后者是一种特殊的单核吞噬细胞,常见于皮肤和黏膜的上皮细胞内,作为一种抗原提呈细胞,诱导淋巴结引流区的幼稚T细胞发生分化,也可以调控皮肤区域的T细胞,从而保持皮肤屏障的完整性[3]。当朗格汉斯细胞发生肿瘤时,CD1a仍有较强的表达[4]。人真皮树突细胞也表达CD1a,但表达相对于朗格汉斯细胞较弱[5]。CD1a也可表达于胸腺皮质细胞[1],但在上皮细胞的表达较罕见,目前有报道CD1a可表达于Barrett食管的化生上皮,可用于鉴别异位的胃黏膜和食管鳞状上皮化生的腺上皮[6]。本实验发现CD1a在垂体细胞甚至垂体腺瘤也可表达,拓宽了CD1a的表达谱系。
3.2 CD1a在鞍区病变的表达及应用 垂体部位可发生多种肿瘤性病变和非肿瘤性病变[7]。肿瘤性病变常见的有垂体腺瘤、生殖细胞肿瘤、颅咽管瘤、颗粒细胞瘤、垂体细胞瘤和朗格汉斯细胞组织细胞增生症等。非肿瘤性病变包括各种垂体囊肿、腺垂体增生和垂体炎等。垂体炎可以是原发性或继发性的,临床和影像上均可呈肿块样,病理上可分为淋巴细胞性、肉芽肿型、黄色瘤型、坏死型、IgG4相关性垂体炎和继发性垂体炎等,此时要和朗格汉斯细胞组织细胞增生症做鉴别。特别是做为诊断朗格汉斯细胞组织细胞增生症较特异的抗体CD1a在正常垂体细胞和垂体炎时可表达,容易出现误诊。此时应该仔细观察,在朗格汉斯细胞组织细胞增生症中瘤细胞常见核呈分叶状和核沟,并常有较多量嗜酸性粒细胞的浸润,而垂体炎时CD1a阳性的垂体细胞核较圆,不见分叶核及核仁,此外浸润的嗜酸性粒细胞数量常较少。当两者鉴别较困难时,可以借助电镜观察,朗格汉斯细胞组织细胞增生症在电镜下可见有诊断意义的棒状Birbeck颗粒[8]。
腺垂体的各种促激素细胞均可发生增生,手术取出了正常垂体组织和增生的垂体组织在单凭形态很难与垂体腺瘤区别[9],另外手术切除组织或吸出组织常是破碎或局部的,不能很好的反映病变的全貌,更加增加了诊断的困难,而目前也没有很好的鉴别正常垂体组织、增生的垂体组织与垂体腺瘤的免疫标志物。我们的研究发现,CD1a在正常垂体组织和增生的垂体组织呈弥漫性强阳性,而在垂体腺瘤多不表达或呈灶性阳性,可以很好的区别垂体腺瘤和非腺瘤性病变。
综上所述,CD1a在正常垂体组织和增生的垂体组织均可弥漫阳性表达,病理诊断时不要误诊为朗格汉斯细胞组织细胞增生症。此外,垂体腺瘤不表达或灶性表达CD1a,利用CD1a免疫组织化学染色可以很好的与正常垂体组织和增生的垂体组织相区别。
[1] West JA,Olsen SL,Mitchell JM,et al.Polyclonal T-cells express CD1a in langerhans cell histiocytosis(LCH)lesions[J].PLoS One,2014,9(10):e109586.
[2] De Libero G,Mori L.Novel insights into lipid antigen presentation[J].Trends Immunol,2012,33(3):103-111.
[3] Seneschal J,Clark RA,Gehad A,et al.Human epidermal Langerhans cells maintain immune homeostasis in skin by activating skin resident regulatory T cells[J].Immunity,2012,36(5):873-884.
[4] Harmon CM,Brown N.Langerhans cell histiocytosis:a clinicopathologic review and molecular pathogenetic update[J].Arch Pathol Lab Med,2015,139(10):1211-1214.
[5] Klarquist J,Zhou Z,Shen N,et al.Dendritic cells in systemic lupus erythematosus:from pathogenic players to therapeutic tools[J].Mediators Inflamm,2016,2016:5045248.
[6] Pisapia DJ,Rosenblum MK,Lavi E.CD1a reactivity in non-neoplastic adenohypophysis[J].Am J Surg Pathol,2016,40(6):812-817.
[7] Glezer A,Bronstein MD.Pituitary autoimmune disease:nuances in clinical presentation[J].Endocrine,2012,42(1):74-79.
[8] Li X,Deng QI,Li YM.A case of Langerhans′ cell histiocytosis following Hodgkin′s disease[J].Mol Clin Oncol,2016,5(1):27-30.
[9] Yildirim AE,Divanlioglu D,Cetinalp NE,et al.Primary non-necrotizing granulomatous hypophysitis mimicking pituitary adenomas[J].Turk Neurosurg,2014,24(5):688-694.
Clinicopathological analysis of CD1a expression in the saddle region
HUANG Liangliang,WU Haibo,SUN Sibai
(DepartmentofPathology,AnhuiProvincialHospital,Hefei,Anhui230001,China)
Objective To investigate the expression of CD1a in the lesions of the saddle region and its significance in routine pathological diagnosis.Methods Retrospective analysis was conducted of the immunohistochemical staining of CD1a in 194 cases with saddle region tumors and non-neoplastic lesions.Results CD1a exhibited diffuse strong positivity in all 15 cases of native adenopypophyseal cells,3 cases of hyperplasia of the adenohypophysis,and 28 cases of Langerhans cell histiocytosis(LCH),but only 7 of 76 cases of pituitary adenomas partially stained for CD1a.CD1a was negative in 6 cases of germ cell tumors,62 cases of craniopharyngiomas,1 case of granular cell tumor and and 3 cases of pituicytoma.Conclusions CD1a can contribute to distinguishing native adenopypophyseal cells,hyperplasia of the adenohypophysis from pituitary adenomas.The former showed diffuse strong staining,while the latter did not exhibit immunohistochemical expression or only focal positivity.Because the native adenopypophyseal cells can react to CD1a,we should not misdiagnose hypophysitis as LCH.
CD1a;Pituitary adenoma;Langerhans cell histiocytosis;Pathology
10.3969/j.issn.1009-6469.2016.11.021
2016-08-25,
2016-10-08)

