不同乳腺癌细胞系中TLR5和NLRC4受体的表达和定位①
李 伟 卓召振 骆姝琳 任凌雁 陈 琨 刘水和 袁 军
(贵州省人民医院中心实验室,贵阳550002)
不同乳腺癌细胞系中TLR5和NLRC4受体的表达和定位①
李 伟 卓召振 骆姝琳 任凌雁 陈 琨 刘水和 袁 军
(贵州省人民医院中心实验室,贵阳550002)
目的:探究TLR5和NLRC4受体在不同乳腺癌细胞系MDA-MB-231、MCF-7和MDA-MB-435中的表达和定位情况,并探讨重组鞭毛素蛋白对乳腺癌细胞TLR5受体的激活情况。方法:利用Real-time PCR法检测MDA-MB-231、MCF-7和MDA-MB-435细胞TLR5和NLRC4 mRNA表达水平,用流式细胞仪检测MDA-MB-231、MCF-7细胞TLR5受体的表达和定位。纯化重组鞭毛素蛋白即全长鞭毛素蛋白FliC(同时激活TLR5和NLRC4两条通路)、FliCΔ90-97(不能激活TLR5通路)、FliC-L3A(不能激活NLRC4通路)、FliCΔ90-97:L3A(两条通路都不激活)。用1μg/ml重组鞭毛素蛋白刺激MCF-7细胞,12 h后,ELISA法检测IL-8的分泌。结果:MCF-7细胞TLR5 mRNA表达水平最高,约是MDA-MB-435细胞的1 700倍,MDA-MB-231细胞TLR5表达水平是MDA-MB-435的约200倍。TLR5在MCF-7细胞浆和胞膜上均有表达,而MDA-MB-231细胞只在胞浆中表达。激活TLR5通路的FliC和FliC-L3A能够刺激MCF-7细胞分泌IL-8,而不激活TLR5通路的FliCΔ90-97和FliCΔ90-97:L3A则不能。结论:不同乳腺癌细胞系都表达TLR5和NLRC4,但是表达部位和表达水平不同。MCF-7细胞TLR5和NLRC4表达高于其他乳腺癌细胞系。乳腺癌细胞系表面的TLR5受体可以被鞭毛素蛋白激活,为进一步探讨TLR5通路的激活在乳腺癌细胞增殖中的作用提供实验基础。
乳腺癌细胞系;TLR5;NLRC4
TLRs在癌症进展中起着重要作用[1,2]。研究发现乳腺癌、宫颈癌、肺癌、前列腺癌等肿瘤细胞均有TLR的表达。TLRs的激动剂有可能促进肿瘤细胞的增殖,但是也有研究发现,不同的TLRs配体刺激TLR3、TLR4、TLR5、TLR7和TLR9,表现出不同程度的抗肿瘤效果[3-6]。鞭毛素是细菌鞭毛的重要构成组件,也是一种重要的PAMPs。鞭毛素蛋白作为TLR5和NLRC4的天然配体,激活TLR5介导的信号通路,启动促炎基因的表达。先前的研究发现,TLR5激动剂-鞭毛素蛋白具有抑制肿瘤的功能[1,7-10],鞭毛素蛋白和表达鞭毛蛋白的细菌在小鼠模型中表现了抗肿瘤效果[11,12]。但乳腺癌细胞系中是否存在鞭毛素蛋白的另外一个受体——NLRC4,目前尚无研究报道。不同乳腺癌细胞系包括高转移的人乳腺癌细胞系MDA-MB-231和低转移能力的人乳腺癌细胞系MCF-7中NLRC4受体表达情况目前并不十分清楚,本研究将探讨不同乳腺癌细胞系MDA-MB-231、MCF-7和MDA-MB-435中TLR5和NLRC4受体的表达情况,为利用鞭毛素蛋白进行抗肿瘤免疫,以及探讨这两条通路在介导鞭毛素蛋白抑制乳腺癌细胞增殖中的作用提供实验基础。
1 材料与方法
1.1 实验试剂、仪器和细胞系 抗体TLR5-FITC(Abcam公司);同型抗体IgG2a-FITC、DMEM 培养基(Gibco公司);L-谷胺酰胺、氨苄青霉素和链霉素(北京索莱宝公司);胎牛血清(杭州四季青公司);0.25%胰蛋白酶(Hyclone);人IL-8细胞因子检测试剂盒(武汉博士德公司)。hTLR5F:TCCCTGAACTCACGAGTCTTT;hTLR5R:GGTTGTCAAGTCCGTAAAATGC。hNLRC-4F: GTGTTCTCCCACAAG-TTTG-A;hNLRC4R: AGTAACCATTCCCCTTGGTC;hGAPDH-F: GGAAGGTGAAGGTCGGAGTC;hGAP-DH-R:TCAGCCTTGACGGTGCCATG。所有引物均由上海生工合成。FACS AiriaTM流式细胞仪(BD公司)、BioRad iQ5 荧光定量PCR仪。MDA-MB-231、MCF-7和MDA-MB-435细胞购自武汉博士德公司,Caco-2细胞、表达菌株FliC、FliC-L3A、FliCΔ90-97和FliCΔ90-97:L3A由中国科学院武汉病毒所鄢慧民研究员惠赠。
1.2.1 细胞培养 MDA-MB-231、MCF-7和MDA-MB-435细胞培养于含10% 胎牛血清的DMEM完全培养基中,每隔3~5 d进行传代培养,待细胞进入对数生长期时,收获细胞备用。
1.2.2 重组鞭毛素蛋白的表达和纯化 方法见参考文献[13]。
1.2.3 Real-time PCR法检测乳腺癌细胞系TLR5和NLRC4 mRNA水平。首先,采用TRNzol总RNA提取试剂进行样本RNA提取,实验操作按产品说明书进行。然后,将总RNA逆转录成cDNA。最后,每个样品3个复孔,实时荧光PCR反应。反应条件为:(95℃30 s,95℃ 5 s)×40 个循环,60℃ 30 s,60~95℃进行溶解曲线分析。根据CT值,结果采用2-ΔΔCT法进行数据的相对定量分析。
1.2.4 流式细胞术检测乳腺癌细胞系胞膜和胞浆TLR5表达 胞膜TLR5的表达:用PBS洗涤不同乳腺癌细胞系,加入FcR受体阻断剂孵育20 min后,1 500 r/min×5 min,PBS洗涤一遍,分别加入抗体TLR5-FITC和同型对照抗体孵育30 min后,1 500 r/min×5 min洗涤,用PBS重悬,用流式细胞仪进行检测。用Flowjo软件对结果进行分析,检测不同乳腺癌细胞系TLR5的平均荧光强度,并用直方图表示。
细胞膜和胞浆TLR5表达:用PBS洗涤不同乳腺癌细胞系,加入FcR受体阻断剂孵育20 min后,PBS洗涤一遍,加入固定和破膜剂,孵育1 h后,2 000 r/min×5 min离心洗涤一次,分别加入抗体TLR5-FITC和同型对照抗体孵育30 min后,1 500 r/min×5 min洗涤后,用PBS重悬,用流式细胞仪进行检测。用Flowjo软件对结果进行分析,检测不同乳腺癌细胞系TLR5的平均荧光强度,并用直方图表示。
1.2.5 ELISA法检测重组鞭毛素蛋白刺激MCF-7细胞后IL-8的分泌 MCF-7细胞加入96孔板,50 000个/孔,加入鞭毛素蛋白1 μg/ml,刺激12 h后收集上清,ELISA法检测上清中IL-8浓度,方法见IL-8细胞因子检测试剂盒。
1.3 统计学方法 实验结果用GraphPad Prism 5.0软件进行统计处理。所得结果的比较采用One-way ANOVA和t检验共同分析。P<0.05表示差异有统计学意义。
2 结果
2.1 不同乳腺癌细胞系TLR5受体基因的表达 因为MDA-MB-435细胞表达TLR5和NLRC4水平很低,其他乳腺癌细胞TLR5 mRNA水平均与之相比,计算相对表达情况。结果显示,MDA-MB-231、MCF-7和MDA-MB-435细胞均表达TLR5受体,其中MCF-7细胞TLR5 mRNA表达水平显著高于MDA-MB-435和MDA-MB-231细胞系(P<0.001),约是MDA-MB-435细胞的1 700倍。MDA-MB-231细胞TLR5表达是MDA-MB-435的约200倍(图1)。
2.2 不同乳腺癌细胞系中NLRC4受体基因的表达 荧光定量PCR结果显示NLRC4受体在MCF-7和MDA-MB-231细胞均有相对高的表达,MCF-7细胞NLRC4的mRNA水平显著高于MDA-MB-435和MDA-MB-231(P<0.001),约是MDA-MB-435的11 000倍。MDA-MB-231细胞NLRC4的表达约是MDA-MB-435的2 000倍(图2)。
“当前,名庄酒市场的最大问题是要获得消费者的信赖。”中粮酒业副总经理中粮名庄荟总经理李士祎在讲话中表示,中国消费市场潜力巨大,在消费升级细分和中国进一步扩大开放进口的背景下,世界各地的名庄酒可以满足不同的消费需求,给中国消费者提供更多的选择空间。他建议市场各方携手合作打造利益的共同体,共同推动名庄酒市场的健康有序发展。
2.3 MCF-7细胞TLR5受体胞浆和胞膜的表达水平 流式细胞术分析结果显示,MCF-7细胞膜TLR5-FITC平均荧光强度为428,与同型对照相比显著升高(P<0.01)。当加破膜固定剂之后进行胞内TLR5-FITC染色,与胞膜TLR5染色相比,MFI显著升高(P<0.01)(图3),说明TLR5在MCF-7细胞膜和细胞浆均有表达。
2.4 MDA-MB-231细胞TLR5受体胞浆和胞膜的表达水平 MDA-MB-231细胞膜用TLR5-FITC染色后,平均荧光强度为189,与同型对照相(MFI为180)比没有显著变化(P>0.05)。当加透膜剂之后,MFI明显升高(为420)(图4),说明MDA-MB-231细胞TLR5受体主要表达在其胞内。
2.5 重组鞭毛素蛋白刺激MCF-7细胞IL-8的分泌 用1 μg/ml鞭毛素蛋白刺激MCF-7细胞,12 h后收集上清检测IL-8浓度。结果显示,不激活TLR5的FliCΔ90-97和FliCΔ90-97:L3A均不能刺激MCF-7细胞产生IL-8,而激活TLR5通路的重组鞭毛素蛋白FliC和FliC-L3A刺激MCF-7细胞后IL-8分泌量显著高于FliCΔ90-97和FliCΔ90-97:L3A(P<0.001)。见图5。

图1 不同乳腺癌细胞系中TLR5的表达Fig.1 Expression of TLR5 on different breast cancer cell lineNote: *.P<0.001.
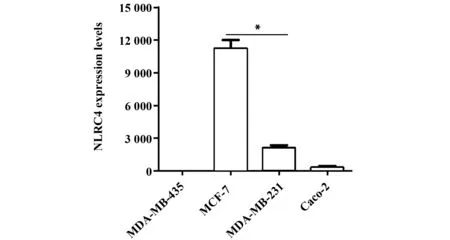
图2 不同乳腺癌细胞系中NLRC4的表达Fig.2 Expression of NLRC4 on different breast cancer cell lineNote: *.P<0.001.
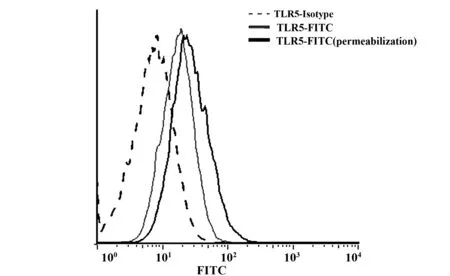
图3 MCF-7细胞TLR5受体胞浆和胞膜的表达水平Fig.3 Expression of TLR5 in cytoplasm and cytomember of MCF-7 breast cancer cell line

图4 MDA-MB-231细胞TLR5受体胞浆和胞膜的表达水平Fig.4 Expression of TLR5 in cytoplasm and cytomember of MDA-MB-231 breast cancer cell line
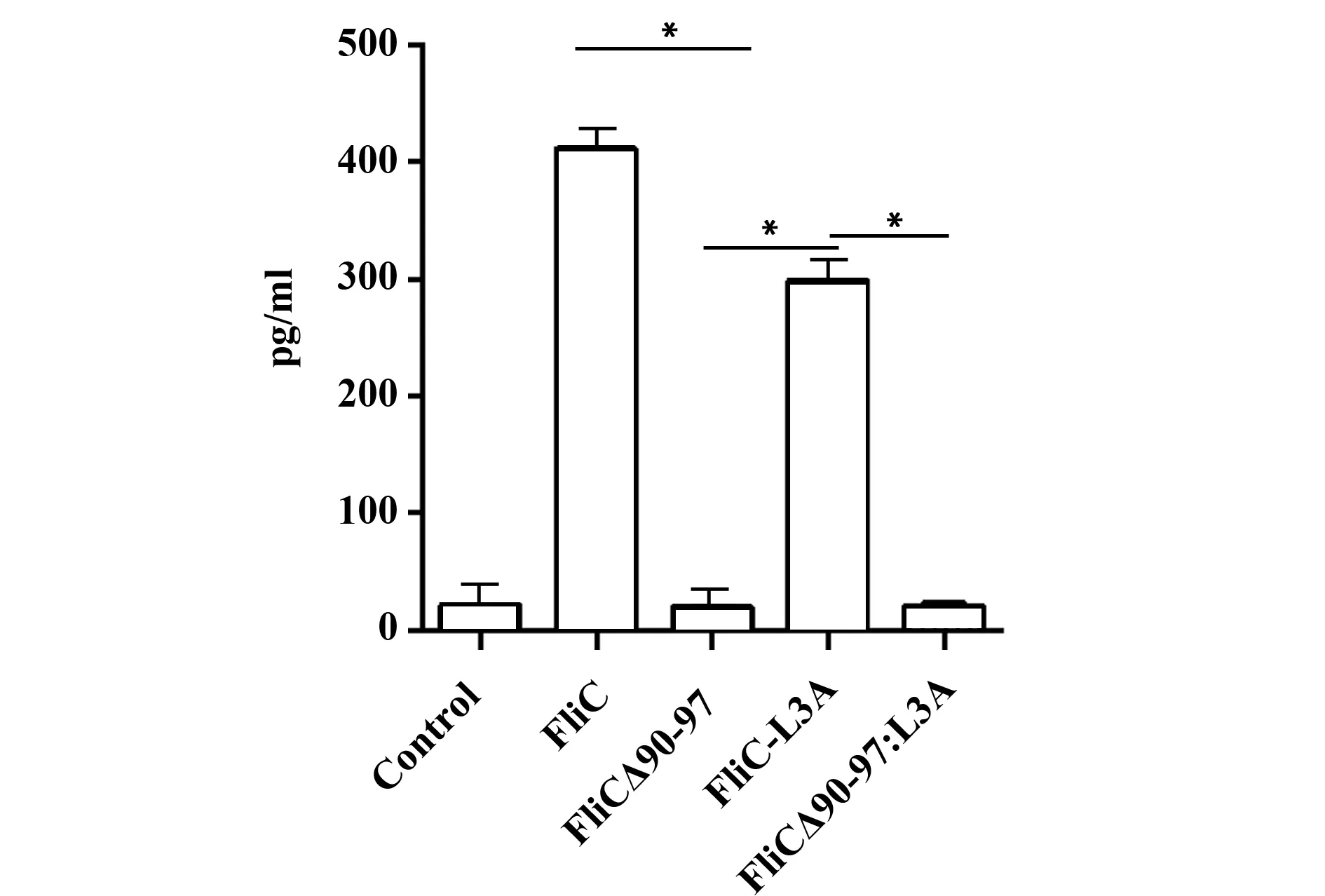
图5 重组鞭毛素蛋白刺激MCF-7细胞后IL-8的分泌Fig.5 Secretion of IL-8 in MCF-7 cell line after stimula-ted by recombinant flagellinNote: *.P<0.001.
3 讨论
免疫细胞通过不同的模式识别受体识别不同的病原相关分子模式,这些模式识别受体包括TLRs、RLRs和NLRs等。在抗肿瘤方面,免疫细胞模式识别受体的激活有利于增强抗肿瘤免疫,清除癌细胞。另一方面,分泌的细胞因子又对肿瘤免疫微环境起到了不同的调控作用,包括炎性细胞的浸润以及诱发多种肿瘤的发生。另外,肿瘤细胞也表达不同的模式识别受体,与肿瘤的发生发展密切相关,可以介导不同的配体激活相关信号通路,调节着肿瘤的增殖、侵袭和转移。
鞭毛素蛋白有可能通过除TLR5通路外的另外一条通路NLRC4来参与介导鞭毛素蛋白的抗肿瘤效应。当NLRC4炎症复合体激活后,能够加工炎症细胞因子IL-1β、IL-18、IL-33的前体,使它们成熟[14]。虽然,目前关于NLRC4通路与肿瘤关系的研究还较少,尚无明确的结论。但研究发现,在一些肿瘤类型中IL-1β和炎症小体上调,IL-1β和炎症小体在抗肿瘤免疫和诱导致瘤方面可能存在相反的效果。IL-1β通过刺激抗肿瘤免疫消除恶性细胞并增强化疗效果。Chen等[15]发现,肿瘤炎症小体来源的IL-1β可募集粒细胞,提高EB病毒引起的鼻咽癌无局部复发存活率。因此,NLRC4通路的激活可能与肿瘤的进展、预后有关。
本研究发现,不同乳腺癌细胞系都表达TLR5和NLRC4受体,但是表达部位和表达水平存在差异。MCF-7细胞TLR5mRNA表达最多,表达水平约是MDA-MB-435细胞的1 700倍,MDA-MB-231细胞TLR5表达是MDA-MB-435的约200倍。TLR5受体在MCF-7细胞浆和胞膜上均有表达,而MDA-MB-231细胞只在胞浆中表达[7]。提示鞭毛素蛋白不直接抑制MDA-MB-231细胞,可能需要加入转染试剂使其进胞膜后才能够激活TLR5通路而发挥作用。MCF-7细胞浆和胞膜除了表达TLR5受体,也表达高水平的NLRC4,说明鞭毛素蛋白有可能通过激活NLRC4而发挥抑制效果。有文献报道,TLR5在介导鞭毛素抑制MCF-7细胞增殖的作用,并没有考虑NLRC4通路。因此,本研究提示,需要综合考虑两条通路所介导的鞭毛素蛋白抗肿瘤效果。本研究利用分别激活TLR5和NLRC4的重组鞭毛素蛋白刺激MCF-7细胞,发现只有激活TLR5通路的MCF-7细胞能够分泌IL-8,这说明IL-8的分泌依赖于TLR5通路的激活。表达在乳腺癌细胞系表面的TLR5受体可以被鞭毛素蛋白激活,也进一步证明了TLR5受体位于MCF-7细胞膜上,为我们深入探讨TLR5通路的激活在乳腺癌细胞增殖中的作用提供实验基础。文献报道,IL-8能够抑制MCF-7细胞的凋亡[16]。而且乳腺癌患者IL-8的上调与较差预后相关[17,18]。提示在探讨鞭毛素的抗肿瘤效果时,必须考虑其对乳腺癌细胞直接刺激后细胞因子分泌可能影响其抗肿瘤的效果。另一方面,鞭毛素蛋白通过TLR5通路刺激免疫细胞的激活,可能促进机体的抗肿瘤效应。
本研究提示,大部分乳腺癌细胞系表达TLR5和NLRC4受体,TLR5受体分布于乳腺癌细胞系的胞膜或者胞浆,位于胞膜的TLR5受体可以被鞭毛素蛋白激活而分泌炎症因子IL-8。这两种受体的激活在介导鞭毛素蛋白的抗肿瘤方面具有哪些作用,是促进乳腺癌增殖,还是抑制乳腺癌细胞增殖,促进其凋亡,需要进一步实验探讨。本研究为进一步探讨乳腺癌细胞中TLR5和NLRC4通路的激活在肿瘤增殖中的作用提供实验依据。
[1] Rakoff-Nahoum S,Medzhitov R.Toll-like receptors and cancer[J].Nat Rev Cancer,2009,9(1):57-63.
[2] Shcheblyakov DV,Logunov DY,Tukhvatulin AI,etal.Toll-like receptors (TLRs):the role in tumor progression[J].Acta Naturae,2010,2(3):21-29.
[3] Lonsdorf AS,Kuekrek H,Stern BV,etal.Intratumor CpG-oligodeoxynucleotide injection induces protective antitumor T cell immunity [J].J Immunol,2003,171(8):3941-3946.
[4] Chicoine MR,Zahner M,Won EK,etal.The in vivo antitumoral effects of lipopolysaccharide against glioblastoma multiforme are mediated in part by Toll-like receptor 4[J].Neurosurgery,2007,60(2):372-380.
[5] Scheel B,Aulwurm S,Probst J,etal.Therapeutic anti-tumor immunity triggered by injections of immunostimulating single-stranded RNA[J].Eur J Immunol,2006,36(10):2807-2816.
[6] Craft N,Bruhn KW,Nguyen BD,etal.The TLR7 agonist imiquimod enhances the anti-melanoma effects of a recombinant Listeria monocytogenes vaccine[J].J Immunol,2005,175(3):1983-1990.
[7] Cai Z,Sanchez A,Shi Z,etal.Activation of Toll-like receptor 5 on breast cancer cells by flagellin suppresses cell proliferation and tumor growth[J].Cancer Res,2011,71(7):2466-2475.
[8] Leigh ND,Bian G,Ding X,etal.A flagellin-derived toll-like receptor 5 agonist stimulates cytotoxic lymphocyte-mediated tumor immunity[J].PLoS One,2014,9(1):e85587.
[9] Rhee SH,Im E,Pothoulakis C.Toll-like receptor 5 engagement modulates tumor development and growth in a mouse xenograft model of human colon cancer[J].Gastroenterology,2008,135(2):518-528.
[10] Sfondrini L,Rossini A,Besusso D,etal.Antitumor activity of the TLR-5 ligand flagellin in mouse models of cancer[J].J Immunol,2006,176(11):6624-6630.
[11] Yam C,Zhao M,Hayashi K,etal.Monotherapy with a tumor-targeting mutant of S.typhimurium inhibits liver metastasis in a mouse model of pancreatic cancer[J].J Surg Res,2010,164(2):248-255.
[12] Zhao M,Geller J,Ma H,etal.Monotherapy with a tumor-targeting mutant of Salmonella typhimurium cures orthotopic metastatic mouse models of human prostate cancer[J].Proc Natl Acad Sci USA,2007,104(24):10170-10174.
[13] Li W,Yang J,Zhang E,etal.Activation of NLRC4 downregulates TLR5-mediated antibody immune responses against flagellin[J].Cell Mol Immunol,2015,doi:10.1038/cmi.2015.033.
[14] Martinon F,Mayor A,Tschopp J.The inflammasomes:guardians of the body[J].Annu Rev Immunol,2009,27:229-265.
[15] Chen LC,Wang LJ,Tsang NM,etal.Tumour inflammasome-derived IL-1beta recruits neutrophils and improves local recurrence-free survival in EBV-induced nasopharyngeal carcinoma[J].EMBO Mol Med,2012,4(12):1276-1293.
[16] Pang X,Li K,Wei L,etal.IL-8 inhibits the apoptosis of MCF-7 human breast cancer cells by up-regulating Bcl-2 and down-regulating caspase-3[J].Xi Bao Yu Fen Zi Mian Yi Xue Za Zhi,2015,31(3):307-311.
[17] Singh JK,Simoes BM,Clarke RB,etal.Targeting IL-8 signalling to inhibit breast cancer stem cell activity[J].Expert Opin Ther Targets,2013,17(11):1235-1241.
[18] Freund A,Chauveau C,Brouillet JP,etal.IL-8 expression and its possible relationship with estrogen-receptor-negative status of breast cancer cells[J].Oncogene,2003,22(2):256-265.
[收稿2016-04-12 修回2016-06-01]
(编辑 张晓舟)
Expression and location of TLR5 and NLRC4 in different breast cancer cell lines
LI Wei,ZHUO Zhao-Zhen,LUO Shu-Lin,REN Ling-Yan,CHEN Kun,LIU Shui-He,YUAN Jun.
Central Laboratory of Guizhou Provincial People′s Hospital,Guiyang 550002,China
Objective:To explore the expression and location of TLR5 and NLRC4 on different breast cancer cell lines MDA-MB-231,MCF-7 and MDA-MB-435 and TLR5 activation in breast cancer cell line by recombinant flagellin .Methods:The mRNA level of TLR5 and NLRC4 in MDA-MB-231,MCF-7 and MDA-MB-435 cell were detected with quantitative Real-time PCR and TLR5 expression and location in MDA-MB-231 and MCF-7 cell were detected with Flow cytometry.Induction,expression,purification and identification of recombiant flagellin,including FliC (activating both TLR5 and NLRC4),FliCΔ90-97(unable to activate TLR5),FliC-L3A (unable to activate NLRC4),FliCΔ90-97:L3A (unable to activate both TLR5 and NLRC4).1 μg/ml recombinant flagellin were used to stimulate MCF-7 cell lines,12 h later,the supernate were collected,and ELISA was performed to assess the secretion of IL-8.Results:The mRNA level of TLR5 in MCF-7 cell was 1 700 folds higher than that of MDA-MB-435.TLR5 was expressed in MCF-7 cell surface and ctyosol,while expressed only in cytosol in MDA-MB-231 cell.FliC and FliC-L3A,which were able to activate TLR5 pathway,stimualted MCF-7 cell line to secret IL-8,but FliCΔ90-97 and FliCΔ90-97:L3A did not.Conclusion:TLR5 and NLRC4 have been expressed in different breast cancer lines,but there exists difference on the expression level and location of TLR5.Expression level of TLR5 and NLRC4 in MCF-7 cell were higher than other breast cancer lines.TLR5 receptor which is expressed on the surface of breast cancer cell can be activated by flagellin,and these work also provide us experimental basis to further understand the impact of TLR5 activation on breast cancer cell proliferation.
Breast cancer cell line;TLR5;NLRC4
10.3969/j.issn.1000-484X.2016.12.007
①本文受贵州省卫计委科学技术基金(gzwjkj2015-1-020)和贵州省人民医院博士基金(GZSYBS[2015]11号)资助。
李 伟(1983年-),男,博士,主要从事肿瘤免疫方面的研究,E-mail:lwcy2010@yeah.net。
及指导教师:袁 军(1970年-),女,博士,教授,主要从事移植免疫及肿瘤免疫方面的研究,E-mail:junyuan99430@163.com。
R730
A
1000-484X(2016)12-1761-05

