AEG-1基因在NSCLC中的表达及其临床病理意义
高建华 曹 华 李 萱 虞春华 宋晓东
(江西医学高等专科学校,上饶334000)
AEG-1基因在NSCLC中的表达及其临床病理意义
高建华 曹 华 李 萱 虞春华 宋晓东
(江西医学高等专科学校,上饶334000)
目的:探讨非小细胞肺癌(NSCLC)组织中星型胶质细胞上调基因1(AEG-1)的表达及其临床意义。方法:选取本院心胸外科手术切除治疗的83例NSCLC患者的术后癌组织标本及20例癌旁组织标本进行研究,采用免疫组化染色法检测两组AEG-1蛋白的表达水平,并分析AEG-1蛋白与NSCLC患者的临床病理学关系。结果:AEG-1 NSCLC组织中的AEG-1 蛋白高表达46例(55.42%)显著高于癌旁组织的2例(10.00%)(P<0.05);NSCLC组织中的AEG-1 蛋白高表达与患者的T分期、N分期及发生远处转移具有显著的相关性(P<0.05),与患者年龄、性别、分化程度关系不显著(P>0.05)。 AEG-1高表达NSCLC患者的中位生存时间15.0个月显著低于AEG-1低表达患者的19.0个月(log-rankχ2=4.119,P<0.05)。结论:NSCLC组织中AEG-1基因表达上调,并且与患者的临床分期及远处转移有关。
非小细胞肺癌;星型胶质细胞上调基因1;基因表达;免疫组化
非小细胞肺癌(Non-small-cell lung cancer,NSCLC)发病率约占整体肺癌的80%[1],已成为最主要的肺癌病理分型,且约60%的NSCLC患者被确诊时,已处于Ⅲ或Ⅳ期[2],故其患者预后差、死亡率高。临床中,治疗NSCLC的方式以手术联合放化疗及分子靶向疗法为主,但患者五年生存率仍≤20%[3],因此,寻找更高效的新型NSCLC治疗方式仍十分必要。目前,研究者致力于探查NSCLC发病的分子机制,并发现新的分子靶点,从而为治疗NSCLC创造新方向。文献称,星形胶质细胞上调基因1(AEG-1)显著高表达于多类组织及脏器肿瘤内[4],其表达水平和肿瘤生长、侵润和转移具有相关性,但关于AEG-1在NSCLC发展过程中的具体作用,仍未探查清楚。本文通过检测NSCLC肿瘤组织内AEG-1表达水平,旨在探讨其在NSCLC发病过程中的作用及其表达水平对NSCLC治疗的指导作用,现将研究结果总结如下。
1 对象与方法
1.1 研究对象 选取本院心胸外科手术切除治疗的83例NSCLC患者的术后癌组织标本及20例癌旁组标本进行研究。NSCLC患者83例,男54例、女29例,年龄41~78岁,平均(64.9±10.3)岁,分化程度:高分化21例、中分化23例、低分化39例,远处转移29例,吸烟36例,病理类型:鳞癌37例、腺癌43例、其他类型3例。癌旁组织20例,男13例、女7例,年龄43~72岁,平均(62.8±9.7)岁,吸烟9例。两组患者的年龄、性别及吸烟率差异无统计学意义(P>0.05)。纳入标准:(1)NSCLC标本来源于本院心胸外科手术后标本并经过病理学证实;(2)NSCLC患者术前未接受放疗或者化疗[5];(3)患者的各项临床资料完整。排除标准:(1)术前接受放化疗治疗的患者;(2)资料不完整的患者。
1.2 方法
1.2.1 免疫组化染色法 取肺癌组织及癌旁组织切片甲醛固定、脱水、石蜡包埋及连续切片,片厚4 μm,切片65℃下烤2 h ,脱蜡后蒸馏水洗 2次。置于3%H2O2室温下孵育20 min,蒸馏水洗5 min,PBS 内泡5 min。将切片浸于枸橼酸盐缓冲液内,不锈钢压力锅修复抗原2~3 min ,PBS洗3次,5 min/次。滴入1∶400稀疏AEG-1兔抗人多克隆抗体(上海信裕生物科技有限公司)一抗,4℃下孵育过夜;次日PBS洗3次,5 min/次;滴HRP标记二抗50 μl,室温孵育1 h;PBS洗3次,5 min /次,DAB显色,DAB显色试剂盒购自北京索莱宝科技有限公司,待5 min后蒸馏水洗涤中止显色,苏木素复染、1%酒精盐酸分化,自来水洗涤返蓝,蒸馏水再洗涤,分别行脱水、透明后封片,置于显微镜观察切片染色情况。
1.2.2 免疫组化结果判断 免疫组化结果判定AEG-1蛋白的阳性着色表达于细胞质,呈黄色、棕黄色、褐色颗粒表达。(1)根据着色强度:0分为无色、1分为淡黄色、2分为棕黄色、3分为褐色、黑色;(2)根据阳性细胞比例:阳性细胞数目所占比例<10%为1分、阳性细胞所占比例11%~50%为2分、阳性细胞数51%~75%为3分、阳性细胞数所占比例>75%为4分,两种积分相乘总分<3分为阴性、≥3分为阳性。(-)为总分<3分,阴性表达;(+)为3~5分,弱阳性表达;(++)为6~9分,中阳性表达;(+++)为>9分,强阳性表达。(++)及(+++)为高表达,(-)及(+)为低表达。

2 结果
2.1 AEG-1基因在NSCLC组织中的表达情况 AEG-1 NSCLC组织中的AEG-1 蛋白高表达46例(55.42%)显著高于癌旁组织的2例(10.00%)(P<0.05),见表1。免疫组化染色可见NSCLC组织中棕黄色着色强度显著高于癌旁组织,细胞质中大量黄色、棕黄色颗粒(图1)。
2.2 AEG-1蛋白在NSCLC组织中的表达与患者临床病理特征的关系 NSCLC组织中的AEG-1 蛋白高表达与患者的T分期、N分期及发送远处转移具有显著的相关性(P<0.05),与患者年龄、性别、分化程度关系不显著(P>0.05),见表2。
2.3 AEG-1蛋白表达与NSCLC患者预后的关系 AEG-1高表达NSCLC患者的中位生存时间15.0个月显著低于AEG-1低表达患者的19.0个月(log-rankχ2=4.119,P<0.05),见图2。
表1 AEG-1蛋白在NSCLC组织中的表达情况
Tab.1 In NSCLC protein expression of AEG-1
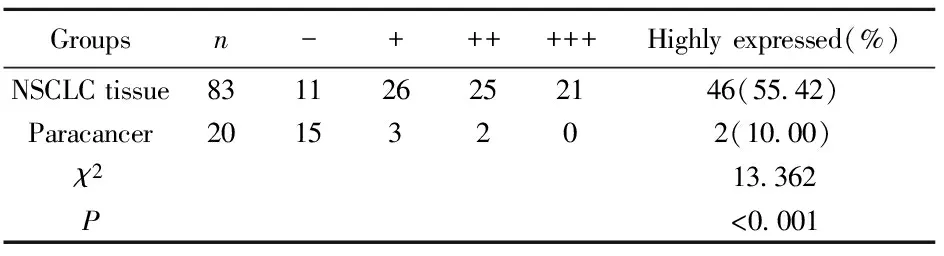
Groupsn-++++++Highlyexpressed(%)NSCLCtissue831126252146(5542)Paracancer20153202(1000)χ213362P<0001

图1 免疫组化染色结果(SP×400)Fig.1 Immunohistochemical staining(SP×400)Note:A.NSCLC tissue;B.Adjacent tissues.
表2 AEG-1蛋白在NSCLC组织中的表达与患者临床病理特征的关系[n(%)]
Tab.2 Relationship between AEG-1 protein expression in NSCLC tissues and clinical pathological characteristics[n(%)]
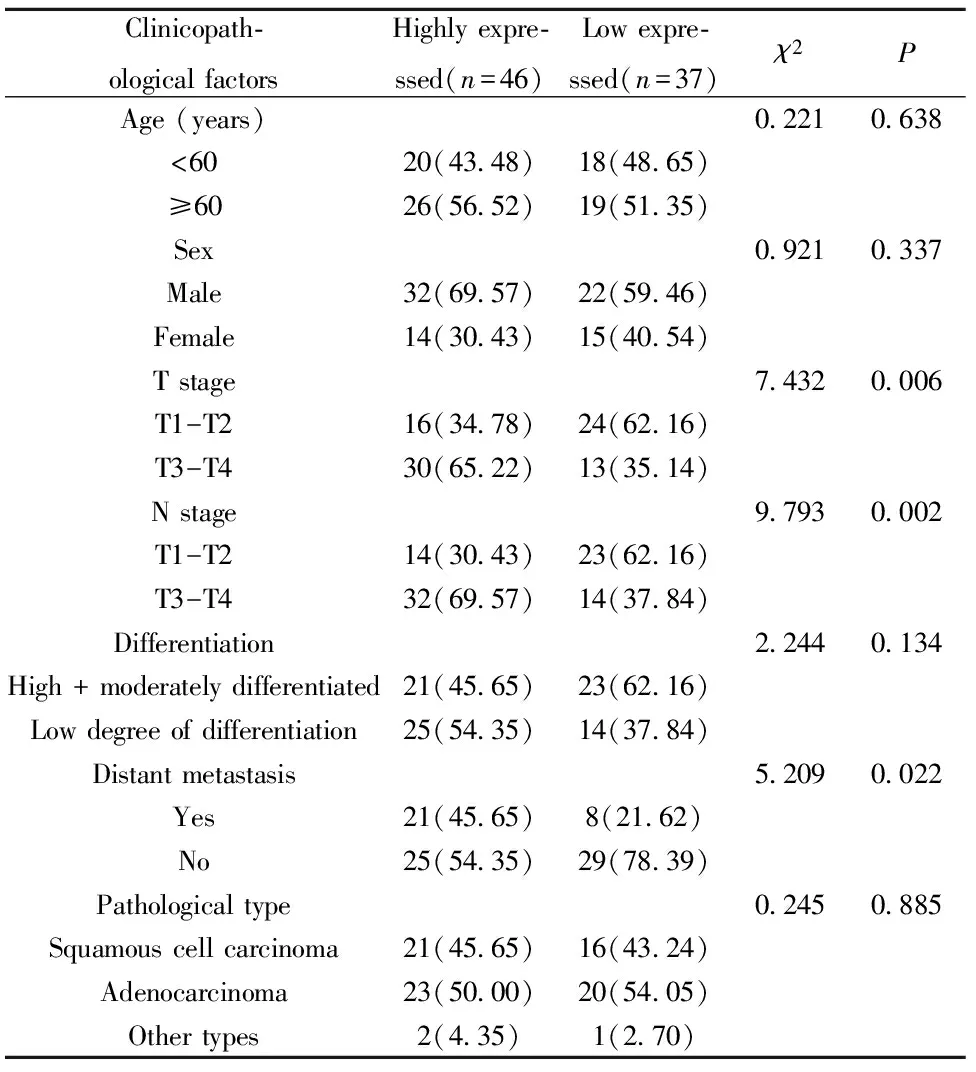
Clinicopath⁃ologicalfactorsHighlyexpre⁃ssed(n=46)Lowexpre⁃ssed(n=37)χ2PAge(years)02210638<6020(4348)18(4865)≥6026(5652)19(5135)Sex09210337Male32(6957)22(5946)Female14(3043)15(4054)Tstage74320006T1-T216(3478)24(6216)T3-T430(6522)13(3514)Nstage97930002T1-T214(3043)23(6216)T3-T432(6957)14(3784)Differentiation22440134High+moderatelydifferentiated21(4565)23(6216)Lowdegreeofdifferentiation25(5435)14(3784)Distantmetastasis52090022Yes21(4565)8(2162)No25(5435)29(7839)Pathologicaltype02450885Squamouscellcarcinoma21(4565)16(4324)Adenocarcinoma23(5000)20(5405)Othertypes2(435)1(270)
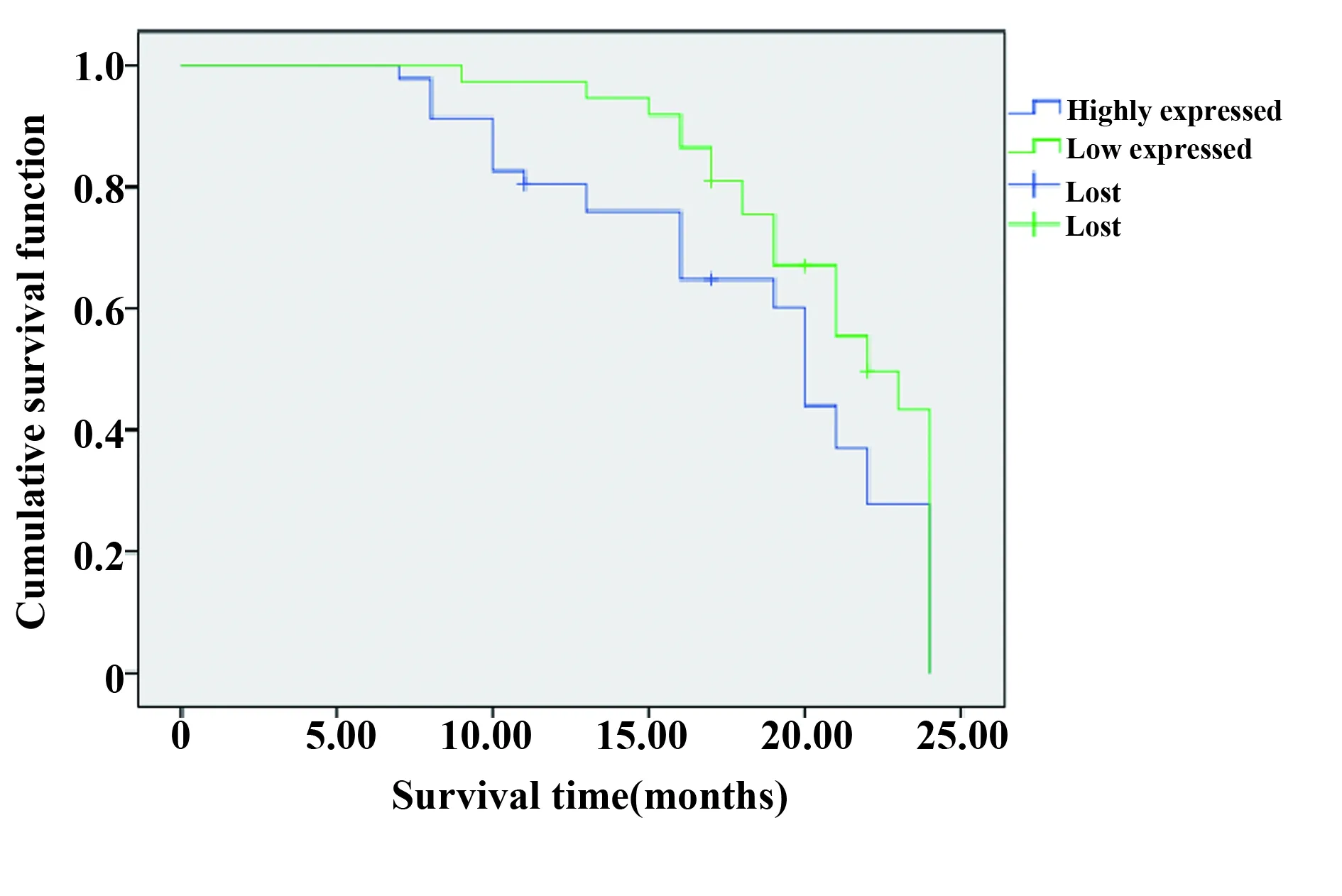
图2 生存函数图Fig.2 Survival function
3 讨论
NSCLC具有肿瘤恶性程度高、进展速度快和易向远处组织器官转移、侵润等特点,因此,其治疗难度较高,患者预后差、病死率高。NSCLC发病分子机制较复杂,但初步研究显示,人体多种变异基因参与其发病过程,并造成肿瘤细胞无限制增殖及细胞凋亡异常,从而促使肿瘤发展、恶化[6],因此,研究者认为通过探查NSCLC产生及发展的分子机制,以寻找关键靶向基因有效治疗该恶性肿瘤。
AEG-1是广泛表达于人体内的肿瘤促进基因之一,其最早在HIV-1感染者血细胞内被发现,随着研究深入,其也被测定高表达于肿瘤坏死因子α(TNF-α)诱导的胚胎星形细胞内。AEG-1 基因是一个遗传上高度保守的癌基因,位于人类染色体 8q22,全长包含3 611 bp,由12 个外显子和 11 个内含子组成。人AEG-1的启动子(-2710~+49)缺少启动子共同的 TATA 或 CAAT 盒,但有多个Spl 基序和高含量的GC。AEG-1 启动子有正调控区(459~302)和负调控区(-738~-460)。正调控区 356~302内有结合激活Ha-ras 转录因子的位点。该基因均高表达于乳腺癌、恶性胶质瘤及黑色素瘤等肿瘤细胞内[7],并可和原癌基因H-ras结合,刺激非致癌永生化黑色素细胞向恶性肿瘤细胞转变。有文献称,AEG-1还可和其上游基因Ha-Ras相互作用,并在其调控下进行RNA转录和复制,共同促进肿瘤生成及生长[8]。AEG-1基因常高表达于乳腺、肝脏、胃、食管等脏器癌症及神经恶性肿瘤、胶质恶性肿瘤内,并明显增强肿瘤细胞侵袭及转移性,而人工干预方式刺激其表达降低后,可显著抑制癌细胞侵袭性。基于以上文献,笔者认为AEG-1基因可能和NSCLC等肺癌肿瘤的产生、发展及转移、侵袭具有相关性。
在本研究中,实验结果显示NSCLC组织中的AEG-1蛋白高表达水平显著高于癌旁组织(P<0.05),这表明AEG-1在NSCLC肿瘤内表达亦处于显著高表达水平,可能在一定程度上影响其肿瘤细胞发展及侵袭。为进一步掌握AEG-1病理性特点,笔者选择对NSCLC肿瘤组织及癌旁组织进行免疫化染色,结果显示肿瘤组织内棕黄色着色强度显著高于癌旁组织,而AEG-1免疫染色结果呈现黄色、棕黄色大颗粒,这进一步证明了AEG-1在NSCLC 组织具有明显高表达特异性,因此笔者推断该基因可作为判断NSCLC发病的特异性分子标志指标。
在临床中,选择合适的检测指标评估NSCLC肿瘤不同分化程度和临床分期,对制订针对性治疗方案具有十分重要的指导意义,AEG-1表达水平会随临床分期及肿瘤分化程度发展而逐渐升高。笔者在本实验中,通过对NSCLC病情进展程度和AEG-1表达进行相关性分析可得,NSCLC组织中的AEG-1蛋白高表达与癌症T分期、N分期及发送远处转移具有显著的相关性(P<0.05),这与他人研究相一致[9],证明AEG-1高表达不仅可以促进NSCLC产生,而其表达水平持续增高也可显著刺激癌症发展。本研究发现AEG-1表达水平和患者年龄、性别、肿瘤分化和转移无关。这与前人报道的AEG-1与肿瘤转移相关不尽相同[10],这可能与肺癌组织样本量偏小有关,另一个可能原因是转移性肺癌多不选择手术治疗,导致研究对象中转移性肺癌例数较少,未能发现统计学意义。
在本研究也发现部分NSCLC患者的AEG-1蛋白表达和肿瘤分化和转移无相关性,这可能因为其NSCLC的发展受到多种基因分子影响,单AEG-1不能完全决定该类癌症恶化、侵袭及转移走向。但总体而言,高表达AEG-1在NSCLC产生过程中可能起着重要的促进作用,其参与肿瘤产生及发展,且表达水平可以评估肿瘤T分期、N分期及远处转移情况,因此,AEG-1能够作为预防和治疗NSCLC新的分子靶向标识之一,从而为研发基于该基因新型靶向药物创造理论依据。
综上所述, AEG-1基因表达在NSCLC组织显著上调,其表达水平可影响甚至决定患者临床分期及远处转移,但本文未针对AEG-1进行关于NSCLC治疗的研究,因此,AEG-1与NSCLC治疗及预后的相关性仍需进一步研究以完善。
[1] 黄梅香,梁艺华,任宁毅,等.胃泌素释放肽前体在小细胞肺癌诊断及治疗中应用[J].现代仪器与医疗,2015,21(3):82-84.
[2] Nikpour Mahnaz,Nikpour Modjtaba,Emadi Ute,etal.MTDH/AEG-1 contributes to central features of the neoplastic phenotype in bladder cancer[J].Urologic Oncol,2014,32(5):670-677.
[3] 甘梅富,徐 铖,张玲娜,等.星形胶质细胞上调基因-1和程序性细胞死亡因子4表达与结直肠癌临床病理学的关系[J].中华实验外科杂志,2015,32(10):2566-2568.
[4] Zheng J,Li C,Wu X,etal.Astrocyte elevated gene-1 (AEG-1) shRNA sensitizes Huaier polysaccharide (HP)-induced anti-metastatic potency via inactivating downstream P13K/Akt pathway as well as augmenting cell-mediated immune response[J].Tumour Biol,2014,35(5):4219-4224.
[5] 李记彬,胡秀芬,刘 放,等.细胞角蛋白19mRNA检测在大肠癌患者外周血转移检测中的应用[J].现代仪器与医疗,2015,21(1):55-56.
[6] 王 冰,田亚平.非小细胞肺癌患者外周血AEG-1 mRNA的表达及临床意义[J].现代肿瘤医学,2014,22(4):823-826.
[7] 黄美金,吴雪铭,王春芳,等.A EG-1基因在非小细胞肺癌中的表达及其意义[J].重庆医学,2014,43(5):545-547.
[8] Wu F,Guo Li J,Zhang W,etal.Astrocyte elevated gene-1 overexpression in histologically favorable Wilms tumor is related to poor prognosis[J].J Pediat Urol,2014,10(2):317-323.
[9] 王 冰,田亚平.AEG-1表达下调对非小细胞肺癌A549细胞增殖和对顺铂敏感性的影响[J].军医进修学院学报,2012,33(11):1156-1159.
[10] 刘 言,李双齐,刘景波.星形细胞上调基因-1及Girdin在乳腺癌组织中的表达[J].中华实验外科杂志,2015,32(11):2818-2819.
[收稿2016-02-19 修回2016-04-08]
(编辑 张晓舟)
Expression of AEG-1 gene in NSCLC and its clinical significance
GAO Jian-Hua,CAO Hua,LI Xuan,YU Chun-Hua,SONG Xiao-Dong.
Jiangxi Medical College,Shangrao 334000,China
Objective:To investigate the expression of AEG-1 gene in NSCLC and its clinical significance.Methods:Selected our hospital cardiothoracic surgical resection of 83 cases of postoperative cancer tissues of NSCLC patients and 20 paracancer to study,immunohistochemical staining was used to detect the expression level of AEG-1 protein in two groups,the clinical and pathological of AEG-1 protein in patients with NSCLC was analyzed.Results:NSCLC tissues AEG-1 protein expression 46 cases (55.42%) was significantly higher than 2 cases (10.00%) of paracancer (P<0.05).The high expression of AEG-1 protein in NSCLC tissue was significantly correlated with T stage,N stage and distant metastasis (P<0.05),the relationship of AEG-1 between the age,sex,and differentiation degree of the patients was not significant (P>0.05).AEG-1 high expression of NSCLC in patients with a median survival time of 15.0 months was significantly lower than that of 19.0 months (log-rankχ2=4.119P<0.05,) in patients with low expression of AEG-1.Conclusion:AEG-1 gene expression has been up-regulated in NSCLC tissue,which was related to the clinical stage and distant metastasis of the patients.
Non-small cell lung cancer;Star-shaped limb mesenchymal cells up-regulated gene 1;Gene expression;Immunohistochemical analysis
10.3969/j.issn.1000-484X.2016.12.024
高建华(1978年-),男,硕士,讲师,主要从事生物遗传学方面的研究。
R734.2
A
1000-484X(2016)12-1833-04

