在制备尖吻蝮蛇毒出血毒素抗血清中不同凝胶染色方法的比较①
韦传宝 曹佳敏
(皖西学院生物与制药工程学院,六安237012)
在制备尖吻蝮蛇毒出血毒素抗血清中不同凝胶染色方法的比较①
韦传宝 曹佳敏
(皖西学院生物与制药工程学院,六安237012)
目的:寻找在制备出血毒素抗血清中电泳后染色凝胶的好方法。方法:按照前人的方法从皖南产尖吻蝮蛇毒中初步分离3种出血毒素:AaH Ⅰ、AaH Ⅱ和AaH Ⅳ并获得3种粗提取的出血毒素,用制备电泳的方法进一步纯化AaHⅠ、AaH Ⅱ和AaH Ⅳ,对每种出血毒素,配制6块制备电泳板并进行聚丙烯酰胺凝胶电泳,用6种不同的染色方法分别染色,将含出血毒素的凝胶切下,磨细后直接免疫注射小鼠并获得抗血清,用ELISA检测和中和出血毒素出血活性两种方法检测抗血清的质量。结果:不同染色方法制备的抗血清中有效IgG浓度不同,用无毒型蛋白质快速染色试剂盒染色制备的抗血清有效IgG浓度最高。结论:用无毒型蛋白质快速染色试剂盒染色是制备抗血清最好的染色方法。
尖吻蝮蛇;出血毒素;抗血清制备;染色法;质量检测
尖吻蝮蛇(Agkistrodon acutus) 俗称五步蛇,属于蝮亚科、蝮属,分布于我国长江以南地区(包括台湾),是我国特有的剧毒蛇。该蛇毒为血循环型蛇毒,其主要毒素为出血毒素。Xu等[1]最先从皖南产尖吻蝮蛇毒中分离出3种低分子量出血毒素,分别命名为出血毒素Ⅰ(AaH Ⅰ)、出血毒素 Ⅱ(AaH Ⅱ)和出血毒素 Ⅲ(AaH Ⅲ);随后Zhu等[2]从皖南尖吻蝮蛇毒中纯化出1种中等分子量的出血毒素,命名为出血毒素Ⅳ(AaH Ⅳ)。在分离的4种出血毒素中,AaH Ⅰ、AaH Ⅱ和AaH Ⅳ属于酸性蛋白,AaH Ⅲ属于碱性蛋白,AaH Ⅰ、AaH Ⅱ、AaH Ⅳ的出血活性强,最小出血剂量(MHD)分别为0.4 μg、1.5 μg和0.4 μg,AaH Ⅲ出血活性弱,最小出血剂量为10.0 μg,该毒素还具有凝聚白细胞的功能[3]。
研究这些蛋白的性质需要对应的抗血清,对于蛇毒出血毒素而言,制备优质出血毒素抗血清是研究出血毒素性质的基础。要想获得优质抗出血毒素血清,必须先获得纯的出血毒素。离子交换层析和分子筛层析纯化的出血毒素通常情况下还含有少量的其他杂质蛋白,制备的抗血清含有抗杂蛋白的抗体,因此,抗血清的质量不高。制备电泳的方法是采用聚丙烯酰胺凝胶电泳的方法分离蛋白质,分离的蛋白质纯度高,但缺点是分离的蛋白质量少,而且包含在聚丙烯酰胺凝胶中,去除凝胶比较困难。本研究先通过离子交换层析和分子筛层析将尖吻蝮蛇三种酸性出血毒素进行初步分离纯化,然后通过制备电泳进一步纯化,用不同的染色方法对凝胶进行染色,切出含出血毒素的蛋白质凝胶条带,直接将凝胶加生理盐水磨细后免疫注射小鼠,通过比较几种染色方法切出的凝胶制备的抗血清质量,为制备优质抗出血毒素血清寻找一种方便、可靠的凝胶染色方法。
1 材料与方法
1.1 材料 尖吻蝮蛇毒购自安徽省祁门县祁门蛇伤研究所;DEAE-Sephadex A-50、CM-Sephadex C-25、Sephadex G-75、DE52、羊抗鼠IgG-碱性磷酸酶购自Sigma公司;可逆型锌染试剂盒(产品编号:C510019)、可逆型铜染试剂盒(产品编号:C510017)、高灵敏快速考马斯亮蓝染色试剂盒(产品编号:C510041)和无毒型蛋白质快速染色试剂盒(产品编号:C503011)、考马斯亮蓝R250、SDS购自生工生物工程(上海)股份有限公司;其他试剂均为国产分析纯;小鼠购自安徽医科大学,规格18~22 g;蛋白质纯化系统(GE公司);层析柜(普析通用公司);酶标仪(伯乐公司);电泳仪、电泳槽(百晶科技公司)等。
1.2 方法
1.2.1 三种酸性出血毒素的初步分离纯化 按照Xu等[1]的方法初步纯化出血毒素Ⅰ(AaHⅠ)和出血毒素 Ⅱ(AaH Ⅱ);按照Zhu等[2]的方法从皖南尖吻蝮蛇毒中初步纯化出血毒素Ⅳ(AaH Ⅳ)。
1.2.2 出血活性的检测 传统的出血活性检测是用家兔皮内注射的方法,最小出血剂量为产生直径10 mm出血斑点的出血毒素量[4]。本研究用18~22 g小鼠检测出血活性。小鼠有出血敏感、试验方便、成本低的优点。采用1 ml的注射器,将待测样品总量控制在0.12 ml,如果少于0.12 ml用生理盐水补齐。将样品注射到小鼠腹部皮下,每只小鼠腹部注射4个点。30 min后处死小鼠并解剖,出血明显且出血点直径10 mm以上确定为有出血活性。对于每一种出血毒素,通过注射不同量出血毒素确定最小出血剂量(MHD)。
1.2.3 制备电泳胶的配制与制备电泳纯化出血毒素 制备电泳与检测电泳区别在于前者浓缩胶里不插梳子,12%PAGE制备电泳胶的配制见表1。将初步纯化的AaHⅠ、AaH Ⅱ和AaH Ⅳ配制成20 mg/ml,每种毒素制备6块制备电泳凝胶板,每个电泳槽加1.0 ml出血毒素溶液,电泳结束取下凝胶,放塑料盒中待染色。
1.2.4 染色与脱色 将每种毒素电泳后的6块凝胶分别放置不同的塑料盒中,分别用6种方法染色,第1块胶用可逆型锌染试剂盒;第2块胶用可逆型铜染色试剂盒;第3块胶用高灵敏快速考马斯亮蓝染色试剂盒;第4块胶用无毒型蛋白质快速染色试剂盒;均按照说明书进行染色与脱色;第5块胶用实验室配制的常用的考马斯亮蓝染色液(甲醇∶水∶冰乙酸=45∶45∶10,100 ml含0.26 g 考马斯亮蓝R250)染色,用配制的常用脱色液(甲醇∶冰乙酸∶水=300∶100∶600)脱色。第6块胶先用含SDS的电泳缓冲液(1 000 ml含5.0 g Tris,14.4 g Gly,1 g SDS)浸泡30 min,然后用预先冷却4℃的0.25 mol/L KCl染色,蛋白质条带为乳白色。
表1 12% PAGE制备电泳配制表
Tab.1 12% PAGE preparation electrophoresis compon-ent table
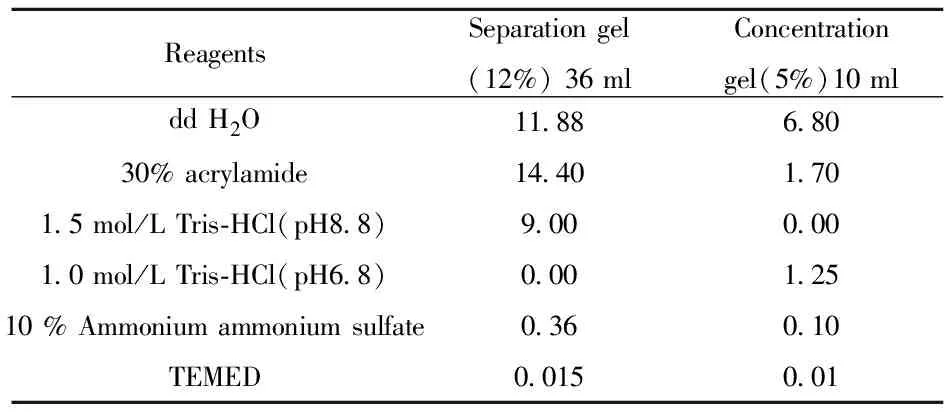
ReagentsSeparationgel(12%)36mlConcentrationgel(5%)10mlddH2O118868030%acrylamide144017015mol/LTris⁃HCl(pH88)90000010mol/LTris⁃HCl(pH68)00012510%Ammoniumammoniumsulfate036010TEMED0015001
1.2.5 抗血清的制备 每种毒素每个染色组免疫1组小鼠(4只),共4次免疫注射,二次注射间隔7 d。具体方法为:取1份含出血毒素的胶体,加2 ml生理盐水,于研钵内充分磨细,将凝胶悬浮液吸入到5 ml规格的一次性注射器中,免疫注射18~22 g的小鼠,共免疫注射4次,每次每只小鼠注射0.5 ml样品,第一次注射每只小鼠皮下注射0.25 ml,腹腔注射0.25 ml,第二、第三、第四次免疫均为腹腔注射,每只小鼠腹腔注射0.5 ml,第四次注射后第3天断头取血,6 h后离心获得抗血清,冷冻保存。
1.2.6 抗血清质量的ELISA检测[5]将步骤1.2.1中制备的粗提的各种出血毒素用包被液配成5 mg/ml浓度,作为抗原包被液,制备的相应抗血清作为一抗,空白对照为无抗原的包被液,阴性对照为未免疫的小鼠血清,二抗用1/10 000的羊抗鼠IgG-碱性磷酸酶,显色30 min后在酶标仪上测定OD405nm。加制备的抗血清组的吸收光值如果大于阴性对照组吸收光值2.1倍,说明血清中含抗该种毒素的IgG,并与毒素结合,抗血清合格,否则不合格。
1.2.7 抗血清中和出血活性检测 ELISA检测呈阳性从理论上说明抗血清中有对应的IgG,抗血清如果能够中和对应的出血毒素的出血活性将是对抗血清质量的直接证明。对每种毒素,取最小出血剂量分别与6种染色方法制备的抗血清混合,30 min后13 000 r/min离心6 min,将上清液注射小鼠腹部皮下,抗血清的用量均为100 μl。30 min后解剖,确定抗血清是否能够中和出血活性,中和出血活性强弱直接说明抗血清的质量。
2 结果
2.1 3种酸性出血毒素的初步纯化 依据前人的方法成功分离出四种出血毒素,每种出血毒素纯度都较高(图略),而且具有出血活性(图1)。AaH Ⅰ、AaH Ⅱ和AaH Ⅳ的最小出血剂量(MHD)分别为0.5、1.3和0.45 μg,与前人的研究结果基本一致[1,2]。
2.2 染色和脱色后毒素的获得 因为电泳的样品是粗提的出血毒素,杂质很少,所有的主条带(粗条带)都是出血毒素,因此用手术刀切下出血毒素蛋白条带(粗条带),将含出血毒素的胶条平分成4份,冷冻保存。每种出血毒素获得6种制备电泳纯化后不同染色的凝胶。
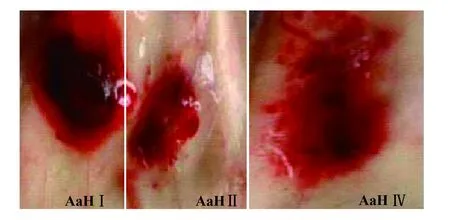
图1 分离的3种出血毒素出血活性检测Fig.1 Hemorrhagic activities test to purified three kinds of hemorrhagins
2.3 抗血清的制备 经过4次免疫,每种出血毒素每组获得约2.8 ml的小鼠抗血清。
2.4 抗血清质量的ELISA检测结果 3种出血毒素与对应的6组抗血清反应的ELISA检测结果见表2。从表2可以看出,第4组用无毒型蛋白质快速染色试剂盒染色制备的抗血清质量比较高,其他抗对应出血毒素血清IgG含量比较低。
2.5 抗血清中和出血活性检测结果 3种出血毒素与对应的6组抗血清中和出血毒素出血活性试验结果表3。从表3可以看出,第4组用无毒型蛋白质快速染色试剂盒染色制备的抗血清能够完全中和对应出血毒素出血活性,其他组制备的抗血清只能部分中和对应出血毒素的出血活性,与ELISA检测结果相吻合。
3 讨论
6组试验都是同样的制备电泳,区别的是染色不同,由于染色剂和脱色剂的成分不同,对出血毒素蛋白的影响也不同。第4组无毒型蛋白质快速染色试剂盒含有单一考马斯亮蓝G-250染色液,胶体状染色液不含有刺激性的甲醇和冰醋酸,安全无毒,该染色液只与蛋白结合,与胶的结合程度低,不需要固定和脱色,蛋白量大于200 ng 时可以清楚地出现染色条带,本试剂盒只需要简单的水洗步骤,不用可能引起蛋白质变性的脱色液。该染色剂染色后出血毒素的蛋白质高级结构基本未变,抗原性完全保留,因此抗血清效价也相对较高。可逆型铜染试剂盒用铜离子与蛋白质结合的方法使蛋白质呈现淡蓝色,可逆型锌染试剂盒用锌离子结合蛋白质染色,由于过量的铜离子或者锌离子对小鼠有毒,在免疫注射时凝胶用量少小鼠才不会死亡,抗原少产生的抗体也少,因此中和出血活性的能力弱。高灵敏快速考马斯亮蓝染色试剂盒的脱色液含甲醇和乙酸,脱色后出血毒素变性,抗原决定簇发生变化,免疫产生的抗体含量也少,与检测结果相符合。常规考马斯亮蓝染色组使用的染色液和脱色液都含甲醇和乙酸,染色后考马斯亮蓝与出血毒素紧密结合,抗原发生了变化,因此产生的抗体也少,KCl染色组在进行染色前用含SDS的电泳缓冲液浸泡了30 min,出血毒素蛋白质与SDS结合,出血毒素的结构发生了变化并失去活性,抗原性也发生了变化,可以预期产生的抗体也少。
表2 3种出血毒素分别与6组对应抗血清反应的ELISA检测结果
Tab.2 ELISA test results between three kinds of hemorrhagins with its antiserums

HemorrhaginGroupone(ProteinStainsZn)OD405nmGrouptwo(ProteinStainsCu)OD405nmGroupthree(ProteinStainsH)OD405nmGroupfour(ProteinStainsL)OD405nmGroupfive(commonCoomassiebrilliantblue)OD405nmGroupsix(KCldyeing)OD405nmAaHⅠ134013501457240013001489AaHⅡ143313351309214912801567AaHⅣ140213501240249011301245
表3 6组抗血清中和3种出血毒素出血活性结果
Tab.3 Results of neutralization of hemorrhagic activities by its antiserums

HemorrhaginNeutralizationofhemorrhagicactivityabilityofGroupone(ProteinStainsZn)NeutralizationofhemorrhagicactivityabilityofGrouptwo(ProteinStainsCu)NeutralizationofhemorrhagicactivityabilityofGroupthree(ProteinStainsH)NeutralizationofhemorrhagicactivityabilityofGroupfour(ProteinStainsL)NeutralizationofhemorrhagicactivityabilityofGroupfive(commonCoomassiebrilliantblue)NeutralizationofhemorrhagicactivityabilityofGroupsix(KCldyeing)AaHⅠ+++++++++++AaHⅡ+++++++++++AaHⅣ+++++++++++
制备电泳分离的出血毒素包埋在网状的聚丙烯酰胺凝胶中,免疫注射后,出血毒素从网状的聚丙烯酰胺凝胶中缓慢释放到动物体内,抗原不但在动物体内停留时间长,充分刺激免疫系统,聚丙烯酰胺凝胶也替代了昂贵的弗氏佐剂。
综上所述,在6种染色方法中,无毒型蛋白质快速染色试剂盒染色制备的蛋白质抗原性保留最完整,免疫小鼠制备的抗血清质量最好,该染色试剂盒可以推广到其他蛋白质抗血清的制备中。
[1] Xu X,Wang C,Liu J,etal.purification and characterization of hemorrhagic components from Agkistrodon acutus (hundred pace snake) venom[J].Toxicon,1981,19(5):633-644.
[2] Zhu ZL,Gong WM,Zhu XY,etal.Purification,characterization and conformational analysis of a haemorrhagin from the venom of Agkistrodon acutus[J].Toxicon,1997,35(2):283-292.
[3] Wei CB,Chen J,Li JH.Acutolysin C,a weak hemorrhagic toxin from the venom of Agkistrodon acutus with leucoagglutination activity[J].J Venom Anim Toxins Incl Trop Dis,2011,17(1):34-41.
[4] Kondo H,Kondo SI,kezawa H,etal.Studies on the quantitative method for determination of hemorrhagic activity of Habu snake venom[J].Japan J Med Sci Biol,1960,13:43-51.
[5] 徐宜为编著.免疫检测技术[M].第3版.北京:科学出版社,1991:158-183.
[收稿2016-08-12 修回2016-09-28]
(编辑 倪 鹏)
Comparative studies by different dyeing methods on antiserum preparation against hemorrhagins from Agkistrodon acutus venom
WEI Chuan-Bao,CAO Jia-Min.
Biological and Pharmaceutical Engineering College,West Anhui University,Liuan 237012,China
Objective:In order to look for a good method for preparation of hemorrhagin antiserum.Methods: Three kinds of hemorrhagins including AaH Ⅰ, AaH Ⅱ, and AaH Ⅳ were purified from Agkistrodon acutus venom according to predecessors′s methods and crude AaH Ⅰ, AaH Ⅱ and AaH Ⅳ were obtained. Preparation electrophoresis was used to purify AaH Ⅰ,AaH Ⅱand AaH Ⅳ further. As for an hemorrhagin, six different dyeing methods were used to dye PAGE gel and the gel contained hemorrhagin was obtained respectively. The ground gel contained hemorrhagin was used to immune mice and its antiserum was obtained. Antiserums quality was tested through ELISA test and neutralization of the hemorrhagic activities of corresponding hemorrhagin. Results: Effective IgG concentration in different antiserum was different and effective IgG made through non toxic type protein fast stain reagent kit was higher than others. Conclusion: Non toxic type protein fast stain reagent kit is the best dyeing method among the six dyeing methods.
Agkistrodon acutus;Hemorrhagin;Antiserum preparation;Dyeing;Quality test
10.3969/j.issn.1000-484X.2016.12.015
①本文为安徽自然科学基金项目(1408085MC43)和安徽省教育厅自然科学重点项目(KJ2015A454,KJ2013A264)。
韦传宝(1961年-),男,博士,教授,硕士生导师,主要从事蛇毒蛋白方面的研究,同时就职于皖西学院抗体制备及其质量检测中心,E-mail:weichuanbao@sina.com。
R991
A
1000-484X(2016)12-1793-04

