离子型谷氨酸受体拮抗剂MK-801和NBQX对胶原诱导型关节炎大鼠的镇痛作用
朱 惠,朱 蓉,邓肇达,封昱辰,沈海丽
(兰州大学第二医院风湿免疫科,兰州 730000)
·论著·
离子型谷氨酸受体拮抗剂MK-801和NBQX对胶原诱导型关节炎大鼠的镇痛作用
朱 惠*,朱 蓉*,邓肇达,封昱辰,沈海丽△
(兰州大学第二医院风湿免疫科,兰州 730000)
目的:在大鼠胶原诱导关节炎( collagen-induced arthritis,CIA )模型中,使用不同离子型谷氨酸受体拮抗剂,即N-甲基-D-天冬氨酸(N-methyl-D-asparticacid,NMDA)受体拮抗剂MK-801及非NMDA受体拮抗剂NBQX,通过阻断谷氨酸与相应受体结合而产生镇痛作用,进而研究两种拮抗剂在镇痛作用方面对大鼠行为的影响,以及对分子生物学指标产生的影响,即应用上述拮抗剂后大鼠血清及组织液中环氧化酶-2(cyclooxygenase-2,COX-2)和Janus激酶-3(Janus-activated kinase,Jak3)等表达的变化。方法: 建立大鼠CIA模型,通过体内研究,向大鼠关节腔内注射不同离子型谷氨酸受体拮抗剂MK-801和NBQX,观察CIA大鼠行为和分子生物学指标的改变。行为评估内容包括大鼠的触痛及关节肿胀情况,触痛情况使用机械性缩足阈值(paw-withdrawal threshold,PWT)来评价,同时使用排水法测足容积来评估肿胀情况。分子生物学指标相关研究即由大鼠心脏采血,并取组织匀浆液,检测血清及组织液中在拮抗剂使用后COX-2和Jak3等表达的变化。结果: MK-801和 NBQX在单独或联合使用时均能表现出镇痛作用(P<0.01), 且镇痛作用持续时间均大于24 h,两种拮抗剂均在注射后4 h达到镇痛作用的峰值,且NBQX比MK-801镇痛作用更强(P<0.05);MK-801和 NBQX在单独及联合使用时,均不能改变CIA大鼠的足跖肿胀(P>0.05);MK-801可降低CIA大鼠COX-2的表达(P<0.01),NBQX则未见此作用(P>0.05);MK-801和NBQX对CIA大鼠的Jak3表达增高均未见产生影响(P>0.05)。结论: MK-801及NBQX均可产生镇痛作用,且NBQX比MK-801表现更强,但两者对肿胀均未见效果;NMDA受体与COX-2炎症通路有一定的交叉作用,而对于Jak3尚不能发现其与离子型谷氨酸信号通路存在交叉作用。
关节炎,类风湿;谷氨酸;受体;炎症;疼痛
类风湿关节炎(rheumatoid arthritis,RA)是一种病因未知的以对称性多关节炎为特征的慢性炎性疾病,目前针对RA发病机制的研究主要集中在各种炎症因子,如肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白介素17(interleukin-17,IL-17)、白介素6(interleukin-6,IL-6)等,以及针对此类因子的前沿生物靶向治疗,并已在临床上取得了较好的疗效[1-2],但临床中仍有部分患者对经典药物及生物制剂应答不佳,还有部分患者全身炎症指标经过治疗后降至正常,但仍有个别关节肿痛明显,而目前应用于临床的关节局部治疗主要集中在激素及生物制剂的局部注射,除此之外尚未见其他有效方法[3],因此探寻针对RA发病机制和治疗新靶点的研究就显得尤为重要。近年来发现谷氨酸是中枢神经系统的重要神经递质,其受体在外周组织(如滑膜、骨、软骨等)中都有表达;滑液中谷氨酸浓度升高,其受体活化与细胞因子释放、痛觉传导、骨吸收有关;而谷氨酸受体拮抗剂能减轻关节肿胀程度和痛觉传导[4-5],故推测谷氨酸可能参与了RA的发病进程。因此,本研究以谷氨酸受体为研究对象,通过给予谷氨酸受体拮抗剂,阻断大鼠胶原诱导关节炎(collagen-induced arthritis,CIA)模型中谷氨酸及其与受体结合的通路,以减少相关炎症介质的释放,从而阻止炎症反应过程,进而观察拮抗剂对大鼠关节炎所致疼痛及肿胀的影响,以及对相关炎症因子表达的作用,探讨谷氨酸信号在RA的作用机制,以期丰富和完善RA发生和发展的理论,并为临床上寻找治疗RA的新靶点及局部治疗提供理论依据。
1 材料与方法
1.1 动物与试剂
1.1.1 实验动物 无特定病原体(specific pathogen free,SPF)级雄性Wistar大鼠138只,5~6周龄,体重220~320 g,购自甘肃省中医学院实验动物中心;实验动物饲养于12 h光亮与12 h黑暗交替的环境中,在造模前至少饲养3 d以保证大鼠适应环境,所有大鼠均自由进食水,垫料按需定期更换,实验过程中努力减少实验大鼠所受痛苦和实验动物的使用数量。
1.1.2 试剂 牛Ⅱ型胶原、完全弗氏佐剂和非N-甲基-D-天冬氨酸(N-methyl-D-asparticacid, NMDA)受体拮抗剂NBQX购自美国Sigma公司,NMDA受体拮抗剂MK-801购自美国Selleck公司,环氧化酶-2(cyclooxygenasez-2, COX-2)、Janus激酶-3(Janus-activated kinase, Jak3)ELISA试剂盒购自上海丰翔生物科技有限公司。
1.2 方法
1.2.1 CIA模型造模方法 按文献[6]方法,将牛Ⅱ型胶原与等体积完全弗氏佐剂充分乳化,在无菌条件下自大鼠尾根1.5~2.0 cm处皮内注射0.2 mL,此为初次免疫,二次免疫以相同方法注射0.1 mL,两次免疫间相隔1周(图1)。
A, blank control group; B, collagen-induced arthritis.
图1 动物模型
Figure1 Animal models
1.2.2 动物分组 实验共分为空白对照组、CIA组、CIA+MK-801组、CIA+NBQX组、CIA+MK-801+NBQX组和8.7%二甲基亚砜(dimethyl sulfo-xide,DMSO)+CIA组(即溶媒组:选取DMSO终浓度较高值作为该组的DMSO浓度)共6组,每组6只。COX-2为诱导型表达,在空白组不表达,故检测COX-2浓度时不设空白组。
1.2.3 各指标评估时间 (1)触痛评估时间:记录给药前(base line,BL)关节的触痛情况,并在给药后4、6、8、10、24、72 h分别评估触痛情况;(2)肿胀评估时间:记录给药前关节肿胀情况,并在给药后4、10、24、72 h分别评估肿胀情况;(3)血清及组织液 COX-2、Jak3浓度检测时间:给药前和给药后4、24、72 h。
1.2.4 关节触痛检测方法 使用Von-Frey纤维丝测量大鼠的机械性缩足阈值(paw-withdrawal thre-shold,PWT)[7],准确记录每次测量的结果,测量结束后查表,根据Xf和K值算出50%缩足阈值,即为PWT。
1.2.5 关节肿胀检测方法 使用排水法将大鼠足跖部插入灌满水的特制量筒(北京硕林苑科技有限公司),使水面与足跖部标记处持平,测量排出水的体积,即为所测大鼠的关节肿胀体积,重复3 次,计算其平均值。
1.2.6 取材方法 心脏取血清方法:对大鼠进行麻醉后消毒并剪开大鼠胸腔,暴露心脏,剪开大鼠的右心耳,用采血管收集血液2~3 mL后置于离心机内2 500~3 000 r/min离心10 min,离心后取上清液置于-20 ℃冰箱保存。组织液获得方法:对大鼠膝关节及以下组织用生理盐水清洗干净并擦干,之后剪下该部分组织,放入冻存管中置于-80 ℃冰箱冷冻,后对组织进行研磨、匀浆,将匀浆液2 500 r/min离心20 min,离心后取上清液置于-80℃冰箱保存。
1.2.7 血清及组织液 COX-2、Jak3浓度检测方法 采用ELISA法检测上述指标,操作步骤严格按照试剂盒说明书进行。
1.3 统计学分析
实验数据采用SigmaStat 3.5及SigmaPlot 12.0(Systat Software Inc.,美国)软件进行统计分析,所有计量资料均以平均值±标准差表示,采用双因素方差分析对各组之间的差异进行比较分析,采用相关性检验统计分析谷氨酸浓度与相应指标之间的关系,P<0.05表示差异有统计学意义。
2 结果
2.1 阻断NMDA和/或非NMDA受体对CIA模型大鼠 PWT的影响
CIA组与空白对照组相比PWT显著降低,即疼痛明显(P<0.01), 单独或联合使用两种拮抗剂后,与CIA组相比较PWT均明显恢复,即镇痛作用明显(P<0.01),至拮抗剂注射后4 h可达PWT恢复峰值,且持续至少24 h,即镇痛作用大于1 d。单独使用NBQX和联合使用两种拮抗剂的镇痛作用均优于单独使用MK-801组(P<0.05),且在4和6 h两个时间点,联合使用两种拮抗剂镇痛作用明显优于单独使用MK-801组(P<0.01),除此之外,在最初的9 h,两种拮抗剂联合使用有更好的镇痛作用,9 h后则联合与单独使用NBQX差异无统计学意义(P>0.05,图2)。
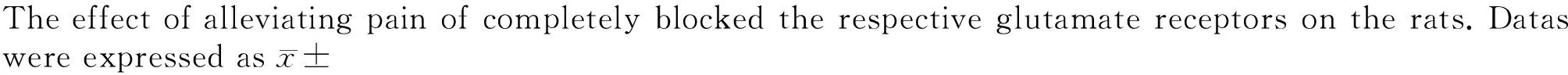
s. * P<0.01,indicated that the group had a statistically significant difference in time between these points compared with the blank control group; # P<0.01,indicated that the group at these time points had a statistically significant difference between the control group and CIA; @ P<0.01,indicated that the group had a statistically significant difference in time between these points compared with the MK-801 group; & P<0.05,indicated that the group hadstatistically difference in time between these points compared with MK-801 group, n=6. BL, base line.
2.2 阻断NMDA和/或非NMDA受体对CIA模型所致关节肿胀的影响
CIA组、单独或联合使用两种拮抗剂组足跖肿胀程度与空白对照组相比差异均有统计学意义,即肿胀明显(P<0.01);而向大鼠膝关节腔内注射不同拮抗剂后,与CIA组相比,差异均无统计学意义(P>0.05,图3),表明单独或联合使用这两种拮抗剂均不能改变CIA所致的足跖肿胀。
2.3NMDA受体拮抗剂MK-801及非NMDA受体拮抗剂NBQX对CIA模型大鼠COX-2表达的影响
两拮抗剂联合使用,在时间点24和72h血清COX-2表达与CIA组相比明显降低(P<0.01);对于单独使用拮抗剂MK-801组,在时间点72h其血清COX-2表达与CIA组相比明显降低(P<0.01),而单独注射拮抗剂NBQX组其血清COX-2表达与CIA组差异则无统计学意义(P>0.05,图4),表明NMDA受体拮抗剂MK-801可降低CIA模型大鼠COX-2表达。
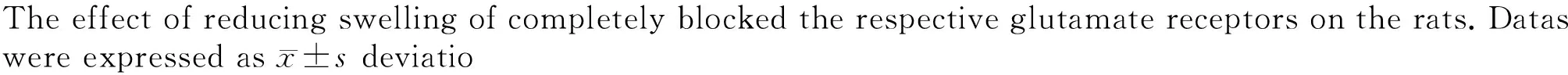
n. *P<0.01,indicated that the group had a statistically significant dif-ference in time between these points compared with the blank control group, n=6. BL, base line.
2.4NMDA受体拮抗剂MK-801及非NMDA受体拮抗剂NBQX对CIA模型大鼠Jak3表达的影响
与空白对照组相比,CIA组及各拮抗剂组血清Jak3的表达均增高(P<0.05), 在BL和4 h两个时间点表达更是显著增高(P<0.01)。单独或联合使用两种拮抗剂的各组,其Jak3的表达与CIA组相比较差异均无统计学意义(P>0.05,图5),表明无论是单独还是联合使用两种拮抗剂,对于CIA所致的表达增高可能均不产生作用。
3 讨论
RA是由于免疫应答异常引起的以炎症及关节破坏为特征的疾病,其病理改变为滑膜炎及血管翳形成,从而引起滑膜细胞的增生和侵蚀,进而导致骨和软骨的破坏。近年来针对其病因及发病机制的研究很多,认为其与细胞免疫功能紊乱、T细胞异常活化以及T细胞亚群失衡等因素有关[8]。关节炎常以疼痛的形式引起患者的主观不适,且这种疼痛具有自发及痛觉过敏的特征,即轻微触压和关节活动即可引起疼痛。谷氨酸作为重要的神经递质参与炎症及疼痛的发生,外源性给予或由伤害感受器释放的谷氨酸可使动物产生疼痛行为并能使人产生疼痛反应,而由其诱导出现的痛觉过敏现象可被NMDA受体拮抗剂阻止[9]。近来解剖、生理及行为学上的证据表明外周谷氨酸及其受体在炎症外周敏化的发展和维持上起重要作用[10]。NMDA和非NMDA受体已被证实存在于初级传入纤维,并且其数量在炎症介导后增加[11],亦有文献报道,RA患者关节滑液中谷氨酸浓度升高且在滑膜成纤维细胞上有谷氨酸受体及其转运体的表达,此外,谷氨酸浓度升高加重了RA患者的骨破坏[12],因此谷氨酸及其受体可能与类风湿关节炎的发病有关。
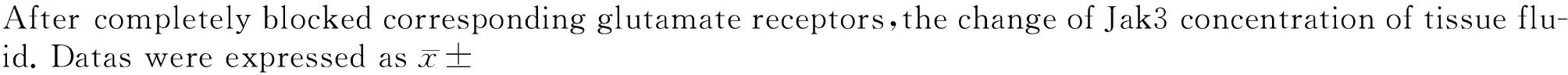
s. * P<0.01,indicated that the group had a statistically significant difference in time between these points compared with the blank control group;# P<0.05,indicated that the group had a statistically difference in time between these points compared with the blank control group, n=6. BL, base line.
有研究报道[13],于关节腔内注射非NMDA受体拮抗剂NBQX,可阻止抗原诱导性关节炎( antigen induced arthritis,AIA )鼠的疼痛及相关的病理改变。本研究单独使用NMDA受体拮抗剂MK-801、非NMDA受体拮抗剂NBQX,以及联合使用这两种拮抗剂均能表现出很好的恢复PWT,即有良好的镇痛作用,镇痛作用持续时间均大于24 h,且NBQX比MK-801在镇痛作用方面表现更优,提示当使用拮抗剂完全阻断离子型谷氨酸受体的作用后,即可减轻关节炎大鼠的疼痛,且阻断非NMDA受体可能会起到更好的镇痛作用,说明非NMDA受体拮抗剂的镇痛作用优于NMDA受体拮抗剂。拮抗剂MK-801、NBQX单独或者是联合使用均不能改变CIA大鼠的足跖肿胀,即这两种拮抗剂对关节炎所致肿胀均可能不产生影响,这尚需要后续通过进行按疗程规律注射并延长观察周期的相关实验来进一步探讨。
RA中重要的炎症介质包括细胞因子IL-1、IL-6和TNF-α等,在RA活动期,滑膜组织及滑液中的IL-6增加[14],非NMDA受体活化后可增加IL-6的释放,从而引起关节疼痛,若给予非NMDA受体拮抗剂NBQX即可降低滑膜成纤维细胞IL-6的表达[15]。本研究为了探讨谷氨酸能信号与相关炎症因子通路的作用,检测了CIA大鼠及各拮抗剂组大鼠血清及组织液中COX-2和Jak3的浓度,大鼠血清中COX-2和Jak3的浓度均较低,以至于难以检出,而组织液中COX-2和Jak3浓度是升高的。给予NMDA受体拮抗剂MK-801可使CIA大鼠COX-2表达降低,而单独注射非NMDA受体拮抗剂NBQX组与CIA组差异无统计学意义,表明NBQX对COX-2的表达可能不产生作用;尽管拮抗剂NBQX无降低COX-2表达的作用,但其是否具有促进MK-801降低COX-2表达的作用,则需通过进一步的实验加以探究。因此,由以上分析得出,NMDA受体与COX-2炎症通路具有一定的交叉作用,这可能也是阻断CIA大鼠谷氨酸受体可减轻大鼠关节疼痛阈值的机制之一。有研究报道[16],NMDA受体拮抗剂MK-801可减轻软骨细胞的增生并能抑制IL-1的释放,从而使由后者诱导软骨细胞所产生的COX-2、IL-6和基质金属蛋白酶-3减少,这为进一步探讨其作用于通路上的位点奠定了初步的基础,从而能更好地研究类风湿关节炎及其疼痛发生发展的机制。另外,本研究也发现无论是单独还是联合使用此两种拮抗剂,对于CIA所致的Jak3表达增高均不产生作用,提示Jak3与谷氨酸信号通路可能无交叉作用,该种情况也可能与样本量较小、观察周期短以及没有进行连续注射等因素相关,而这些都有待于今后的进一步验证。
综上所述,谷氨酸能信号参与了CIA大鼠关节炎症,在类风湿关节炎炎性疼痛的发生发展,以及与其他炎症因子通路交互作用等方面都具有重要作用。针对不同拮抗剂作用的强弱或者说是拮抗剂发挥作用的侧重点不同,这一结论将促使今后在炎症因子之外发现新的能减轻关节疼痛、抑制关节肿胀的信号通路,而这些都将为临床上寻找到治疗RA的新靶点,从而为尽快实现使用精确高效的关节腔内局部注射的方法治疗类风湿关节炎这一思路提供理论依据。
[1]Klareskog L, Catrina AI, Paget S. Rheumatoid arthritis[J] . Lancet, 2009, 373(9664): 659-672.
[2]MdYusof MY, Emery P. Targeting interleukin-6 in rheumatoid arthritis[J]. Drugs, 2013, 73(4): 341-356.
[3]McNearney T, Speegle D, Lawand N, et al. Excitatory amino acid profiles of synovial fluid from patients with arthritis[J]. J Rheumatol, 2000, 27(3): 739-745.
[4]Lawand NB, McNearney T, Westlund KN. Amino acid release into the knee joint: key role in nociception and inflammation[J]. Pain, 2000, 86(1/2): 69-74.
[5]McNearney T, Baethge BA, Cao S, et al. Excitatory amino acids,TNF-α, and chemokine levels in synovial fluids of patients with active arthropathies[J]. Clin Exp Immunol, 2004, 137(3): 621-627.
[6]Brand DD, Latham KA, Rosloniec EF. Collagen-induced arthritis[J]. Nat Protoc, 2007, 2(5): 1269-1275.
[7]Chaplan SR, Bach FW, Pogrel JW, et al. Quantitative assessment of tactile allodynia in the rat paw[J]. J Neurosci Methods, 1994, 53(1): 55-63.
[8]杨金娜, 刘晓光, 李覃, 等. Th17/Treg平衡在类风湿关节炎中作用的研究进展[J]. 中国药理学通报, 2013, 29(8): 1045-1048.
[9]Miller KE, Hoffman EM, Sutharshan M, et al. Glutamate pharmacology and metabolism in peripheral primary afferents:physiological and pathophysiological mechanisms [J] . Pharmacol Ther, 2011, 130(3): 283-309.
[10]Wang J, Geng B, Shen HL, et al. Amino acid transport system A is involved in inflammatory nociception in rats [J]. Brain Res, 2012, 1449(4): 38-45.
[11]Lam FF, Ng ES. Substance P and glutamate receptor antagonists improve the anti-arthritic actions of dexamethasone in rats [J]. Br J Pharmacol, 2010, 159(4): 958-969.
[12]Cowan RW, Seidlitz EP, Singh G. Glutamate signaling in healthy and diseased bone [J]. Front Endocrinol, 2012, 3(7): e89.
[13]Bonnet CS, Williams AS, Gilbert SJ, et al. AMPA/kainate glutamate receptors contribute to inflammation,degeneration and pain related behaviour in inflammatory stages of arthritis [J]. Ann Rheum Dis, 2015, 74(1): 242-251.
[14]Mccarthy DJ, Alexander R, Smith MA, et al. Glutamate-based depression GBD [J]. Med Hypotheses, 2012, 78(5): 675-681.
[15]Flood S, Parri R, Williams A, et al. Modulation of interleukin-6 and matrix metalloproteinase 2 expression in human fibroblast-like synoviocytes by functional ionotropic glutamate receptors [J] . Arthritis Rheum, 2007, 56(8): 2523-2534.
[16]Piepoli T, Mennuni L, Zerbi S, et al. Glutamate signaling in chondrocytes and the potential involvement of NMDA receptors in cell proliferation and inflammatory gene expression [J]. Osteoarthr Cartilage, 2009, 17(8): 1076-1083.
(2016-02-16收稿)
(本文编辑:王 蕾)
Analgesic effects of ionotropic glutamate receptor antagonists MK-801 and NBQX on collagen-induced arthritis rats
ZHU Hui*, ZHU Rong*, DENG Zhao-da, FENG Yu-chen, SHEN Hai-li△
(Department of Rheumatology, Lanzhou University Second Hospital, Lanzhou 730000, China)
Objective: The ionotropic glutamate receptorantagonists include two types: MK-801, anta-gonist of N-methyl-D-asparticacid (NMDA) receptor, and NBQX, antagonist of non-NMDA receptor.The above-mentioned ionotropic antagonists can block the glutamate and its corresponding receptor binding to produce analgesic effect. The objective of this research was to study two antagonists in analgesic effect on rat behavior,as well as to investigate the down-regulation and up-regulation of cyclooxygenase-2 (COX-2) and Janus-activated kinase (Jak3) in collagen-induced arthritis (CIA) rat serum and tissue fluid after the application of these antagonists, that is, the effect on molecular biology. Methods: This study used the ionotropic glutamate receptors as the target and established CIA rat model. Vivo studies were used to observe changes in behavior and molecular biology of the CIA rat.Behavioral assessment includedmechanical allodynia and joint swelling in the CIA rat,where themechanical allodynia was measured using the paw-withdrawal threshold (PWT) with VonFrey filaments according to the “Up-Down” method,and the drainage volume was used to assess joint swelling. Then the blood samples taken from the heart of the rat and the tissue homogenate were collected to detect the down-regulation and up-regulation of COX-2 and Jak3 in the serum and tissue fluid after the antagonists wereused. Results: Using MK-801, NBQX alone or using the combination of these two antagonists,these three methods all could alleviate pain(P<0.01).The analgesic effect lasted more than 24 h.Both antagonists reached the peak of analgesia at the end of 4 hours post-injection.NBQX had stronger analgesic effect than MK-801 (P<0.05).Whether alone or combined use of these two antagonists,could not change the CIA rats’ swelling of the joint (P>0.05). MK -801 could decrease the expression of COX-2 (P<0.01).At the same time, NBQX did not have this effect (P>0.05). Using MK-801, NBQX alone or combination of these two antagonists could not affect the increased expression of Jak3 caused by the CIA (P>0.05). Conclusion: MK-801 and NBQX could both alleviate pain, NBQX was much better than MK-801. Neither MK-801 nor NBQX had the effect on the swelling of the joint. NMDA receptor and COX-2 inflammatory pathways had certain interactions. For Jak3, it could not be found to have cross-function with ionotropic glutamate signaling pathways by this experiment.
Arthritis, rheumatoid; Glutamic acid; Receptor; Inflammation; Pain
甘肃省科技支撑计划基金(144FKCA060)及甘肃省卫生行业科研计划管理项目(GWGL2014-50)资助Supported by Gansu Pro-vince Science and Technology Support Plan Fund (144FKCA060) and Health Industry in Gansu Province Scientific Research Plan Management Program (GWGL2014-50)
时间:2016-11-25 16:27:10
http://www.cnki.net/kcms/detail/11.4691.R.20161125.1627.010.html
R593
A
1671-167X(2016)06-0977-05
10.3969/j.issn.1671-167X.2016.06.010
△ Corresponding author’s e-mail, shl523194@sohu.com
* These authors contributed to this work equally

