玫瑰茄花青素的提取分离研究进展
晁晴晴,胡亚琦,杜新永,谢宜臻,郭兴峰
(聊城大学农学院食品科学与工程系,山东 聊城 252000)
【中药与天然活性产物】
玫瑰茄花青素的提取分离研究进展
晁晴晴,胡亚琦,杜新永,谢宜臻,郭兴峰*
(聊城大学农学院食品科学与工程系,山东 聊城 252000)
综述了近年来国内外应用溶剂提取法、微波辅助提取法、超声波辅助提取法、膜过滤及树脂吸附纯化等方法对玫瑰茄花青素的提取、分离和纯化的最新研究进展。这些方法仍存在提取温度高、溶剂回收难和设备可靠性差等问题,应用新型低温提取技术,如超临界/亚临界流体萃取、高静压提取以及生物酶技术等,是今后玫瑰茄花青素提取分离的发展方向。
玫瑰茄;花青素;提取分离
玫瑰茄(Hibiscussabdariffa),又名洛神花,是锦葵科木槿属的一年生草本植物,原产于西非、印度等热带和亚热带地区,在我国云南、福建、广西、广东和台湾等南方省份均有栽培[1]。玫瑰茄花瓣紫红黑亮,具有轻微香气,含有丰富的有机酸、还原糖、蛋白质、氨基酸及多种矿物质等,其干花萼含有机酸10%~15%、蛋白质3.5%~7.9%、还原糖16%、纤维11%、维生素约1%、灰分12%以及花青素约1%~1.5%[2](质量分数)。研究表明,玫瑰茄具有降低胆固醇、降血压、降血糖、提高免疫力、预防肥胖及心血管疾病、抗菌和保护肝脏等作用。玫瑰茄的主要生物活性成分之一花青素作为一种天然色素,在食品加工过程中可作为食品的功能性天然色素使用,除具有较高的安全性,还有清除自由基、抗氧化、抗衰老、抑制痴呆症的发生和预防脑细胞变性等作用[3]。由于花青素具有不稳定性,在提取分离过程中会造成对其的破坏,致使目前玫瑰茄花青素及其相关产品应用还不广泛。本文综述了玫瑰茄花青素的提取、分离和纯化的最新研究进展,以促进玫瑰茄及其花青素相关产品在我国保健饮料和色素领域的研究与应用。
1 玫瑰茄花青素的种类
玫瑰茄中的花青素很早就得到各国科学家的关注,研究表明其主要以矢车菊素和飞燕草素类花青素(图1)糖苷的形式存在。早在1932年,Yamamato等[4]首先从玫瑰茄中分离出一种结晶的花青苷,称为Hibiscin,并测定其结构为矢车菊素-3-O-葡萄糖苷。1973年, Du 等[5]对特立尼达(Trinidad)产的玫瑰茄红色素进行层析分离和鉴定,发现主要色素为矢车菊素-3-O-接骨木二糖苷和飞燕草素-3-O-接骨木二糖苷,其次为矢车菊素-3-O-葡萄糖苷和飞燕草素-3-O-葡萄糖苷。江南生等[6]研究发现我国云南产玫瑰茄红色素含有两种主要色素和一种微量色素,经过鉴定其中较大量的为飞燕草素-3-O-双葡萄糖苷,次之为矢车菊素-3-双葡萄糖苷和微量的飞燕草素-3-葡萄糖苷。Segura-Carretero等[7]利用固相萃取技术和毛细管电泳串联质谱等鉴定出,飞燕草素-3-葡萄糖苷和矢车菊素-3-葡萄糖苷是玫瑰茄中花青素的主要成分,矢车菊素-3-O-芸糖苷、飞燕草素-3-O-葡萄糖苷、矢车菊素-3,5-二糖苷和绿原酸等是微量组分。
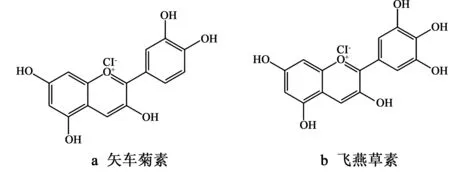
图1 矢车菊素和飞燕草素结构式Fig.1 Structures of cyanidin and delphinidin
2 玫瑰茄花青素的提取研究
2.1 溶剂提取法
溶剂提取法是花青素提取过程中最常用的方法,溶剂多选择水、乙醇、甲醇、丙酮或其混合溶剂等。由于花青素在高温、光照条件下不稳定,提取过程一般在低温下进行,通常在提取溶剂中添加少量的酸以得到花青素阳离子形式并提高其稳定性。但是,酸会导致酰基化的花青素部分水解。传统的溶剂提取法使用热的溶剂进行提取,导致花青素降解,从而降低其生理活性功能[8]。基于以上不足,溶剂提取法逐渐得到改进。Amor等[9]研究并将即时控制压降(D. I. C)处理应用到了溶剂萃取过程中,结果表明,D. I. C对萃取动力学及玫瑰茄干花萼花青素的萃取有很大影响,在0.18 MPa的压力和18 s热处理时间的条件下,花青素含量比传统提取方法高出135%,飞燕草素-3-葡萄糖苷和矢车菊素-3-葡萄糖苷占总花青素的百分比不变,有效扩散率也得到了很大提高。Sindi等[10]利用高效液相色谱法定量研究了不同溶剂对花青素萃取率的影响,结果表明萃取能力大小分别为:水>甲醇>乙酸乙酯>己烷。通过实验结果发现,提取溶剂的萃取能力与提取溶剂的极性有很大的相关性,溶剂极性增加,会增加萃取物浓度,从而提高提取率。
2.1.1 水提取法
水是花青素提取中常用的提取溶剂,用于提取水溶性色素,通常采用酸水提取法、热水提取法和碱水提取法等,以提高其提取效率。水提取法的优点是提取溶剂来源广泛、价格便宜且提取成本低,缺点是水对原料中除色素以外的其他成份的选择性较小,采用水浸提法提取出的色素杂质较多,给后续的纯化、精制带来较大困难。Cissé等[11]采用固液萃取法从玫瑰茄中提取花青素的研究表明,料液比及花萼颗粒大小是影响提取效率的主要因素,在料液比为1:25,25 ℃条件下,花青素的提取率最大,达到88%;花萼颗粒大小由2 cm减小到150 μm,明显缩短了提取时间;温度升高增加了扩散系数进而缩短了提取时间,但是对提取率没有影响。同时,他们提出了一个萃取动力模型,固液比1:5条件下,花青素萃取率可达63%,花青素浓度可达到0.3 g/L。李升峰等[12]通过单因素试验、3因素3水平的正交试验来研究浸提温度、浸提时间和料液比对玫瑰茄花萼可溶性固形物、总酸和单体花青素提取效率的影响,确定了最佳的浸提条件为浸提温度75℃,浸提时间50 min,花萼与水的质量比1:25。
2.1.2 乙醇提取法
乙醇提取法是花青素的常规提取方法之一,由于乙醇具有方便回收、极性大和无毒等特点,因此成为工业提取花青素过程中最常用的提取溶剂。李升峰等[13]运用4因素2次回归正交旋转组合设计试验,系统研究了玫瑰茄干花萼花青素提取过程中乙醇浓度、液料比、提取温度和提取时间4因素对花青素得率的影响,确定了花青素的最优提取参数。通过各因素对花青素提取率的研究表明,各因素对玫瑰茄干花萼花青素提取率影响的大小顺序分别为提取温度、液料比、提取时间和乙醇浓度。花青素提取的适宜条件为温度70.27~74.06 ℃,液料比24.12~26.18,时间1.57~1.76 h,乙醇体积分数为39.84% ~44.4%。曾哲灵等[14]应用单因素试验和响应面分析(RSM),以40%乙醇为提取溶剂研究了不同提取条件下玫瑰茄花青素的提取效果,最终结果表明玫瑰茄花青素的最优提取条件为:料液比1:24.8(g/mL),提取温度48.74 ℃,提取时间1.52 h,提取液中花青素的含量为4.88 mg/g。Borras- Linares等[15]利用酸化的乙醇提取、通过HPLC技术测定了25种玫瑰茄提取物的多酚、黄酮以及花青素含量,结果表明,由白色到黄色再到红色,颜色逐渐加深的25种玫瑰茄中,除4种白色的无花青素外,其余玫瑰茄中飞燕草素和矢车菊素均占花青素质量分数的90%以上,且不同玫瑰茄中飞燕草素和矢车菊素的含量不同。并且,他们首次提出了可以根据玫瑰茄花青素中飞燕草素和矢车菊素的不同进行玫瑰茄的分类,为以后的研究提供了方便。
2.2 微波提取法
微波提取法是在电磁场中使极性分子从原来的随机分布状态转向依照电场的极性排列取向,这些取向按交变电磁的频率不断变化,从而使提取溶剂及物料产生热效应和非热效应,加速溶剂分子对物料的渗透和待提取成分溶剂化,从而增强提取效果。微波提取法具有耗时少、选择性高以及能耗低等优点。目前,微波技术已广泛应用于植物中各种生物活性成分提取。张赛男等[16]应用微波辅助提取技术在单因素试验的基础上研究了微波功率、料液比和提取时间对玫瑰茄花青素提取率的影响,结果表明,料液比、微波功率以及提取时间为影响微波提取法提取玫瑰茄花青素得率的主要因素,最佳提取条件为料液比1:25(g/mL),微波功率164 W,提取时间12 min,在此条件下,玫瑰茄花青素提取量为5.38 mg/g。刘宜丰[17]应用微波提取技术,通过正交实验研究了玫瑰茄花青素提取的最优条件,确定了微波提取法提取玫瑰茄花青素的最佳工艺条件为微波功率500 W,提取液pH为3.0,微波处理时间100 s,料液比1:10(g/mL),在此条件下玫瑰茄花青素提取率达92.78%。
2.3 超声波提取法
超声波提取法是利用超声波独特的空化效应和机械效应,加速细胞破碎、增加溶剂的穿透力、并缩短提取时间,从而达到提高提取效率的方法。应用超声波技术提取花青素类生物活性物质,所需的提取时间明显短于常规溶剂浸提法。
师文添[18]以冰醋酸为溶剂,采用超声波法研究玫瑰茄中花青素的提取效果,以花青素的提取率作为评价指标,在单因素试验的基础上应用响应面优化得到影响玫瑰茄花青素的最佳提取条件为冰醋酸体积分数9%,液料比1:22(g/mL),超声时间28.5 min,超声功率490 W。涂宗财等[19]研究超声波辅助提取玫瑰茄花青素最佳工艺条件时,采用pH示差法对花青素含量进行测定,通过正交试验确定了玫瑰茄花青素的最佳提取条件为超声功率80 W,固液比1:25(g/mL),提取温度50 ℃,提取时间20 min。在此最佳条件下,花青素得率为0.566%,其得率与传统浸提方法相比提高了14.3%,且大大缩短了提取时间。杨大兵等[20]采用超声波技术提取玫瑰茄干花萼浸提液,以浸提液吸光度为评价指标,确定了最佳浸提条件为超声波功率60 W,提取温度70 ℃,提取时间30 min,料液比1:30(g/mL)。
3 玫瑰茄花青素的纯化研究
3.1 膜过滤技术
膜过滤技术(Membrane Filtration,MF)是以压力为动力,在常温条件下实现对物料中某些组分的分离、提纯和浓缩的分离技术,因其在常温下进行,溶剂间没有相变,特别对热敏性物质具有很好的保护作用。膜过滤技术根据膜孔径可分为微滤、超滤、纳滤和反渗透等,适合于不同物质的分离、提纯和浓缩,是天然产物分离、纯化中的新技术之一。
胡建农等[21]用聚酰胺微滤膜对玫瑰茄浸提液进行微滤、纳滤提纯时,物料在40 ℃以下可有效去除浸提液中的悬浮杂质和多糖,使浸提液变得透亮、澄清,且处理后对花青素的截留很少,最终产品中花青素回收率在98%以上,充分说明膜过滤技术可很好地应用在玫瑰茄花青素的提纯、浓缩过程中。郭宏等[22]以玫瑰茄花青素为研究对象,研究了超滤和反渗透技术对玫瑰茄花青素提取液的分离、提纯和浓缩效果,结果表明在操作温度30 ℃、操作压力0.3 MPa、料液流速1.375 m/s条件下,应用截留分子量为50 000 Da的聚砜超滤膜可有效去除提取液中的果胶类物质,果胶和色素分离率分别大于90%和96%;在相同温度下,调节操作压力至4.5 MPa,采用HR95PP聚酰胺反渗透膜可将玫瑰茄超滤透过液浓缩至 20°Bx。张赛男等[23]应用纳滤和反渗透浓缩玫瑰茄花青素,确定了玫瑰茄色素纳滤和反渗透浓缩的最佳条件为UH100超滤膜和NS027纳滤膜进行组合,操作压力分别为0.4 MPa和1.5 MPa,操作温度分别为30~35 ℃和40 ℃,纯化后花青素含量可达32.7 mg/g干粉重,为生产高纯度的玫瑰茄色素产品提供了一个较好的方法。
3.2 树脂纯化技术
树脂吸附作用是依靠树脂填料与被吸附物质分子之间的范德华力、氢键等相互作用力,通过其巨大的比表面积进行的物理性吸附过程,经不同洗脱能力的溶剂洗脱分开从而达到分离、纯化的目的。大孔吸附树脂的物理化学性质比较稳定,不溶于有机溶剂、酸及碱,对有机物选择性好,解析条件温和,常用于花青素的提取纯化过程中。
张国铭等[24]应用大孔吸附树脂分离纯化玫瑰茄红色素,结果表明在DA-20l、H-103、X-5、S-8四种树脂中,对玫瑰茄花青素吸附效果最好的为DA-201吸附树脂,吸附率为82.47%,用无水乙醇作为洗脱剂,脱附率可达95.68%;经该树脂分离纯化后,花青素质量分数减少4.26%,但色价可提高7.36倍。实验证明,采用DA-201大孔树脂分离纯化工艺对玫瑰茄红色素的富集是行之有效、成本低廉且效果显著的方法,可工业化推广。尹忠平等[25]研究了大孔树脂吸附纯化玫瑰茄花萼粗提花青素的条件和方法,结果表明,X-5树脂对玫瑰茄花青素具有较好的吸附性能,最佳条件为上柱液pH=3.0、质量浓度5.63 mg/mL、流速 2.0 mL/min ;最佳洗脱剂为体积分数60%的乙醇,经吸附纯化后所得花青素色价从5.1提高到了32.3,且树脂经多次重复使用,吸附性能无明显减弱,可以进行循环利用。许立松等[26]利用HPD-100大孔吸附树脂吸附玫瑰茄红色素时,发现其同样具有很好的吸附、洗脱效果,工艺过程较为稳定,适合规模化生产。Zhang等[27]用反相色谱C18填料及Sephadex 葡聚糖凝胶LH-20柱分离纯化了玫瑰茄提取物,并得到两个高抗氧化和抗肿瘤活性的组分,经过HPLC-ESI-MS/MS检测其含量,结果表明玫瑰茄的此两种花青素含量分别是863.41 mg/g和617.25 mg/g。
4 玫瑰茄花青素提取分离技术研究现状与展望
4.1 研究现状与存在问题
综上所述,玫瑰茄花青素早在几百年前已得到关注和研究,并作为天然功能性色素应用到食品加工过程中。随着科学技术的发展,很多新型的提取分离手段也逐步在玫瑰茄花青素的提取分离过程中得到研究和应用,如水提取法、乙醇提取法、微波辅助提取法、超声波辅助提取法、膜分离和树脂分离等,这些提取分离技术的应用对玫瑰茄花青素的提取起到了很好的强化效果,但是也存在一些问题和不足,主要表现在:
(1)提取溶剂回收成本较高,以水或乙醇作为提取溶剂在浓缩过程中有大量溶剂需要回收,造成成本的增加;
(2)常规方法提取过程中均有热效应,会导致玫瑰茄中花青素的降解,造成花青素色价和生物活性功能的下降;
(3)一些新的提取方法需要新型提取设备的支持,存在前期投入大、设备生产能力和稳定性有待于进一步提高等问题。
4.2 未来展望
玫瑰茄含有的丰富的花青素、有机酸等生物活性物质,在食品、保健品和药品中具有较好的开发前景。花青素作为玫瑰茄的主要活性成分,应用更加安全、高效的技术手段相互结合使用、优势互补,实现进一步的提取、分离和纯化,使其得到更好的发展利用,已成为当前重要的研究课题之一,也是花青素提取、纯化方法未来的发展趋势。
近年来一些提取分离的新技术、新方法,可以为玫瑰茄花青素的开发开辟新途径。超临界/亚临界流体萃取技术具有产品无溶剂残留、萃取温度低、能有效保护花青素生理活性功能等的优点,可用于热敏性花青素类活性物质的提取、纯化的研究过程中。高静压提取利用100~1 000 MPa的高压在常温下使细胞壁和细胞膜破损,使通透性改变,近年来在生物活性成分的提取方面有了长足的发展。利用纤维素酶、果胶酶等生物酶技术可促进细胞壁分解和细胞内色素物质的溶出,在玫瑰茄花青素的提取纯化过程中具有十分广阔的应用前景。另外,微波-超声波辅助提取技术、高压脉冲电场辅助提取技术、高速逆流色谱分离技术以及基质固相萃取技术等,近年来也在该领域得到越来越多的研究和应用。通过对上述低温提取和分离技术的集成,可以优化花青素的提取纯效果,从而进一步促进玫瑰茄及其花青素产品的开发和利用。
[1]沂南. 玫瑰茄[J]. 食品与健康, 2011(6): 34.
[2]王金亭. 天然玫瑰茄红色素研究进展[J]. 粮食与油脂, 2010 (11): 40-43.
[3]陈政. 玫瑰茄的开发与利用[J]. 饮料工业, 2007, 10(3): 13-16.
[4]YAMAMOTO R, OSHIMA Y. On the red coloring matter of Hisbiscus sabdariffa L. [J]. Bulletin of the Agricultural Chemical Society of Japan, 1932, 8(10/11/12): 142-149.
[5]DU C T, FRANCIS F J. Anthocyanins of roselle ( Hisbiscus sabdariffa L.) [J]. Journal of Food Science, 1973, 38(5): 810-812.
[6]江南生, 严曰仁, 唐本琏. 玫瑰茄红色素的鉴定[J]. 食品与发酵工业,1990(3): 18-23.
[7] SEGURA-CARRETERO A, PUERTAS-MEJA M A, CORTACERO-RAMREZ S, et al. Selective extraction, separation, and identification of anthocyanins fromHibiscussabdariffaL. using solid phase extraction- capillary electrophoresis-mass spectrometry (time-of-flight/ion trap) [J]. Electrophoresis, 2008, 29(13):2852-2861.
[8]孙建霞, 张燕, 胡小松, 等. 花青素的提取、分离以及纯化方法研究进展[J].食品与发酵工业, 2008, 34(8): 111-117.
[9] AMOR B B, ALLAF K. Impact of texturing using instant pressure drop treatment prior to solvent extraction of anthocyanins from Malaysian Roselle (Hibiscussabdariffa) [J]. Food Chemistry, 2009, 115 (3): 820-825.
[10] SINDI H A, MARSHALL L J, MORGAN M R A. Comparative chemical and biochemical analysis of extracts ofHibiscusSabdariffa[J]. Food Chemistry, 2014, 164: 23-29.
[11] CISSÉ M, BOHUON P, SAMBE F, et al. Aqueous extraction of anthocyanins fromHibiscussabdariffa: Experimental kinetics and modeling [J]. Journal of Food Engineering, 2012, 109(1): 16-21.
[12]李升峰,徐玉娟,刘学铭,等. 玫瑰茄浸提工艺条件的研究[J]. 农产品加工·学刊,2006(7):11-13.
[13]李升锋,徐玉娟,张友胜,等. 玫瑰茄花青素提取条件优化研究[J]. 广东农业科学, 2006 (11): 83-85.
[14]曾哲灵,郝纯青,吕伟,等. 响应面法优化玫瑰茄红色素提取工艺[J]. 食品科学, 2010, 31(20): 47-51.
[15]BORRAS-LINARES I, FERNANDEZ-ARROYO S, ARRAEZ-ROMAN D, et al. Characterization of phenolic compounds, anthocyanidin, antioxidantand antimicrobial activity of 25 varieties of Mexican Roselle (Hibiscussabdariffa) [J]. Industrial Crops and Products, 2015, 69: 385-394.
[16]张赛男,陈毅勇,宗俊. 响应面法优化微波提取玫瑰茄花色苷工艺研究[J]. 粮油食品科技,2015,23(6): 57-61.
[17]刘宜锋. 应用微波技术提取玫瑰茄色素[J]. 福建轻纺,2008(1):16-19
[18]师文添. 响应面法优化玫瑰茄中花青素的超声波提取工艺[J]. 安徽农业科学,2010, 38(31):17433-17435
[19]涂宗财,尹月斌,姜颖,等. 超声波辅助提取玫瑰茄花青素的工艺优化[J]. 食品研究与开发, 2011, 32(10): 1-4.
[20]杨大兵,杨志锦,陈振林. 超声波提取玫瑰茄浸提液工艺条件的研究[J]. 农产品加工·学刊,2012(2): 85-88.
[21]胡建农, 郑晓英. 膜技术提取玫瑰茄红色素工艺的初步研究[J]. 亚热带植物科学,2004, 33(3): 19-21.
[22]郭宏,彭义交,吕晓莲,等. 膜分离技术集成在玫瑰茄色素加工中的应用[J]. 食品科学,2011,32(14):341-345.
[23]张赛男,李林福,陈毅勇. 超滤、纳滤膜技术分离浓缩玫瑰茄花青素研究[J]. 食品工业科技, 2015,36(23):143-147.
[24]张国铭,高虹. DA-201吸附树脂纯化分离玫瑰茄红色素的研究[J]. 广东化工,2007, 34(2):23-25.
[25]尹忠平,洪艳平,徐明生. 大孔树脂吸附纯化粗提玫瑰茄红色素研究[J]. 江西农业大学学报,2007, 29(6):1026-1030.
[26]许立松,马银海. 大孔树脂吸附法提取玫瑰红色素[J]. 食品科学, 2009, 30(12): 120-122.
[27]ZHANG B T, MAO G H, ZHENG D H,et al. Separation, identification, antioxidant, and anti-tumor activities ofHibiscussabdariffaL. extracts [J]. Separation Science and Technology, 2014, 49 (9): 1379-1388.
Advances on extraction and purification of anthocyanins fromHibiscussabdariffaLinn.
CHAO Qing-qing, HU Ya-qi, DU Xin-yong, XIE Yi-zhen, GUO Xing-feng*
(Department of Food Science and Engineering, School of Agriculture, Liaocheng University, Liaocheng 252000, China)
∶We review the latest advances on solvent extraction, microwave assisted extraction, ultrasonic assisted extraction, membrane filtration and resin absorption and purification for extraction, separation and purification of anthocyanins fromHibiscussabdariffaLinn. These approaches have such defects as high extraction temperature, difficult solvent recovery and poor equipment reliability. Therefore, novel low temperature purification technologies such as supercritical/ subcritical fluid extraction, high hydrostatic pressure extraction and bio-enzyme are future development trend for extraction and separation of anthocyanins fromHibiscussabdariffaLinn.
∶HibiscussabdariffaLinn.; anthocyanins; extraction and purification
10.3976/j.issn.1002-4026.2016.05.007
2016-04-13
聊城大学大学生创新创业训练技术(201410447038);聊城大学大学生科技文化创新项目(SF2014212,2014196 SF)
晁晴晴(1991—),女,研究方向为保健食品加工。Email: 973672385 @qq.com
*通信作者,郭兴峰(1983—),男,博士,讲师,研究方向为天然产物研究与开发、农产品加工。Email: guoxingfeng@lcu.edu.cn
R284.2
A

