毛细管电泳电化学发光检测鱼露中的L-羟脯氨酸含量的不确定度评定
沈俊炳
(诏安县质量计量检验检测所,福建 诏安 363500)
毛细管电泳电化学发光检测鱼露中的L-羟脯氨酸含量的不确定度评定
沈俊炳*
(诏安县质量计量检验检测所,福建 诏安 363500)
为验证检验机构的毛细管电泳检测能力及进行毛细管电泳检测能力比对,按照JJF 1059.1—2012《测量不确定度评定与表示》、CNAS-GL05:2011《测量不确定度要求的实施指南》及CNAS-GL06:2006《化学分析中不确定度的评估指南》,对新开发的毛细管电泳电化学发光检测鱼露中的L-羟脯氨酸含量的不确定度进行评定。不确定度来源主要有标准溶液、移取定容体积、试样重复测定、回收率和最小二乘法拟合标准曲线。结果表明,该方法中最小二乘法拟合标准曲线求试样含量引入的不确定度uc对合成标准不确定度的贡献最大,其次为试样重复测定引入的不确定度urep,而L-羟脯氨酸标准溶液配制过程中引入的不确定度us也不容小觑。上述3个方面应该在实验过程中加以注意,以提高实验的准确度。本研究对各个不确定度分量进行量化,得出鱼露中的L-羟脯氨酸含量为(50.44±8.80) mg/L,k=2.576。研究结果为L-羟脯氨酸含量测定新方法的质量控制提供了理论依据。[中国渔业质量与标准,2016,6(4):31-36]
毛细管电泳;电化学发光;L-羟脯氨酸;不确定度;鱼露
L-羟脯氨酸,又称顺式-4-羟基-L-脯氨酸,分子式C5H9NO3,是一种亚氨基酸[1],白色片状结晶或结晶性粉末,呈苦味中的独特甜味,可作香料。L-羟脯氨酸是胶原蛋白的主要成分,广泛存在于动物皮[2]、胶原海绵[3]、鱼皮[4]等水解液中,其他普通蛋白质中含量极少[5],是动物水解蛋白的指示性氨基酸[6],检测其在食品中的含量,可用于判定在食品加工过程中是否违法添加了动物水解蛋白以提高蛋白质含量[7-9]。因此要求L-羟脯氨酸的检测方法具有更高的准确度。
不确定度是表征合理地赋予被测量之值的分散性,与测量结果相联系的参数[10]。不确定度评定作为一种科学的方法,不但能给出测量结果可信度,还能有效地评定测量结果的质量[11]。同时不确定度评定也使得国内国际间不同检测机构的实验数据得以共享[12]。因此,不确定度评定在各个领域都倍受关注[13-15]。
目前有的L-羟脯氨酸的检测方法主要有分光光度法、高效液相色谱法、液质联用法、氨基酸自动分析仪法及毛细管电泳法[16-17]。但目前国家只颁布了GB/T 9695.23—2008《肉与肉制品 羟脯氨酸含量测定》[18](国家标准)和SN/T 3929—2014《出口食品中L-羟脯氨酸的测定 液相色谱-质谱法/质谱法》[19](进出口行业标准)这两个标准。而上述两个标准并不适用于水产品中L-羟脯氨酸含量的检测。因此开发适用于水产品中L-羟脯氨酸含量检测的标准方法尤为重要。同时为验证检验机构的毛细管电泳检测能力及进行毛细管电泳检测能力比对,本研究以新开发的鱼露中L-羟脯氨酸含量的毛细管电泳电化学发光检测方法为例,按照JJF 1059.1—2012《测量不确定度评定与表示》[20]、CNAS-GL05:2011《测量不确定度要求的实施指南》[21]及CNAS-GL06:2006《化学分析中不确定度的评估指南》[22],建立了毛细管电泳电化学发光检测鱼露中L-羟脯氨酸含量的不确定度测量模型,分析各个不确定度来源,量化各个不确定度分量,最终对测量结果进行不确定度分析和评定。不仅验证了不同检验机构的毛细管电泳检测能力,也为新开发的毛细管电泳电化学发光检测鱼露中L-羟脯氨酸含量检测方法的质量控制提供理论依据,同时也为开发其他毛细管电泳电化学发光检测方法提供理论依据。
1 材料与方法
1.1 仪器与试剂
MPI-A型毛细管电泳电化学发光检测仪(西安瑞迈分析仪器有限责任公司);75 cm×25 μm (id.)无涂层石英熔融毛细管(永年县锐沣色谱器件有限公司);MS105DU电子天平(瑞士Mettler Toledo公司);1~10 mL移液器(德国Eppendorf公司);pH211C酸度计(意大利HANNA公司);KQ2100E超声波清洗器(昆山市超声波仪器有限公司)。
氯化三(2,2′-联吡啶)钌(II)六水合物(Ru(bpy)32+)、L-羟脯氨酸(美国Sigma-Aldrich公司,纯度≥99%);NaH2PO4、Na2HPO4、NaOH、HCl(国药集团化学试剂有限公司,AR)。
实验用水均为纯水,鱼露购自超市。
1.2 实验方法
1.2.1 L-羟脯氨酸标准溶液配制
L-羟脯氨酸标准储备溶液(1 000 mg/L):准确称取0.100 0 g L-羟脯氨酸标准品(精确到0.1 mg),用纯水溶解并定容至100 mL。
L-羟脯氨酸标准工作溶液:用纯水按比例稀释标准储备溶液,分别配制成10、25、50、100、250、500 mg/L的标准工作溶液。
1.2.2 试样处理
鱼露用纯水稀释后即可进行测定。
1.3 毛细管电泳电化学发光检测条件
检测条件:光电倍增管高压为800 V;检测电位为1.20 V;Ru(bpy)32+浓度为6 mmol/L;缓冲溶液浓度为50 mmol/L PBS;缓冲溶液pH为8.0。进样条件:10 kV×12 s。分离条件:运行高压为14 kV;运行缓冲溶液浓度为50 mmol/L;运行缓冲溶液pH为8.5。所有进入毛细管的溶液均需超声波脱气,并用0.22 μm醋酸纤维膜过滤。
2 结果与分析
2.1 数学模型
试样中L-羟脯氨酸含量的计算公式见式(1)。
式(1)
式(1)中:X为试样中的L-羟脯氨酸含量(mg/L);c为试样稀释液中的L-羟脯氨酸含量(mg/L,根据标准曲线计算得出);V为移取的试样体积(mL);n为试样稀释液体积(mL)。
2.2 不确定度来源分析
经过对测定步骤和2.1中数学模型进行分析,影响L-羟脯氨酸检测结果的不确定度因素主要有:L-羟脯氨酸标准溶液配制过程中引入的不确定度、试样移取定容过程中引入的不确定度、试样重复测定产生的不确定度、L-羟脯氨酸回收率引入的不确定度和最小二乘法拟合标准曲线求试样含量引入的不确定度。
2.3 不确定度分度量化
2.3.1 L-羟脯氨酸标准溶液配制过程中引入的相对标准不确定度us
2.3.1.1 L-羟脯氨酸标准品纯度引入的相对标准不确定度us1分析
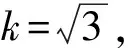
2.3.1.2 L-羟脯氨酸标准品称量引入的相对标准不确定度us2分析
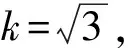
2.3.1.3 L-羟脯氨酸标准溶液配制过程中器具引入的相对标准不确定度us3分析
本实验过程中配制L-羟脯氨酸标准溶液使用容量瓶和移液器所引入的不确定度分量主要有3个方面:1)使用的容量瓶和移液器体积校准不确定引入的标准不确定分量us3(1);2)使用的容量瓶和移液器重复性引入的标准不确定分量us3(2);3)配制过程中L-羟脯氨酸标准溶液温度与检定标准温度(20 ℃)不同引入的标准不确定分量us3(3)。3个不确定度分量的计算如下。

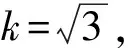
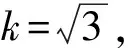
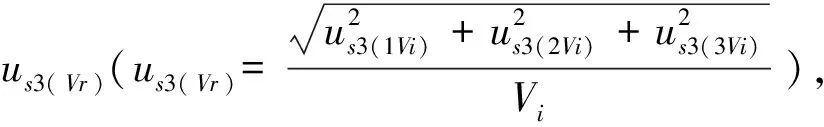
表1 容量瓶和移液器的相对标准不确定度
Tab.1 The relative standard uncertainty of volumetric flask and pipette
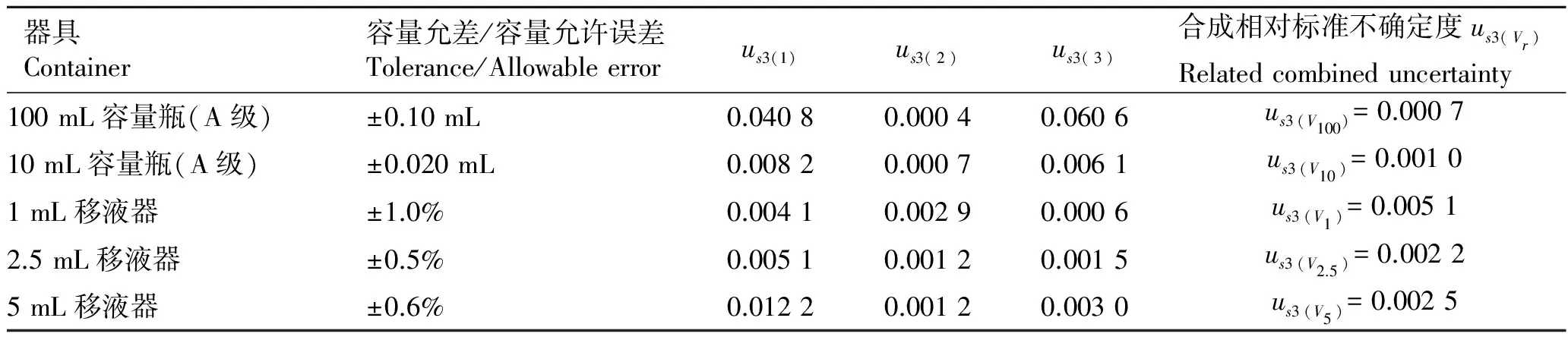
器具Container容量允差/容量允许误差Tolerance/Allowableerrorus3(1)us3(2)us3(3)合成相对标准不确定度us3(Vr)Relatedcombineduncertainty100mL容量瓶(A级)±0.10mL0.04080.00040.0606us3(V100)=0.000710mL容量瓶(A级)±0.020mL0.00820.00070.0061us3(V10)=0.00101mL移液器±1.0%0.00410.00290.0006us3(V1)=0.00512.5mL移液器±0.5%0.00510.00120.0015us3(V2.5)=0.00225mL移液器±0.6%0.01220.00120.0030us3(V5)=0.0025

2.3.2 试样移取定容过程中引入的相对标准不确定度uv
2.3.3 试样重复测定产生的相对标准不确定度urep
按上述实验方法进行试样测定,试样平行检10次,测定结果,计算结果见表2。
表2 试样中L-羟脯氨酸含量重复检测结果
Tab.2 L-hydroxyproline content of the sample parallel test

平行实验/(mg·L-1)Paralleltest12345678910平均值/(mg·L-1)Averagevalue相对标准偏差/%RSD50.06251.55848.42452.02251.29852.30251.47848.72050.27848.24450.443.03
根据A类不确定度评定,计算出相对标准不确定度如下:
=0.009 6(n=10)。
2.3.4 L-羟脯氨酸回收率引入的相对标准不确定度urec
由于是新开发的L-羟脯氨酸检测方法,方法的回收率是否符合相关要求也是需要考虑的重点,需进
行不确定度评定。本实验根据测定试样的L-羟脯氨酸含量,分别进行了10、20、30 mg/L 3个水平的添加,每个添加水平做4次平行实验,计算回收率,计算结果见表3。
=0.005 2(n=12)。
显著性检测是用来确定平均回收率是否与理想状态100%回收有显著性差异。采用t-检验确定平均回收率与理想状态100%回收是否有显著性差异。假设显著性水平α=0.05,查表得n-1自由度的双边临界值tcrit=2.201(n=12)。
表3 试样回收率测定结果
Tab.3 Recovery test results of samples
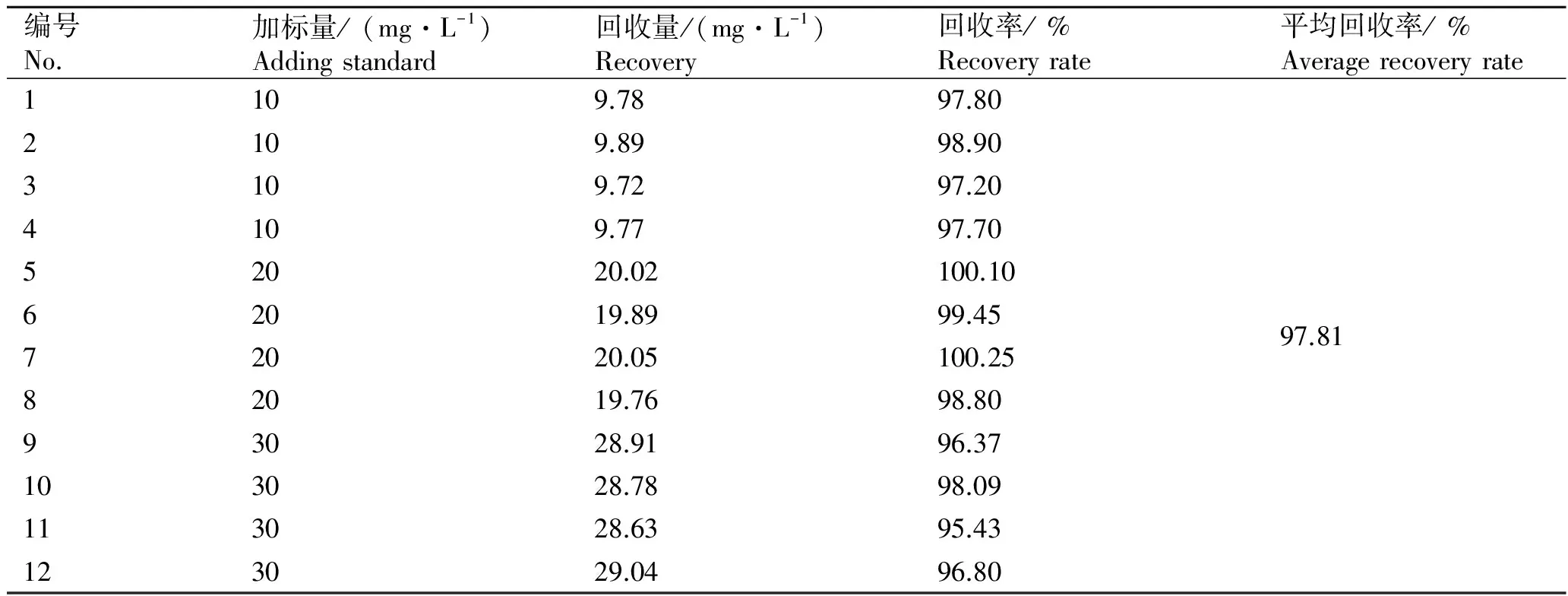
编号No.加标量/(mg·L-1)Addingstandard回收量/(mg·L-1)Recovery回收率/%Recoveryrate平均回收率/%Averagerecoveryrate1109.7897.802109.8998.903109.7297.204109.7797.7052020.02100.1062019.8999.4572020.05100.2597.8182019.7698.8093028.9196.37103028.7898.09113028.6395.43123029.0496.80
平均回收率与理想状态100%回收有显著性差异,必须考虑L-羟脯氨酸回收率引入的不确定度。
2.3.5 最小二乘法拟合标准曲线求试样含量引入的相对标准不确定度uc
将10、25、50、100、250、500 mg/L的标准溶液工作液各测定3次,得到相应的电化学发光强度,其结果见表4。
根据表4的测定数据,用最小二乘法拟合求出标
表4 L-羟脯氨酸标准溶液质量浓度和相应的电化学发光强度
Tab.4 L-hydroxyproline standard mass concentration and corresponding ECL intensity

质量浓度/(mg·L-1)MassconcentrationI1I2I3I1032.131.633.132.32581.982.782.182.250164.5167.8167.4166.6100330.1322.7328.7327.2250845.2840.9837.6841.25001744.21759.61740.81749.7
注:I为实验条件下的L-羟脯氨酸标准溶液的电化学发光强度。

对试样进行10次平行测定,测得试样检测液中的L-羟脯氨酸质量浓度为25.22 mg/L,则鱼露中的L-羟脯氨酸含量为50.44 mg/L。标准曲线拟合的相对标准不确定度如下:
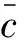
2.3.6 计算相对合成标准不确定度及扩展不确定度
不确定度各分量按正态分布处理,取置信因子k=2.576(置信区间99%),则扩展不确定度U=c0×k×uc=8.80 mg/L。
2.3.7 不确定度分量比例

图1 各个不确定度分量分布图Fig.1 Distribution diagram of each component of uncertainty
通过对鱼露中L-羟脯氨酸含量测定过程中各个不确定度来源进行分析,将各个不确定度分量按比例绘制成图,如图1所示。由图1可以看出,最小二乘法拟合标准曲线求试样含量引入的不确定度uc对合成标准不确定度的贡献最大,其次是试样重复测定引入的不确定度urep,再者L-羟脯氨酸标准溶液配制过程中引入的不确定度us也不容小觑。
3 结论
本实验中,鱼露中的L-羟脯氨酸含量为(50.44±8.80) mg/L,k=2.576。新开发的毛细管电泳电化学发光检测鱼露中的L-羟脯氨酸检测方法的准确度得到验证。通过对实验过程中的不确定度分析发现,此新开发的L-羟脯氨酸检测方法中最小二乘法拟合标准曲线求试样含量引入的不确定度uc对合成标准不确定度的贡献最大,其次是试样重复测定引入的不确定度urep,再者L-羟脯氨酸标准溶液配制过程中引入的不确定度us也不容小觑,对此以后改进此新方法的过程中,需要特别注意在测定标准曲线过程中要规范操作及增加平行实验次数。本研究为此L-羟脯氨酸测定新方法的质量控制提供了理论依据。
[1] 刘思洁, 郭良友, 李青, 等. 乳与乳制品中L-羟脯氨酸检测技术的研究进展[J]. 食品安全质量检测学报, 2014,5(9):2629-2633.
[2] 蓝蔚青, 王川, 李燕, 等. 猪皮中羟脯氨酸含量的测定[J]. 现代食品科技, 2006,22(3):232-234.
[3] 关静, 叶萍, 武继民. 胶原海绵的羟脯氨酸含量测定[J]. 氨基酸和生物资源, 2000, 22(1):52-54.
[4] 郭恒斌, 曾庆祝, 闫磊, 等. 分光光度法测定鱼皮中羟脯氨酸含量测定[J]. 食品研究与开发, 2007,28(7):81-83.
[5] 蔡梅, 吉文亮, 刘华良, 等. 氨基酸自动分析仪对牛乳中羟脯氨酸快速测定方法研究[J]. 中国食品卫生杂志, 2012,24(6):542-545.
[6] 增暖茜, 王洪健, 周兴起, 等. 氨基酸自动分析仪对乳制品中羟脯氨酸的测定方法研究[J]. 现代食品科技, 2008,24(7):719-721.
[7] 刘婷, 姜金斗, 刘宁. HPLC-OPA柱后衍生离子交换法对乳粉中掺水解动物蛋白检测方法的研究[J]. 食品工业科技, 2007,2(7):207-209.
[8] 胡华, 吕定, 杜青, 等. 高效液相色谱法检测酱油中羟脯氨酸的含量[J]. 中国调味品, 2010,35(4): 106-109.
[9] 赵一晖, 刘思杰, 张培军, 等. 高效液相色谱发测定乳与乳制品中L-羟脯氨酸的含量[J]. 食品安全质量检测学报, 2016,7(1): 55-58.
[10] 国家质量监督检验检疫总局. JJF1135—2005化学分析测量不确定度[S]. 北京:中国计量出版社, 2005.
[11] 赵健亚, 陈丹, 谢怀根, 等. 高效液相色谱法测定鸡肉中磺胺类药物残留的不确定度评定[J]. 食品科学, 2013,34(10):144-147.
[12] 任雪冬, 刘成雁, 林雪征, 等. 液相色谱-串联质谱法测定畜禽肉中十种磺胺类兽药残留的不确定度评定[J]. 中国兽药杂志, 2011,45(5):20-25.
[13] 马丽莎, 郑光明, 陈昆慈, 等. 气相色谱法测定水产品中氯霉素的不确定度分析[J]. 中国渔业质量与标准, 2013,4(3):15-20.
[14] 熊铁, 李强, 黄志鹏, 等. 临床凝血检验项目测量不确定度的评定[J]. 海南医学, 2013,24(1):60-61.
[15] 赵雪. 机织物接缝强力测量的不确定度分析[J]. 纺织学报, 2015,36(10):49-53.
[16] 薛静, 梁恒, 李甜, 等. 毛细管电泳-电致化学发光法测定人尿中脯氨酸和羟脯氨酸[J]. 分析化学, 2005,33(6):785-788.
[17] 蒲云霞, 徐晓枫, 苏军, 等. 柱前衍生-反相高效液相色谱法测定乳及乳制品中的L-羟脯氨酸[J]. 中国卫生检验杂志, 2012(9):2056-2057.
[18] 中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会. GB/T 9695.23—2008 肉与肉制品羟脯氨酸含量测定[S]. 北京:中国标准出版社, 2008.
[19] 中华人民共和国国家质量监督检验检疫总局. SN/T 3929—2014 出口食品中L-羟脯氨酸的测定 液相色谱-质谱/质谱法[S]. 北京:中国标准出版社, 2014.
[20] 国家质量监督检验检疫总局. JJF1059.1—2012测量不确定度评价与表示[S]. 北京:中国计量出版社, 2012.
[21] 中国合格评定国家认可委员会. CNAS-GL05:2011测量不确定度要求的实施指南[S]. 北京:中国合格评定国家认可委员会, 2011.
[22] 中国合格评定国家认可委员会. CNAS-GL06:2006化学分析中不确定度的评估指南[S]. 北京:中国合格评定国家认可委员会, 2006.
[23] 国家质量监督检验检疫总局. JJG196—2006常用玻璃量器检定规程[S]. 北京:中国计量出版社, 2006.
[24] 国家质量监督检验检疫总局. JJG64—2006移液器检定规程[S]. 北京:中国计量出版社, 2006.
Evaluation of uncertainty in detection of L-hydroxyproline in fish sauce by capillary electrophoresis electrochemiluminescence
SHEN Junbing*
(Zhao’an Institute of Quality Inspection and Metrological Verification, Zhao’an 363500, China)
In order to verify the ability of capillary electrophoresis of the inspection body and compare the ability of capillary electrophoresis, the uncertainty evaluation of the new method for detection of L-hydroxyproline in fish sauce through capillary electrophoresis electrochemiluminescence was conducted in accordance with JJF 1059.1—2012 "Evaluation and Expression of Uncertainty in Measurement", CNAS-GL05:2011 "Guidance on the Application of the Requirements for Measurement Uncertainty" and CNAS-GL06:2006 "Guidance on Evaluating the Uncertainty in Chemical Analysis". After the analysis of L-hydroxyproline measurement, the uncertainty sources included standard solution, pipetting volume by volume, repetitive sample measurement, recovery and least-squares fitting standard curve. The results showed that in the L-hydroxyproline detection method, the uncertaintyucintroduced for the mea-surement of content by the least square method to fit the standard curve contributes highest to combined standard uncertainty, followed by uncertaintyurepintroduced for repeated measurement. Furthermore, the uncertaintyusintroduced for the L-hydroxyproline standard solution preparation process should not be underestimated. Attention should be paid to the above three aspects in the experiment process, in order to improve the accuracy of the experiment. Through each quantified uncertainty components on fish sauce, the results showed that L-hydroxyproline content was (50.44±8.80) mg/L,k=2.576. The research results provide a theoretical basis for the quality control of new determination methods of L-hydroxyproline content. [Chinese Fishery Quality and Standards, 2016, 6(4):31-36]
capillary electrophoresis; electrochemiluminescence; L-hydroxyproline; uncertainty; fish sauce
SHEN Junbing, cysjbsjb@163.com
2016-04-27;接收日期:2016-06-16
诏安县质量计量检验检测所事业发展基金〔2016〕004号
沈俊炳(1989-),男,硕士,助理工程师,研究方向为食品可追溯体系和食品检验质量控制,cysjbsjb@163.com
S94
A
2095-1833(2016)04-0031-06

