菲律宾蛤仔对阿特拉津的富集与消除规律
王玮云,刘丽娟,张华威,任利华,姜向阳,姜芳,孙灵毅
(1.山东省海洋资源与环境研究院,山东 烟台 264006;2.烟台市水产研究所,山东 烟台 264003)
菲律宾蛤仔对阿特拉津的富集与消除规律
王玮云,刘丽娟1*,张华威1,任利华1,姜向阳1,姜芳1,孙灵毅2
(1.山东省海洋资源与环境研究院,山东 烟台 264006;2.烟台市水产研究所,山东 烟台 264003)
采用半静态水质接触染毒法,研究了菲律宾蛤仔对养殖海水中阿特拉津的富集和消除规律。在水温(20±1) ℃,阿特拉津暴露浓度分别为1.0、10.0和200 μg/L的养殖海水中,菲律宾蛤仔中阿特拉津含量随暴露浓度的升高而逐步增加,二者之间呈显著正相关关系。在3个暴露组中,菲律宾蛤仔对阿特拉津的富集表现为随着时间的推移先增加后降低,而后维持在某一含量水平(分别为5.2、30.5 和420.1 μg/kg),仅产生小幅波动。3个暴露浓度下,菲律宾蛤仔中阿特拉津含量分别在第4天、第4天和第2天达到富集最大值,最大富集系数分别为15.4、6.15、3.56。在消除实验中,菲律宾蛤仔中阿特拉津含量迅速下降,3个实验浓度下降到低于检出限的时间分别为1、4和8 d。结果表明,菲律宾蛤仔对阿特拉津具有快速富集和快速消除能力,本研究可为海水贝类食品安全和海洋环境保护提供理论依据。[中国渔业质量与标准,2016,6(4):12-16]
阿特拉津;菲律宾蛤仔;富集;消除
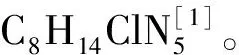
菲律宾蛤仔(Ruditapesphilippinarum)是一种分布比较广的滩涂贝类,在中国沿海均有分布,近年来已成为中国北方沿海重要的养殖贝类之一,具有很高的经济价值。菲律宾蛤仔生活在潮间带或近岸浅海,且生长位置比较固定,受阿特拉津污染的风险较大。然而,目前关于阿特拉津在水生生物中的生物富集和消除规律研究较少[8],有关阿特拉津在菲律宾蛤仔体内富集效应的研究在国内外尚未见报道。本研究探讨了阿特拉津在菲律宾蛤仔体内的富集及消除规律,以期为深入研究阿特拉津对水生生物的危害程度和作用机理提供参考,为海水贝类食品安全和海洋环境保护提供理论依据。
1 材料与方法
1.1 实验生物
实验用菲律宾蛤仔取自山东省牟平近海,壳长2.5 ~3.0 cm。实验前将菲律宾蛤仔在实验条件下暂养3 d,每天换水1次,定时投喂硅藻(烟台海益苗业有限公司培育,经检测未受阿特拉津污染)1次,连续充氧。经检测菲律宾蛤仔不含阿特拉津,驯养期间及时清除状态不佳和死亡个体,选择活动性强的健康蛤仔进行实验。
1.2 实验用水
富集、消除实验在山东省烟台海益苗业有限公司完成。实验用海水为该公司育苗生产用水,取自蓬莱近海,经沙滤、升温后使用,水温(20±1) ℃,pH7.8~8.0,盐度30,经检测均不含阿特拉津。
1.3 主要仪器和试剂
气相色谱-质谱联用仪(6890N/5973N,Agilent,USA);超声波清洗器(KQ-600E,昆山市超声仪器有限公司),凝胶色谱仪(Accuprep Mps,J2 Scientific,USA);全自动固相萃取仪(ASPEC XL4+,Gilson,France),旋转蒸发仪(Laborota 4001,Heidolph,Germany)。乙酸乙酯(色谱纯,Merck);环己烷(色谱纯,Tedia);丙酮(色谱纯,Merck);正己烷(色谱纯,Merck);石墨化碳柱(Carbon,500 mg/6 mL,Bong Elut);氨基柱(NH2SPE Tubes,500 mg/3 mL,CNWBOND)。
阿特拉津(atrazine)标准品由Dr. Ehrenstorfer提供,纯度>98.0%。实验用水为去离子水。标准溶液的配制:准确称取一定量标准品,用甲醇溶解定容至100 mg/L,使用前用乙酸乙酯稀释至所需浓度。
1.4 富集和消除实验
设置1.0、10.0和200 μg/L 3个实验组和1个空白对照组,每组设置2个平行。设置7个150 L水箱,每个实验水箱内注入新鲜海水100 L,加入适量的阿特拉津储备液,使水体中的阿特拉津的最终质量浓度分别为0、1.0、10.0和200 μg/L,各放入经暂养的健康菲律宾蛤仔100只。采用半静态水质接触染毒法,每24小时换一半含相同质量浓度阿特拉津的海水。分别在富集实验开始后的第6、24、48、96、144、240、336、432和528小时取样,每次从每个水箱内随机取菲律宾蛤仔5只,分别放入标记清楚的自封口塑料袋中密封,-20 ℃冷冻保存。富集实验结束后进行菲律宾蛤仔体内阿特拉津的消除实验,把所有实验水箱换成清洁海水,分别在换水完毕后的第2、24、48、96、192和336小时进行取样,投喂、取样方法与富集实验一致。实验过程中及时捞出死亡的菲律宾蛤仔。
1.5 阿特拉津含量的测定
用滤纸将所取菲律宾蛤仔壳表面擦干,解剖,取所有可食部分,用均质机制成匀浆,称取匀浆后的
样品5.00 g于50 mL塑料离心管中。样品预处理和含量测定均按照张华威等[9]的方法进行,该方法阿特拉津检出限为1.0 μg/kg。
2 结果与讨论
2.1 菲律宾蛤仔对不同浓度阿特拉津的富集规律
以阿特拉津暴露浓度为横坐标,菲律宾蛤仔中阿特拉津的含量为纵坐标,分别对第6、24、48、96、144、240、336、432和528小时的暴露浓度-富集量关系做线性回归分析,见表1。
表1 暴露浓度-富集量线性回归
Tab.1 Linear regression of concentration- accumulation of atrazine

时间/hTime回归方程Linearregression相关系数 R26y=2.7129x+8.09710.999624y=2.8923x+9.02790.999648y=3.4867x+14.27300.999396y=2.3873x+24.99200.9979144y=2.8085x+14.29000.9988240y=2.0223x+6.55940.9997336y=2.0565x+9.04970.9993432y=2.1955x+9.99690.9993528y=2.113x+6.01510.9998
回归方程经t检验,相关系数R2均达到极显著水平(P<0.01)。在同一时间点,随着海水暴露浓度的增加,菲律宾蛤仔中阿特拉津的含量逐渐增加,二者呈显著正相关关系。
分别做不同暴露浓度下菲律宾蛤仔中阿特拉津含量随时间变化的富集浓度-时间(C-t)图(图1)。由图1可见,在22 d的实验过程中,菲律宾蛤仔中阿特拉津含量表现为先迅速升至最高值后迅速降低,而后含量维持在某一水平(5.2、30.5和420.1 μg/kg),仅产生小幅波动的变化趋势,振幅分别为暴露浓度的0.99倍、0.79倍和0.20倍。第22天富集实验结束时,1.0、10.0和200 μg/L 3个实验组菲律宾蛤仔中阿特拉津的平均含量分别为4.9、30.6和428.5 μg/kg(n=2),为暴露浓度的4.9倍、3.1倍和2.1倍;富集最高值分别为15.4、61.5和 711 μg/kg,分别为暴露浓度的15.4倍、6.15倍和3.56倍;富集达到最大值所需时间分别为4、4和2 d。
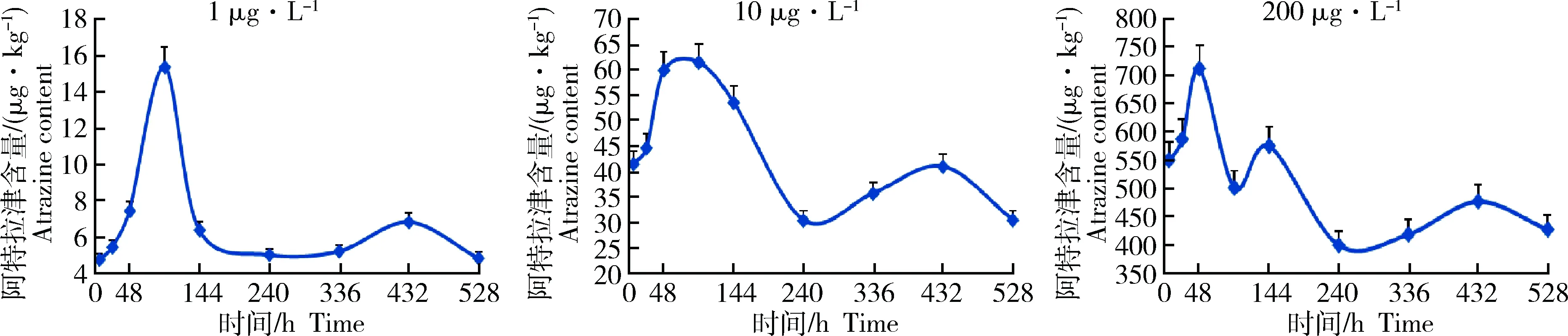
图1 菲律宾蛤仔中阿特拉津含量-时间曲线Fig.1 C-t curve of atrazine at various exposed concentrations in Ruditapes philippinarum(n=2)
随着养殖海水中阿特拉津浓度的升高,菲律宾蛤仔的富集效率逐步下降,即暴露浓度越低,富集效率越高,相对于暴露浓度的富集量波动越大;暴露浓度越高,富集效率越低,相对于暴露浓度的富集量波动越不明显。
由图2可见,在1.0、10.0和200 μg/L 3个暴露浓度下,菲律宾蛤仔对阿特拉津的富集系数总体变化趋势相同,均表现为先升高后下降至某一水平上下波动。在1.0 μg/L暴露浓度下,富集系数最高值为15.4(96 h);在10.0 μg/L暴露浓度下,富集系数最高值6.1(96 h);在高暴露浓度(200.0 μg/L)下,富集系数最高值3.6(48 h)。富集实验开始后6 h,1.0、10.0和200 μg/L暴露组的阿特拉津富集系数分别为4.8、4.2、2.8,显示菲律宾蛤仔对阿特拉津具有快速富集效应。每个时间点菲律宾蛤仔对阿特拉津的富集系数均随暴露浓度的升高而下降,证明其富集效率与暴露浓度成反比。

图2 菲律宾蛤仔在阿特拉津不同暴露浓度下的富集系数-时间曲线Fig.2 BCF-t curve of atrazine at various exposed concentrations in Ruditapes philippinarum(n=2)
2.2 菲律宾蛤仔对阿特拉津的消除规律
由图3可见,在14 d的消除实验过程中,1.0、10.0和200 μg/L 3个实验组菲律宾蛤仔中阿特拉津的含量均在极短时间(2 h)就出现断崖式下降,分别达到1.4、4.0、47.2 μg/kg,暴露浓度越高下降幅度越大;在24 h时分别降至低于检测限、2.3和13.3 μg/kg,此后下降趋缓。实验水体中的阿特拉津浓度始终低于检出限(1.0 μg/kg)。3个实验组下降到低于检出限的时间分别为1、4 和8 d。结果表明,菲律宾蛤仔对阿特拉津的消除效率很高,脱离暴露环境可以迅速降低菲律宾蛤仔中阿特拉津的含量。

图3 菲律宾蛤仔中阿特拉津含量随时间的消除变化曲线Fig.3 C-t curve of atrazine at various exposed concentrations in elimination stage
3 讨论
3.1 菲律宾蛤仔对阿特拉津的富集作用
正辛醇/水分配系数(Kow)为某一化学品在正辛醇相与水相浓度之比,Pacakova等[10]采用lgKow值来估计污染物在生物体中的生物富集效果,阿特拉津 lgKow值为2.7,代表阿特拉津应易于在生物体内富集,与本研究结果一致。本研究数据显示,在阿特拉津暴露浓度为1、10和200 μg/L时,菲律宾蛤仔的最大富集系数分别为15.4、6.15、3.56,与徐英江等[8]对海参的研究结果相比,相同阿特拉津暴露浓度下海参的最大富集系数分别为1.77、1.46、1.23,可见不同水生动物对阿特拉津的富集能力存在着较大区别,菲律宾蛤仔对阿特拉津的富集能力明显高于海参。
菲律宾蛤仔对阿特拉津的富集速度快,富集系数高,可能与其摄食方式有关。菲律宾蛤仔为滤食性生物,直接滤食海水中的浮游藻类为食物。浮游藻类具有巨大的总表面积、特殊胞外组分及细胞形态,对阿特拉津具有很高的富集能力[11]。藻类富集除草剂是毒物物理转移的一个重要途径,可通过食物链在高浓度水平转移毒物,对所有的水生生物生存造成不良的影响[12-13]。通过食物链的传递,阿特拉津可在菲律宾蛤仔中快速富集,而且菲律宾蛤仔具有开放式循环系统[14],与外来物质的接触较为充分,因此会快速形成峰值。
富集实验开始时,菲律宾蛤仔中阿特拉津含量迅速上升,达到最高值后逐渐下降,可能是由于短时间内菲律宾蛤仔对阿特拉津的代谢效率远低于富集效率,表现为富集量的快速增加;随着体内阿特拉津含量的升高,代谢效率也不断提高,逐渐高于富集效率,菲律宾蛤仔中阿特拉津的含量逐渐下降;随后,由于对环境的适应,菲律宾蛤仔对阿特拉津的富集和代谢效率达到平衡,表现为阿特拉津含量基本达到稳定状态。
3.2 菲律宾蛤仔对阿特拉津的消除能力
消除实验表明,阿特拉津在菲律宾蛤仔中的含量在短时间内呈断崖式下降,可能是由于转移到洁净海水中之后,菲律宾蛤仔对阿特拉津的代谢效率远高于富集效率,表现为其阿特拉津含量的急速下降;菲律宾蛤仔对阿特拉津的代谢效率随着体内阿特拉津含量的减少逐渐下降,直至降至检出限以下。且菲律宾蛤仔中阿特拉津含量越高,完全消除需要的时间越长。
2012年,日本查出从中国进口的3 种贝类产品中扑草净残留超标[15],引起对海产贝类除草剂污染情况的重视。目前国内外尚没有水产品中阿特拉津的残留限量规定,中国标准规定玉米、甘蔗等食品中阿特拉津残留限量为≤0.05 mg/kg[16]。一般情况下,菲律宾蛤仔在食用前需要在洁净海水中24 h的净化以排出体内的泥沙,在此期间菲律宾蛤仔中的阿特拉津可被迅速净化。研究发现莱州湾海域表层海水中阿特拉津质量浓度为6.82~83.0 ng/L[17],在自然状态下,随污染的径流和池塘养殖用水排入海水中的阿特拉津,在海水的稀释和自净作用后浓度应远远低于人工给药浓度1.0 μg/L。根据实验数据推测,在自然海区中生长的菲律宾蛤仔,经过24 h净化后其阿特拉津含量应该达到1 μg/kg以下,食用相对安全。
4 结论
实验结果表明,在1.0、10.0和200 μg/L阿特拉津暴露浓度下,菲律宾蛤仔分别在暴露后第4天、第4天和第2天对阿特拉津达到富集最大值,分别为15.4、61.5和711 μg/kg,最大富集系数分别为15.4、6.15、3.56。在各暴露浓度下,菲律宾蛤仔对阿特拉津的富集量均随着作用时间的延长而呈现先升高后降低的变化趋势。菲律宾蛤仔对阿特拉津的富集能力因阿特拉津暴露浓度的不同有所差异,低暴露浓度下富集系数大,高暴露浓度下富集系数小,低暴露浓度下阿特拉津在菲律宾蛤仔中易产生较大程度的富集。转移至洁净海水后,阿特拉津在菲律宾蛤仔中的含量在短时间内呈断崖式下降,说明阿特拉津在菲律宾蛤仔中能够快速消除。
[1] 李清波, 黄国宏, 王颜红, 等. 阿特拉津生态风险及其检测和修复技术研究进展[J]. 应用生态学报, 2002,13( 5):625- 628.
[2] 弓爱君, 叶常明. 除草剂阿特拉津的环境行为综述[J]. 环境科学进展, 1997,5(2):37-47.
[3] 任晋, 蒋可. 官厅水库水中莠去津及其降解产物残留的分析[J]. 分析实验室, 2004,23(12): 17- 20.
[4] 塔娜, 冯建芳, 孙成, 等. 太湖梅梁湾水体中阿特拉津的毛细管气相色谱法测定[J]. 环境污染与防治, 2005,27(8):634-636.
[5] Gfrerer M, Martens D, Gawlik B M.Triazines in the aquatic systems of the Eastern Chinese Rivers Liao- He and Yangtse[J].Chemosphere, 2002,47:455-466.
[6] Buser H R.Atrazine and other s- triazine herbicides in lakes and in rain in Switzerland [J]. Environ Sci Technol, 1990,24:1049-1058.
[7] Fischer-Scherl T,Veeser A,Hoffmann R W,et al.Morphological effects of acute and chronic atrazine exposure in rainbow trout (Oncorhynchusmykiss) [J]. Arch Environ Contam Toxicol, 1991,20:454- 461.
[8] 徐英江, 宫向红, 任传博, 等. 除草剂阿特拉津在刺参中的生物富集与消除效应研究[J]. 海洋渔业, 2013, 35(3): 337-341.
[9] 张华威,刘慧慧,田秀慧,等. 凝胶色谱-固相萃取-气相色谱串联质谱法测定水产品中9种三嗪类除草剂[J].质谱学报, 2015,36(2):177-184.
[10] Pacakova V,Stulik K,Jiskra J. High-performance separations in the determination of triazine herbicides and their residues [J]. J Chrom A, 1996,754(1):17-31.
[11] 吴颖慧, 蔡磊明, 王捷, 等. 除草剂莠去津对7种藻类的生长抑制[J]. 农药, 2007,46(1):48- 51.
[12] Shubert L L. Algae as Ecological Indicators [M]. London:Academic Press, 1984:35-42.
[13] 刘爱菊, 朱鲁生, 王军, 等. 除草剂阿特拉津的环境毒理研究进展[J]. 土壤与环境, 2002,11(4):405-408.
[14] 山东省水产学校. 贝类养殖学[M]. 北京:中国农业出版社, 1995:5.
[15] 李庆鹏, 秦达, 崔文慧, 等. 我国水产品中农药扑草净残留超标的警示分析[J].食品安全质量检测学报, 2014,5(1):108-112.
[16] 中华人民共和国农业部. GB 2763—2014食品安全国家标准.食品中农药最大残留限量[S]. 北京:中国标准出版社, 2014.
[17] 徐英江,刘慧慧,任传博,等. 莱州湾海域表层海水中三嗪类除草剂的分布特征[J]. 渔业科学进展,2014,35(3): 34-39.
Accumulation and elimination of atrazine in Ruditapes philippinarum
WANG Weiyun1, LIU Lijuan1*, ZHANG Huawei1, REN Lihua1, JIANG Xiangyang1, JIANG Fang1, SUN Lingyi2
( 1. Shandong Marine Resource and Environment Research Institute, Yantai, 264006, China; 2. Yantai Fisheries Research Institute, Yantai 264003, China)
Accumulation and elimination of atrazine inRuditapesphilippinarumwere studied by semi-static method. TheRuditapesphilippinarumwas exposed to water containing 1.0, 10.0 and 200 μg/L atrazine at (20±1)℃. The accumulation amounts in these clams were rised with the increase of atrazine concentrations (1.0, 10.0, 200 μg/L), presenting significantly positive correlation. Moreover, the residues of atrazine were firstly increased and then decreased. Afterwords they remained at certain concentrations (i.e.5.2, 30.5 and 420.1 μg/kg) with small fluctuations. The biggest bioconcentration factors (BCF) for the three concentrations were 15.4,6.15 and 3.56 when exposed for 4,4 and 2 d, respectively. In addition, the atrazine concentration was dropped down in elimination stage till it was not detected after 1, 4 and 8 d. These suggested thatRuditapesphilippinarumhad strong ability on rapid accumulation and elimination of atrazine. The study would provide theoretical support for the sea shellfish food safety and marine environmental protection.[Chinese Fishery Quality and Standards, 2016, 6(4):12-16]
atrazine;Ruditapesphilippinarum; accumulation; elimination
LIU Lijuan, liu_li_juan_426@aliyun.com
2015-12-19;接收日期:2016-05-21
烟台市科技发展计划项目( 2013NC334);山东省现代农业产业技术体系贝类产业创新团队(SDAIT-19)
王玮云( 1987-) ,女,硕士,助理研究员,研究方向为水产品质量安全检测,wwy495278513@163.com 通信作者:刘丽娟,副研究员,研究方向为水产品质量安全检测,liu_li_juan_426@aliyun.com
S94
A
2095-1833(2016)04-0012-05

