降解菌Pseudomonas sp.对阿特拉津的降解条件优化
刘丹丹,刘 畅,刘长风,李欣燕
(沈阳化工大学环境与安全工程学院,辽宁沈阳110142)
降解菌Pseudomonas sp.对阿特拉津的降解条件优化
刘丹丹,刘 畅,刘长风,李欣燕
(沈阳化工大学环境与安全工程学院,辽宁沈阳110142)
为微生物降解菌在农药污染土壤修复工程中应用提供参考,以从长期受阿特拉津污染的农田土壤中筛选出的一株降解菌Pseudomonas sp.为研究对象,采用单因素试验研究其在不同培养条件下对阿特拉津的降解效果,并采用正交试验进一步优化该菌的降解条件。结果表明:碳源对降解效果的影响不大;培养时间48h,底物浓度100mg/L,温度25~35℃,pH 5.0~8.0,盐度0.1%~1%时,该菌对阿特拉津的降解效果较好,降解率大于90%;该菌对阿特拉津降解的最佳组合条件为温度30℃,pH 7.0,盐度0.5%;且3因素对降解效果的影响依次为温度>pH>盐度。
Pseudomonas sp.;微生物降解菌;阿特拉津;农药残留;环境污染;降解力
阿特拉津是世界范围内应用最广泛的除草剂之一,常被用于玉米、高粱、甘蔗、茶园、果园、红松苗圃及林地等种植地去除一年生禾本科杂草和阔叶杂草[15]。阿特拉津属三嗪类化合物,施用后在环境中的矿化时间可长达57个月[6],长期施用造成严重的环境污染,在土壤、地表水和地下水体等环境介质中均有检出[711]。阿特拉津在环境中的长效残留特性,严重危害生物安全。毒理学试验表明,阿特拉津能够干扰人和动物的内分泌系统[1214],同时具有潜在的致癌和致畸特性[15]。因此,先后被许多国家和组织列为优先控制污染物或禁止使用[1618]。
为有效去除环境中阿特拉津的残留及其危害,利用降解性微生物修复阿特拉津污染的研究越来越多。1994年,菌株Pseudomonas sp.YAYA6被报道能够完全降解阿特拉津,并能够利用阿特拉津作为唯一碳源生长[19]。迄今为止,已发现大量与阿特拉津降解相关的微生物[2023]。利用微生物治理阿特拉津污染不仅避免了传统污染治理中的二次污染,且兼具经济高效等优点,发展前景好。为此,笔者以前期试验中从辽宁地区长期施用阿特拉津农田土壤中分离获得的高效阿特拉津降解菌株Pseudomonas sp.为研究对象,以阿特拉津降解率为衡量指标,采用单因素试验研究该菌在不同培养条件下对阿特拉津的降解效果,并在此基础上采用正交试验进一步优化该菌的降解条件,旨在为更好地应用降解菌株进行阿特拉津污染土壤的生物修复提供理论基础。
1 材料与方法
1.1 供试材料
1.1.1 菌株降解菌株Pseudomonas sp.,从辽宁地区长期施用阿特拉津的农田土壤中分离获得。实验室驯化培养,该菌株48h对阿特拉津的降解率可达94%,并且能以阿特拉津作为唯一氮源生长。
1.1.2 培养基无机盐培养基:K2HPO41.6g、KH2PO40.4g、MgSO40.2g、NaCl 0.1g,葡萄糖3g,阿特拉津0.1g,定容至1 000mL,121℃高压灭菌30min。
1.2 试验方法
1.2.1 不同培养条件降解菌株对阿特拉津的降解效果参照文献[24-25]的方法进行。1)培养时间。将108CFU/mL降解菌转接至阿特拉津含量100mg/L的无机盐培养基,30℃连续避光培养,测定不同培养时间(0~72h)该降解菌株对阿特拉津的降解率,每6h测定1次,3次重复。2)底物浓度。降解菌接种至含阿特拉津50mg/L、100mg/L、200mg/L、400mg/L、800mg/L和1 200mg/L的无机盐培养基,30℃培养48h测定阿特拉津降解率,3次重复。3)培养温度。考察15℃、20℃、25℃、30℃、35℃和40℃等不同培养温度对菌株降解阿特拉津能力的影响。采用1.1.2的无机盐培养基培养48h,3次重复(下同)。4)pH。考察pH 3~11对阿特拉津降解效果的影响。5)盐度。分别考察0.05%、0.1%、0.5%、1%、2%和3%培养基盐度对阿特拉津降解的影响。6)碳源。考察葡萄糖、果糖、柠檬酸钠、乳糖、蔗糖和淀粉为碳源对阿特拉津降解效果的影响。试验调整1.1.2中培养基碳源,30℃培养48h测定阿特拉津降解率,3次重复。
1.2.2 阿特拉津降解条件优化选择温度、pH和盐度3个因素,按照L9(34)正交表进行正交试验,在100mg/L阿特拉津浓度下,以阿特拉津降解率为指标,研究菌株降解阿特拉津的最佳组合条件。
1.2.3 阿特拉津提取及含量测定参照文献[26-27]的方法提取与检测。其中,阿特拉津的提取采用等体积CHCl3萃取法;阿特拉津含量检测采用高效液相色谱法,检测条件为反相C18柱(4.6mm× 250mm),流动相为甲醇和水(V/V=80/20),流速为1mL/min,柱温25℃,进样量10μL,检测波长213nm。
1.3 数据统计与分析
试验数据经DPS软件和Microsoft Office Excel 2007软件统计,并采用Duncan’s新复极差法进行差异显著性分析。
2 结果与分析
2.1 不同处理条件下降解菌对阿特拉津的降解效果
从图1可见,不同培养时间、底物浓度、温度、pH、盐度和碳源处理对降解菌株Pseudomonas sp.降解阿特拉津的影响不同。
2.1.1 培养时间在培养初期阿特拉津降解率升高较快,48h时阿特拉津降解率超过90%,之后直至72h降解率变化不明显,基本保持平稳。因此,菌株降解阿特拉津的有效时间为48h。
2.1.2 底物浓度随着底物浓度升高,阿特拉津的降解率呈下降趋势。其中,当底物浓度为50mg/L和100mg/L时,阿特拉津的降解率均较高;当底物浓度为200mg/L时,降解率降至58%;底物浓度为1 200mg/L时降解率降至10%以下。阿特拉津虽然可以为降解菌生长提供氮源,但其对菌体生长仍有生物毒性,超过一定浓度(>200mg/L)将抑制菌株生长,出现阿特拉津降解受阻,降解率下降的现象。

图1 不同培养时间、底物浓度、温度、pH、盐度和碳源处理降解菌对阿特拉津的降解效果Fig1. Degradation effect of culture time,substrate concentration,temperature,pH,salinity and carbon on Atrazine degradation of a Pseudomonas sp.strain
2.1.3 温度随着底物浓度升高,阿特拉津的降解率呈先上升后下降趋势。当温度在25~35℃时,阿特拉津的降解效果较好,表明降解菌有较强的温度适应性。低温和高温对菌株降解能力均有不同程度的影响,但低温对阿特拉津降解的影响更大,这与前人[2829]发现的很多降解菌株具有相似性。
2.1.4 pH随着pH的升高,阿特拉津降解率总体呈先上升后下降的趋势。溶液pH在6.0~9.0时,阿特拉津降解率较高,pH 7.0时降解率达最大,为96%。可见,降解菌具有较好的酸碱耐受性,但强酸和强碱环境仍不利于菌株降解能力的发挥。较强的酸碱环境对菌体细胞产生较大的渗透压力,造成细胞溶质外渗和生长发育受阻等,从而影响菌株对阿特拉津的降解效果,出现降解率下降现象。
2.1.5 盐度随着盐度升高,阿特拉津的降解率呈先上升后下降趋势。菌株降解阿特拉津的适宜盐度为0.1%~1%,在0.5%盐度时阿特拉津降解率最高,为96%;高盐(3%盐度)明显抑制阿特拉津的降解作用。当培养基中盐度高于菌体细胞时可直接引起细胞失水,导致细胞运输系统受损或使生物酶失活,影响菌体对营养物质的吸收和利用,造成阿特拉津降解率降低[27]。
2.1.6 碳源各碳源对阿特拉津降解率的影响依次为葡萄糖>果糖>柠檬酸钠>乳糖>蔗糖>淀粉。其中,葡萄糖为碳源的降解率最高,达97%;淀粉为碳源的降解率最低,为90%。表明,菌株可利用的碳源种类较宽,且利用能力较强。因此,碳源对阿特拉津降解效果的影响不大。
2.2 阿特拉津降解条件优化
从表1可见,A2B1C1、A2B2C2组合处理的降解率最高,分别达80.34%和76.26%,二者间差异不显著。进一步极差分析得出,菌株降解阿特拉津的最佳组合条件为A2B2C2(表2),即:温度30℃、pH 7.0、盐度0.5%时,阿特拉津的降解效果最好。3个因素对阿特拉津降解的影响依次为温度>pH>盐度。
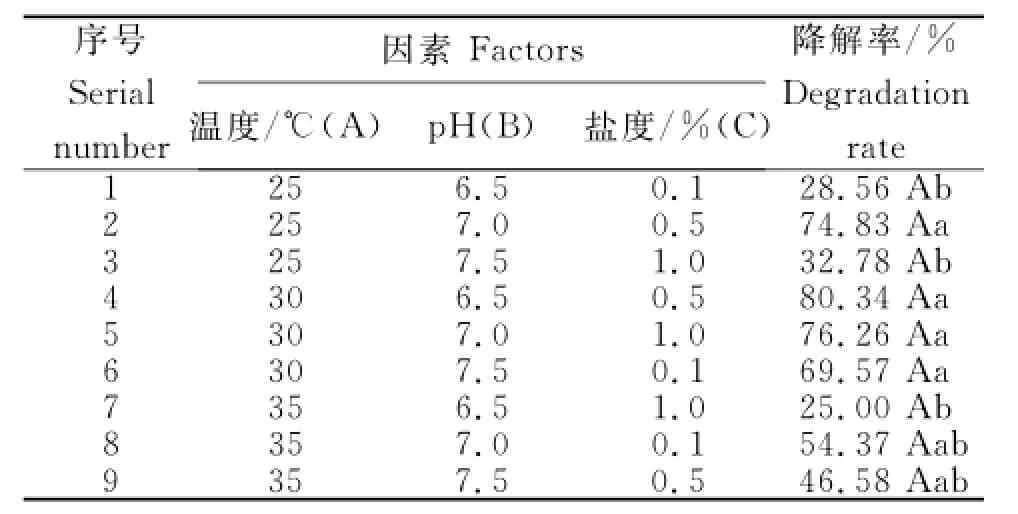
表1 阿特拉津降解条件正交试验设计及其降解率Table1 Design and degradation rate of the orthogonal test for Atrazine degradation conditions
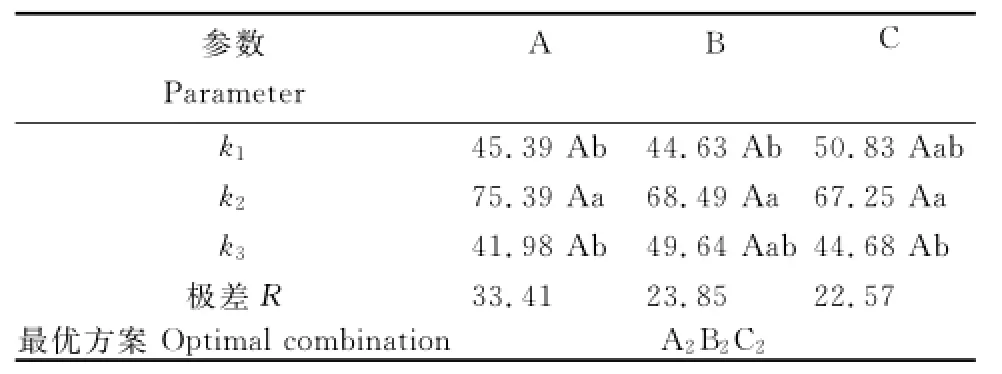
表2 阿特拉津降解条件正交试验结果的极差分析Table2 Range analysis of orthogonal test results for Atrazine degradation conditions
3 结论与讨论
该试验菌株在实验室培养48h对阿特拉津的降解率超过90%,表明,其是理想的高效降解菌株。因此,本研究丰富了阿特拉津降解的微生物资源。
单因素试验结果表明,菌株降解阿特拉津的培养条件分别为培养时间48h,底物浓度100mg/L,温度25~35℃,pH 5.0~8.0,盐度0.1%~1%。碳源利用试验表明,菌株有较宽的碳源利用谱,碳源对阿特拉津降解效果的影响不大。
正交试验结果表明,菌株降解阿特拉津的最佳组合条件为温度30℃,pH 7.0,盐度0.5%,且3个因素对降解效果的影响依次为温度>pH>盐度。
[1]SENE L,CONVERTI A,SECCHHI G A R,et al.New aspects on atrazine biodegradation[J].Brazilian Archives of Biology anDTechnology,2010,53(2):487-496.
[2]SMITH D,ALVEY S,CROWLEY D E.Cooperative catabolic pathways within an atrazine-degrading enrichment culture isolated from soil[J].Federation of European Microbiological Societies Microbiology Ecology,2005,53:265-273.
[3]周宁,孟庆娟,王荣娟,等.除草剂阿特拉津微生物降解研究进展[J].东北农业大学学报,2008,39(9):136-139.
[4]KADIAN N,GUPTA A,SATYA S,et al.Biodegradation of herbicide(atrazine)in contaminated soil using various bioprocessed materials[J].Bioresource Technology,2008,99(11):4642-4647.
[5]LIU C,HUANG X,WANG H.Start-up of a membrane bioreactor bio-augmented with genetically engineered microorganism for enhanceDTreatment of atrazine containing wastewater[J].Desalination,2008,231(1-3):12-19.
[6]李绍峰,朱静,李铁晶.阿特拉津降解菌株的分离尧鉴定及降解特性研究[J].环境科学,2012,33(9),3214-3219.
[7]YANG C,LI Y,ZHANG K,et al.Atrazine degradation by a simple consortium of Klebsiella sp.A1and Comamonas sp.A2in nitrogen enriched medium[J].Biodegradation,2010,21:97-105.
[8]WACKETT L P,SADOWSKY M J,MARTINEZ B,et al.Biodegradation of atrazine and related s-triazine-compounds:from enzymes to field studied[J].Applied Microbiology and Biotechnology,2002,58(1):39-45.
[9]王辉,赵春燕,李宝明,等.微生物降解阿特拉津的研究进展[J].土壤通报,2005,36(5):791-794.
[10]FREITASL G,SINGER H,MüLLER S R,et al.Source area effects on herbicide losses to suiface waters-A case study in the Swiss Plateau[J].Agriculture,Ecosystems&Environment,2008,128(3):177-184.
[11]吴卫东,周驰,郭晋君,等.高压液相色谱法测定地表水和饮用水中的阿特拉津[J].干旱环境监测,2011,25(1):1-3,8.
[12]HAYES T.Hermaphroditic,demasculinized frogs after exposure to the herbicide,atrazine,at low ecologically relevant doses[J].Proceedings of the National Academy of Sciences of the United States of America,2002,99:5476-5480.
[13]SAFE S.Clinical correlates of environmental endocrine disruptors[J].Trends in Endocrinology and Metabolism,2005,16(4):139-144.
[14]GU RIT I,BOCQUEN G,JAMES A,et al.Environmental risk assessment:A critical approach of the European TGD in an insitu application[J].Ecotoxicology and Environmental Safety,2008,71(1):291-300.
[15]李清波,黄国宏,王颜红.阿特拉津生态风险及其检测和修复技术研究进展[J].应用生态学报,2002,13(5):625-628.
[16]WIEGAND C,KRAUSE E,STEINBERG C,et al.Toxicokinetics of atrazine in embryos of the zebrafish(Danio rerio)[J].Ecotoxicology and Environmental Safety,2001,49:199-205.
[17]MACLENNAN PA,DELZELL E,SATHIAKUMAR N,et al.Cancer incidence among triazine herbicide manufacturing workers[J].Journal of Occupational and Environmental Medicine,2002,44:1048-1058.
[18]BETHSASS J,COLANGELO A.European Union bans atrazine,while the United States negotiates continued use[J].International Journal of Occupational and Environmental Health,2006,12:260-267.
[19]崔燕玲,刘丹丹,刘长风,等.土壤农药污染的微生物修复研究概况[J].安徽农业科学,2015(16):75-76,79.
[20]UDIKOVI -Koli N,SCOTT C,MARTIN-Laurent F.Evolution of atrazine-degrading capabilities in the environment[J].Applied Microbiology and Biotechnology,2012,96:1175-1190.
[21]CAI B,HAN Y,LIU B,et al.Isolation and characterization of an atrazine-degrading bacterium from industrial wastewater in China[J].Letters in Applied Microbiology,2003,36(5):272-276.
[22]SINGH P,SURI C R,CAMEOTR S S.Isolation of a member of Acinetobacter species involved in atrazine degradation[J].Biochemical and Biophysical Research Communications,2004,317(3):697-702.
[23]SAJJAPHAN K,SHAPIR N,WACKETT L P,et al.Arthrobacte raurescens TC1atrazine catabolism genes trzN,atzB,and atzC are linked on a160-kilobase region and are functional in Escherichia coli[J].Applied and Environmental Microbiology,2004,70(7):4402-4407.
[24]张慧芳,冉梦兰,汪倩,等.草甘膦微生物降解菌株的筛选及其生物学特性[J].贵州农业科学,2015,43(10):111-115.
[25]胡秀虹,张廷辉,汤承浩,等.阿维菌素降解菌的诱变选育及降解特性[J].贵州农业科学,2015,43(11):102-104.
[26]SOLOMON R D J,KUMAR A,SATHEEJA S V.Atrazine biodegradation efficiency,metabolite detection,anDTrzD gene expression by enrichment bacterial cultures from agricultural soil[J].Journal of Zhejiang University-SCIENCE B(Biomedicine &Biotechnology),2013,14(12):1162-1172.
[27]王静,李迎芳,裴丽娟,等.水中阿特拉津的自动固相萃取-高效液相色谱法测定[J].河南科学,2013,31(2):165-167.
[28]郑柳柳,袁博,朱希坤,等.阿特拉津降解菌株的分离、鉴定和工业废水生物处理试验[J].微生物学通报,2009,36(7):1099-1104.
[29]张庆媛,葛世杰,姜昭,等.高效阿特拉津降解菌株DNS10降解条件优化[J].环境工程学报,2013,7(3):1169-1174.
(责任编辑:王 海)
Optimization for Degradation Conditions of a Pseudomonas sp.Strain with Degrading Atrazine Ability
LIU Dandan,LIU Chang,LIU Changfeng,LI Xinyan
(Department of Environmental and Safety Engineering,Shenyang University of Chemical Technology,Shenyang,Liaoning110142,China)
The degrading Atrazine effect of a Pseudomonas sp.strain screened from the soil polluted with Atrazine for long time was studied under different culture conditions by the single-factor test anDThe degradation conditions were optimized by the orthogonal test to provide a reference for application of microbial degradation bacteria in restoration works of soil polluted with pesticides.Results:Carbon source has no obvious effect on degradation effect.The Atrazine degradation rate of the Pseudomonas sp.strain is more than 90%under the culture conditions of 48h,100mg/L substrate concentration,25~35℃,pH 5.0~8.0and 0.1%~1%salinity.The optimal condition combination of the Pseudomonas sp.strain includes 30℃,pH 7.0and 0.5%salinity anDThe influencing degree is temperature>pH>salinity.
Pseudomonas sp.;microbial degradation bacteria;Atrazine;pesticide residue;environmental pollution;degradation ability
S154.39;X172
A
1001-3601(2016)10-0421-0046-04
2016-04-14;2016-10-09修回
辽宁省博士科研启动项目“土壤阿特拉津污染的微生物修复机制与工程菌株构建”(20141086)
刘丹丹(1981-),女,讲师,博士,从事环境污染控制与修复研究。E-mail:liudandan.553@163.com

