4种花生粕蛋白的理化性质及功能特性研究
李 婷 任 虹 王丹丹 兰社益
4种花生粕蛋白的理化性质及功能特性研究
李 婷 任 虹 王丹丹 兰社益
(北京工商大学食品学院;北京市食品风味化学重点实验室;食品添加剂与配料北京高校工程研究中心,北京 100048)
以花生粕为原料,采用分级提取工艺提取花生清蛋白、球蛋白、醇溶蛋白和谷蛋白,研究4种花生粕蛋白的理化性质和功能特性。扫描电镜观察,4种花生粕蛋白的形态结构各不相同。SDS-PAGE法测定分子质量表明,清蛋白含有4种亚基,分子质量为70、40、30、25和15 ku;醇溶蛋白含有2种亚基,分子质量分别为25和15 ku;球蛋白含有5种亚基,相对分子质量分别为40、38、30、25和15 ku;谷蛋白含有4种亚基,相对分子质量分别为40、30、25和15 ku。花生清蛋白、醇溶蛋白、球蛋白、谷蛋白的等电点分别为pH 3.6、pH 5.2、pH 4.6、pH 5.0。功能性质研究表明,球蛋白的持水性最好,为1.52 mL/g,其次为谷蛋白1.10 mL/g,清蛋白和醇溶蛋白的持水性较低分别为0.49、0.14 mL/g;清蛋白的持油量相对较高为8.21 mL/g,其次为球蛋白为7.16 mL/g,谷蛋白和醇溶蛋白的持油量相对较低,分别为3.82 mL/g 和5.49 mL/g;清蛋白的乳化性和乳化稳定性相对较高,乳化能力(EC)值和乳化稳定性(ES)值分别为71.4%和83.33%,谷蛋白次之,EC和ES值分别为66.7% 和82.86%,醇溶蛋白和球蛋白相对较低,EC值分别为64.0%和62.2%,ES值分别为82.35% 和76.67%。综上,花生粕清蛋白的持油性、乳化性和乳化稳定性相对较好。
花生粕 蛋白 理化性质 功能特性
花生是一种重要的油料蛋白资源,花生粕是花生榨油后的副产物,其中蛋白质量分数为50%左右[1]。在植物蛋白资源中,花生蛋白、大豆蛋白是较理想的食用蛋白资源[2]。花生粕蛋白具有独特的风味品质,其活性和功能特性与大豆蛋白接近,但与大豆蛋白相比,花生蛋白具有易消化、所含腹胀因子少、无豆腥味等优点,这与花生粕蛋白富含的优质蛋白有关[3],药理研究发现,花生粕蛋白对糖尿病、高血压、动脉硬化和肠胃病的康复具有一定效果[4]。目前对于花生蛋白的研究有很多报道,杨晓泉等[5-6]采用硫酸铵分级沉淀结合Sephacyl S-200分子筛柱纯化了花生球蛋白、伴花生球蛋白和2S蛋白3种主要蛋白。曾卫国[7]研究了花生总蛋白的溶解性和乳化性,发现花生总蛋白的乳化性与其溶解性具有一定的相关性。但目前对花生粕中蛋白质的分类、理化性质和功能特性的系统研究较少,多数花生蛋白产品的功能特性和风味不能满足食用需求[1],因此对花生粕进行精深加工,研究花生粕中不同种类的蛋白质的理化性质和功能特性,成为国内外食品、营养等科研工作的研究热点,也为花生粕资源的高值化开发利用提供了理论依据。
本试验以花生粕为原料,采用分级提取方法提取花生清蛋白、醇溶蛋白、球蛋白和谷蛋白,提取率分别为53.59%、8.62%、9.03% 和4.85%,有关花生粕蛋白的提取方法、提取率等已在相关文献中报道[8],重点研究4种花生蛋白的理化性质和功能特性,旨在为花生粕蛋白的研究和应用提供参考。
1 材料与仪器
1.1 材料
花生粕:北京市青龙湖万春园蔬菜种植中心。
1.2 试剂
BCA试剂盒:北京博奥森生物技术有限公司;氯化钠、无水乙醇、氢氧化钠(分析纯):北京化工厂;Tris、Mops、EDTA:Amresco 公司;SDS:Sigma 公司;Mini Bis-TrisPrescost PAGE Gel:上海He Goo生物公司。
1.3 仪器
FW-400A倾斜式高速万能粉碎机:北京中兴伟业仪器有限公司;SENCO R-201旋转蒸发仪:上海申顺生物科技有限公司;ALPHA1-2LD plus冷冻干燥机:博劢行仪器有限公司;KQ-400KDB型高功率数控超声波清洗器:昆山市超声仪器有限公司;DKS22电热恒温水浴锅:上海精宏实验设备有限公司;TP-213电子天平:北京赛多利斯仪器系统有限公司;pHS-3D pH计:上海三信仪表厂;SC-3610低速离心机:科大创新股份有限公司;台式低速离心机TD5A:湖南赫西仪器装备有限公司;DYY-6C型电泳仪:北京六一仪器厂;JY-SCZ2+电泳槽:君意仪器厂。
2 试验方法
2.1 花生粕中4种蛋白的分级提取
花生粕4种蛋白的提取,采用分级提取方法[8],取花生粕采用超声水提法提取,离心得残渣1和上清液,收集上清液冷冻干燥得清蛋白样品粉末;向残渣1中加入NaCl溶液,超声提取,离心得残渣2和上清液,上清液冷冻干燥得球蛋白;向残渣2中加入乙醇溶液后,超声提取,离心得残渣3和上清液,将上清液冷冻干燥得到醇溶蛋白样品;向残渣中加入NaOH溶液,调节pH,超声提取,离心所得上清液冷冻干燥得到谷蛋白样品。
2.2 花生4种蛋白理化性质的测定
2.2.1 花生粕4种蛋白结构形态的扫描电镜观察
将处理后的4种花生蛋白样品固定在样品台上,放入扫描电镜后调节最佳视野和放大倍数进行观察。
2.2.2 花生粕4种蛋白亚基分子质量分布的测定
采用不连续聚丙烯酰胺凝胶电泳(SDS-PAGE)法,对花生粕4种蛋白亚基分子质量分布进行测定。分别将20μL蛋白Marker和样品注入样孔中电泳初始时设置电压80 V,带样品进入分离胶时电压增加到120 V。样品迁移到凝胶板底部时,停止电泳,考马斯亮蓝染色液染色30 min后,用脱色液脱色,然后将凝胶置于凝胶成像系统中拍照分析。
2.2.3 花生粕蛋白的等电点测定
用冰醋酸、磷酸盐配制不同pH的缓冲液,取5mL不同pH的缓冲液于离心管中,分别加入5 mg花生蛋白,混匀,3 000 r/min 离心10 min,在280 nm 下测定上清液吸光度,以上清液中吸光度为指标表示蛋白质含量,蛋白质含量最低时的pH值即为等电点[9]。
2.3 花生粕4种蛋白功能性质的测定
2.3.1 花生粕蛋白持水性及持油性测定[10]
分别取0.5 g样品与5 mL去离子水和大豆油混匀,静置,2 000 r/min离心30 min测定上清液体积,前后体积差值即为样品的吸水量和吸油量。持水性由每克样品吸附水的体积(mL)表示,持油性由每克样品吸附油的体积(mL)表示。
2.3.2 花生粕4种蛋白的乳化性及乳化稳定性的测定[11]
取质量浓度为50 g/L的4种花生蛋白溶液各25 mL分别与25 mL大豆油混和,高速搅拌,使其充分形成水-油乳化物,再将10 mL上述乳化物装入有刻度的离心管中,2 500 r/min离心30 min,离心后测量其乳化层体积,按照公式计算乳化能力(EC/%):
EC=(乳化层体积/离心管中液体总体积)×100%
将以上乳化样品于80℃水浴30 min,取出冷却后读出乳化层高度,按照公式计算乳化稳定性(ES/%):
ES=(仍保持乳液状的液体高度/原乳化层高度)×100%
3 结果与分析
3.1 花生粕4种蛋白理化性质测定结果
3.1.1 花生粕4种蛋白结构形态电镜扫描结果

图1 花生粕4种蛋白的1 000倍电镜扫描图
花生粕4种蛋白的扫描结果如图1所示,在1 000倍扫描电镜下观察4种蛋白质的形态结构,清蛋白呈片状,表面有突起,突起以外的位置较平滑;球蛋白呈块状,表面凹凸不平;醇溶蛋白表面极不平整,呈球状,并且紧密连接在一起;谷蛋白的表面较醇溶蛋白平整,但有较多不规则形状的凸起。4种蛋白的形态结构不同,故其所表现的性质也不相同。
3.1.2 花生粕4种蛋白的亚基分子质量分布
花生粕4种蛋白经SDS-PAGE电泳法分析所得电泳图如图2所示。
经SDS-PAGE电泳分析,花生粕4种蛋白在15~70 ku范围内都有分布,如图2所示,清蛋白分布在70、40、30、25 和15 ku,杜寅等[12]只报道了相对分子质量相对较小的15和19 ku水溶性蛋白。醇溶蛋白亚基分子质量在70、40 ku处分布很少,主要分布在25、15 ku,说明醇溶蛋白所含的亚基分子质量相对较小。球蛋白亚基分子质量主要分布在40、38、30、25、15 ku,与黄上志等[13]和封小龙[14]报道的花生球蛋白(40.5、37.5、35.5、23.5 ku)和伴花生球蛋白Ⅰ(15.5、17.0、18.0 ku)相似。谷蛋白的亚基分子质量主要分布在40、30、25 和15 ku,杜寅等[12]也报道了2种碱溶性的谷蛋白,分子质量分别为30、17 ku。这与本试验结果基本相符,但有些蛋白亚基的大小稍有差别,原因是不同溶剂提取的蛋白所含亚基分子质量不同,这可能是因为不同溶剂对蛋白破坏的程度不同[15],故清蛋白的亚基分子质量较大,70 ku处分布较其他3种蛋白多,醇溶蛋白所含亚基分子质量最小,可能是由于乙醇溶液在提取过程中对花生蛋白的破坏较大。
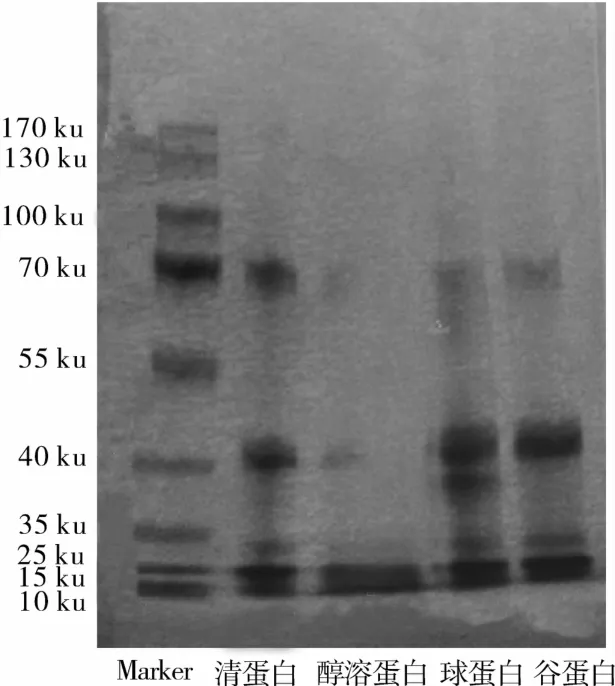
图2 花生粕4种蛋白SDS-PAGE电泳图
3.1.3 花生粕4种蛋白的等电点
由于在等电点处蛋白质间的相互作用力超过蛋白质和溶剂间的相互作用力,蛋白多肽链间的静电排斥力减弱而引起蛋白质聚集,导致蛋白溶解性降低[11],故在等电点处蛋白溶解度最小。图3是不同pH的上清液蛋白在280 nm的吸光度,pH在2~14范围内,清蛋白在pH 3.6处蛋白含量最少,随着pH不断向两端变化,蛋白含量逐渐增加,增加到pH 6后蛋白含量逐渐平稳。随着pH增大,在强碱条件下,蛋白质发生变性导致溶解性降低。由于醇溶蛋白含量少、溶解性小,故在不同pH下的变化较小,在pH 5.2处,醇溶蛋白的含量最少。球蛋白在pH 4.6处含量最低,随pH变化蛋白含量增加;谷蛋白在pH 5.0处蛋白含量最小,随pH增加蛋白含量逐渐增大,在稀碱溶液中溶解度最好。由于4种蛋白中所含的亚基个数和种类不同,各个亚基与溶剂之间有不同的相互作用力,故4种蛋白的等电点不同,花生清蛋白、醇溶蛋白、球蛋白、谷蛋白的等电点分别为pH 3.6、pH 5.2、pH 4.6、pH 5.0。

图3 不同pH下离心后上清液蛋白吸光度
3.2 花生粕4种蛋白功能性质测定结果
3.2.1 花生粕4种蛋白持水性及持油性结果比较
蛋白质较好的持水性可以使其作为添加剂在肉制品加工中保持湿度,在焙烤食品中,可以保留水分,使其柔软。蛋白质的吸油性可以促进脂肪吸收和结合,从而减少蒸煮时脂肪的损失[16],故蛋白质持水性和持油性在食品加工中尤为重要。4种花生粕蛋白持水性和持油性如图4,球蛋白和谷蛋白有较好的蛋白持水性,分别为1.52、1.10 mL/g。清蛋白水溶性较好,但持水性只有0.49 mL/g,醇溶蛋白持水性最差,仅为0.14 mL/g。由图4b 可知,清蛋白持油量最高,为8.21 mL/g;其次是球蛋白,为7.16 mL/g。在进行食品加工中,饼干类含油较高的食品,可选用持油性较好的清蛋白和球蛋白。谷蛋白和醇溶蛋白虽略低于清蛋白及球蛋白,持油量分别为3.82、5.49 mL/g。

图4 花生粕4种蛋白持水性、持油性比较
3.2.2 花生粕4种蛋白乳化性及乳化性结果比较
乳化性是食品加工中非常重要的性质和质量控制指标[17]。花生粕4种蛋白质乳化性及乳化稳定性比较如图5所示,4种蛋白的乳化性强弱依次为清蛋白(71.4%)、谷蛋白(66.7%)、醇溶蛋白(64.0%)、球蛋白(62.2%);乳化稳定性依次为清蛋白(83.33%)、谷蛋白(82.86%)、醇溶蛋白(82.35%)、球蛋白(76.67%)。花生蛋白的溶解性与乳化性有关[7],清蛋白的溶解性高,持水性低,故其乳化性和乳化稳定性最高,这与王艳玲[15]所得结果一致。
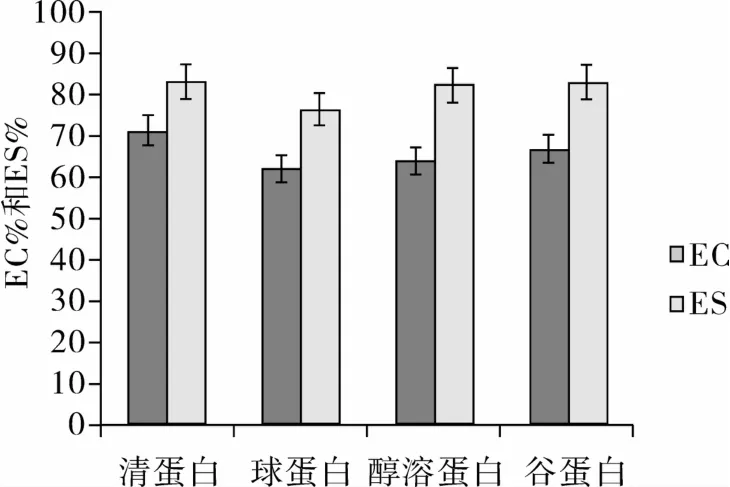
图5 花生粕4种蛋白乳化性及乳化稳定性比较
4 结论
采用分级提取工艺得到花生清蛋白、球蛋白、醇溶蛋白和谷蛋白4种蛋白,对其理化及功能特性进行研究,得出以下结论:1)通过扫描电镜观察,花生粕4种蛋白结构形态不同;2)清蛋白含5种亚基,分子质量主要为70、40、30、25、15 ku,醇溶蛋白亚基分子质量在70、40 ku处分布较少,主要分布在25、15 ku,球蛋白亚基分子质量主要分布在40、38、30、25、15 ku,谷蛋白的亚基分子质量主要分布在40、30、25、15 ku;3)花生清蛋白、醇溶蛋白、球蛋白、谷蛋白的等电点分别为pH 3.6、pH 5.2、pH 4.6、pH 5.0;4)球蛋白、谷蛋白、清蛋白、醇溶蛋白持水量分别为1.52、1.10、0.49、0.14 mL/g,持油量依次为7.16、3.82、8.21、5.49 mL/g;5)乳化性和乳化稳定性测定结果表明,清蛋白、谷蛋白、醇溶蛋白和球蛋白的乳化能力EC 值分别为71.4%、66.7%、64.0% 和62.2%,乳化稳定性ES 值分别为83.33%、82.86%、82.35%和76.67%,4种花生蛋白的乳化性质相差不大,其中,清蛋白的乳化性质最好。
[1]吴海文,王强,周素梅.花生蛋白及其功能性研究进展[J].中国油脂,2007,9(32):7-11
Wu Haiwen,Wang Qiang,Zhou Sumei.Research progress on peanut protein and its functional properties[J].China Oils and Fats,2007,9(32):7-11
[2]Ramachandran S,Singh S K,Larroche C,et al.Oil cakes and their biotechnological applications a review [J].Bioresource Technology,2007,98(10):2000-2009
[3]张维农,刘大川,胡小泓.花生蛋白产品功能特性的研究[J].中国油脂,2002,27(5):60-65
Zhang Weinong,Liu Dachuan,Hu Xiaohong.Research progress on peanut protein and its functional properties[J].China Oils and Fats,2002,27(5):60-65
[4]刘阳,邢福国.花生蛋白的开发和利用现状[J].食品科技,2008,33(12):173-176
Liu Yang,Xing Guofu.Exploitation and utility of peanut protein[J].Food Science and Technology,2008,33(12):173-176
[5]杨晓泉,陈中,赵谋明.花生蛋白的分离及部分性质研究[J].中国粮油学报,2001,16(5):25-28
Yang Xiaoquan,Chen Zhong,Zhao Mouming.Separation and characterization of peanut proteins[J].Journal of the Chinese Cereals and Oils Association,2001,16(5):25-28
[6]杨晓泉,张水华,黎茵,等.花生2S蛋白的提取分离及部分性质研究[J].华南理工大学学报:自然科学版,1998,26(4):1-5
Yang Xiaoquan,Zhang Shuihua,Li Yin,et al.Separation,purification and characterization of 2S protein from peanut(arachis hypogaea L.)seeds[J].Journal of South China University of Technology(Natural Science),1998,26(4):1-5
[7]曾卫国.花生蛋白溶解性和乳化性的研究[J].农产品加工学刊,2005,30(4):16-18
Zeng Weiguo.Study on solubility and emulsibility of peanut protein[J].Academic Periodical of Farm Products Processing,2005,30(4):16-18
[8]李婷,彭宇宁,李强,等.四种花生蛋白的分级提取及其结构的扫描电镜观察[J].食品科学技术学报,2015,33(4):35-42
Li Ting,Peng Yuning,Li Qiang,et al.Study on extraction and structure of four kinds of peanut proteins[J].Journal of Food Science and Technology,2015,33(3):35-42
[9]张水华.食品分析[M].北京:中国轻工业出版社,2004,7
Zhang Shuihua.Food analysis[M].Beijing:China Light Industry Press,2004,7
[10]葛毅强,郑如力,蔡同一.脱脂麦胚蛋白功能特性的研究[J].中国油脂,2000,25(4):53-56
Ge Yiqiang,Zheng Ruli,Cai Tongyi.Functional properties of defatted wheat germ protein[J].China Oils and Fats,2000,25(4):53-56
[11]Pearce K N,Kinsella J E.Emulsifying properties of proteins,evaluation of a turbidimetric technique [J].Journal of Agriculture and Food Chemisty,1998,26:716-723
[12]杜寅,王强,刘红芝,等.花生蛋白组成及其功能特性研究进展[J].食品科学,2012,30(1):285-289
Du Yin,Wang Qiang,Liu Hongzhi,et al.Research progress on peanut proteins and their functional properties[J].Food Science,2012,30(1):285-289
[13]黄上志,傅家瑞.花生种子的贮藏蛋白质[J].花生科技,1992(1):1-6
Huang Shangzhi,Fu Jiarui.Storage proteins of peanut seeds[J].Peanut Science and Technology,1992(1):1-6
[14]封小龙.花生蛋白的组分制备、改性及其应用研究[D].北京:中国农业科学院,2014
Feng Xiaolong.Study on the preparation,modification and application of the peanut protein fractions[D].Beijing:Chinese Academy of Agricultural Sciences,2014
[15]王艳玲.米糠中四种蛋白的提取工艺及特性研究[D].哈尔滨:东北农业大学,2013
Wang Yanling.Study of extraction technics and identity of four proteins in rice bran[D].Haerbin:Northeast Agricultural University,2013
[16]顾炜.花生分离蛋白的制备及红衣组分花生蛋白功能性质的影响[D].广州:华南理工大学,2012
Gu Wei.Study on the preparation of peanut protein isolation and effects of peanut red skin on the properties of peanut protein[D].Guangzhou:South China University of Technology,2012
[17]高金龙,莎丽娜,格日勒图.羊皮胶原蛋白乳化性欲乳化稳定性的研究[J].食品工业科技,2011,32(1):65-67
Gao Jinlong,Sha Lina,Gerelt.Study on emulsifying activity and emulsion stability of collagen from goat skin[J].Science and Technology of Food Industry,2011,32(1):65-67.
Physicochemical and Functional Properties of 4 Peanut Meal Protein
Li Ting Ren Hong Wang Dandan Lan Sheyi
(College of Food Sciences,Beijing Technology & Business University,Beijing Key Laboratory of Flavor Chemistry,Beijing Higher Institution Engineering Research Center of Food Additives and Ingredients,Beijing 100048)
4 protein fractions (albumin,globulin,prolamine and glutelin)were fractionated from peanut meal and their physicochemical and functional properties were determined.On the view of scanning electron microscope,the surface of the 4 protein fractions was different.The result showed that the subunit molecular weight of albumin was determined as70,40,30,25 and 15 ku by SDS-PAGE.The subunit molecular weight of prolamine was mainly distributed in 25 ku and 15 ku.The subunit molecular weight of globulin was determined as 40,38,30,25 and 15 ku.The electric point of peanut albumin,prolamin,globulin and glutelin were respectively pH 3.6,pH 5.2,pH 4.6,pH 5.0.The result of functional properties was that the water binding capacity of albumin,prolamine,globulin and glutelin was 0.49,0.14,1.52,1.10 mL/g.The glutelin was the best.The oil binding capacity of albumin was higher than the other protein.It was 8.21 mL/g.The oil binding capacity of globulin,glutelin and prolamine was 7.16,3.82 and 5.49 mL/g.The emulsifying property and stability of albumin were the best,and its EC and ES were 71.4%and 83.33%.The EC and ESof glutelin was 66.7%and 82.86%.The emulsifying property and stability of prolamine and globulin was lower than albumin and glutelin.The EC of prolamine and globulin was 64.0%and 62.2%,and the ESwas respectively 82.35%and 76.67%.The properties of albumin were the best,so the albumin has high value in food processing.
peanut meal,protein,physicochemical properties,functional properties
TS209
A
1003-0174(2016)11-0037-06
863计划(2007AA09Z411),北京工商大学学科与研究生教育-食品学科特色学科群建设(PXM2011-014213-113634)
2015-03-23
李婷,女,1988年出生,硕士,天然功能因子
任虹,女,1967年出生,副教授,天然功能因子及其作用靶点

