枯草杆菌漆酶重要功能位点的保守性与可变性分析
焦 晶, 杨 雪, 金兰娜, 高 键, 周 洋, 肖亚中, 张应玖,2
(1.吉林大学分子酶学工程教育部重点实验室, 2. 生命科学学院, 长春 130012;3. 安徽大学现代生物制造协同创新中心, 合肥 230601)
枯草杆菌漆酶重要功能位点的保守性与可变性分析
焦 晶1, 杨 雪1, 金兰娜1, 高 键1, 周 洋1, 肖亚中3, 张应玖1,2
(1.吉林大学分子酶学工程教育部重点实验室, 2. 生命科学学院, 长春 130012;3. 安徽大学现代生物制造协同创新中心, 合肥 230601)
在对比分析天然枯草杆菌漆酶(CAR)的一级结构与三维空间结构的基础上, 锁定了CAR的底物结合通道和铜离子结合位点, 设计并构建了CAR的4种突变体. 对比分析了野生型酶与4种突变体酶的性质及催化功能, 结果表明, 该漆酶分子中位于第二保守区的H155位点是漆酶催化所必需的, H155即使被其同义氨基酸(如Arg)替换, 也会因氧化还原电势的降低而降低漆酶的催化活力, 同时还会导致漆酶的热稳定性和酸碱稳定性降低, 以及最适pH值酸移; 位于非保守区的A158位点与I224位点的保守性对漆酶的催化是有利的, 而S210G突变增强了漆酶的稳定性与催化功能, 这可能与S210G突变增强了漆酶的底物通道上一段富含Pro片段的柔性有关. 此外, A158/R155H突变(CAHE)可能导致漆酶不耐冷, 在低温(<50 ℃)时引起酶活明显降低. 所研究的漆酶在2,2′-连氮-双(3-乙基苯并噻唑-6-磺酸)(ABTS)介体存在下, 对靛蓝类染料(如靛蓝胭脂红)和三苯甲烷类染料(如结晶紫)的脱色率均高于对偶氮类染料(如甲基红和刚果红)和蒽醌类染料(如活性亮蓝), 说明该漆酶对染料有一定的选择性.
漆酶; 结构; 催化; 枯草芽孢杆菌
漆酶(Laccase, EC 1.10.3.2) 是一类含铜的多酚氧化酶, 属于蓝色多铜氧化酶家族, 能以分子氧为电子受体, 催化酚类和芳胺类化合物彻底氧化, 副产物只有水, 因此漆酶是一种环境友好的酶[1,2]. 漆酶在生物检测[3,4]、 环境保护与治理[5,6]、 造纸与纺织工业[7]、 食品工业[8]、 木质纤维素加工处理[9,10]及生物能源[11,12]等领域被广泛应用. 天然漆酶来源广泛, 包括细菌、 真菌、 昆虫和植物等, 其中细菌漆酶因分子组成简单, 工程化容易, 发酵周期短及酶分子稳定性高等特点, 而显示出更强的应用性[13~15]. 目前发现产漆酶的细菌主要集中在芽孢杆菌属, 应用基因工程技术可以实现细菌漆酶在大肠杆菌中的高效表达. 近年来, 漆酶作为一种高效、 绿色的催化剂, 其结构与功能的研究日益受到重视[16], 以期获得应用价值较高的漆酶种[17,18]. 通过分子改造获得优良的漆酶种是一条有效的途径, 也必将带来巨大的经济效益和深远的科学意义[19].
基因库(GeneBank)中信息显示, 来自芽孢杆菌属的绝大部分漆酶均由约510个氨基酸构成, 并具有较高(>93%)的序列同源性, 因此具有相似的构象. 漆酶分子中通常含有4个铜离子, 分属于2个相对独立的含铜中心, 即单核中心及三核中心, 共同构成了漆酶的活性部位, 负责结合底物和催化底物[1,20]. 由此推测, 漆酶的含铜中心以及邻近残基的空间位阻和电荷效应会通过影响铜离子的键合状态和微环境而直接或间接地影响漆酶的催化活性.
来自枯草芽孢杆菌的漆酶CAR由513个氨基酸构成, 并与大多数细菌漆酶有96%以上的氨基酸序列同源性, 但其催化活性很低, 因此CAR可作为研究细菌漆酶结构与功能相关性的良好模型. BLAST氨基酸序列分析结果表明, 位于多数细菌漆酶第二个保守区的第155位点为His, 而在CAR中却为Arg. 进一步依据枯草芽孢杆菌漆酶的结构生物学信息, 通过同源建模获得漆酶CAR的构象(见图1). 由图1可见, A158与R155位点位于漆酶三核中心的催化区域, 2个位点相邻近, 且其侧链基团在肽链主链的同侧, 并朝向催化氧化的电子通道一侧, 其电荷效应很可能会影响漆酶的催化效率; S210与I224位点分别位于一段富含Pro片段的两端[图1(B)], 可能会影响这一肽段的柔性和空间排布, 而这一肽段以及I224位点靠近单核中心的底物通道. 针对漆酶的上述区域及位点的功能调节作用目前尚未见报道[21~23].
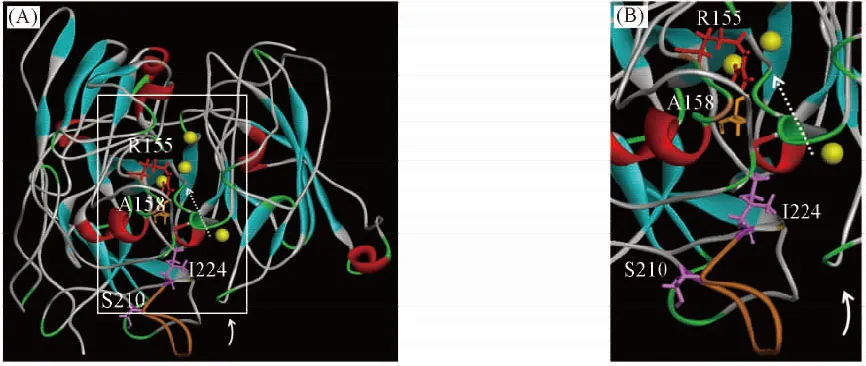
Fig.1 3D structure of laccase CAR
为了确定这些区域及位点对CAR催化效率的影响, 本文依据CAR的构象, 针对位点R155, A158, S210和I224, 设计了4种代表性突变体酶CAH(R155H), CAHE(R155H和A158E), CAHEG(R155H, A158E和S210G)和CAHEGF(R155H, A158E, S210G和I224F), 通过对比分析其性质及功能, 阐明这些区域及位点与漆酶功能的相关性, 为揭示枯草芽孢杆菌漆酶功能调节的结构基础提供一定的实验与理论依据. 本文研究结果为促进细菌漆酶更好地应用于工业环境提供了一定的信息与实验依据. 在此基础上, 再利用酶的固定化载体如壳聚糖等[24]进行优良突变体酶的固定化, 便可实现漆酶的工业化应用.
1 实验部分
1.1 试剂与仪器
2,2′-连氮-双(3-乙基苯并噻唑-6-磺酸)(ABTS)、 靛蓝胭脂红(Indigo carmine)、 结晶紫(Crystal violet)、 刚果红(Gongo red)、 甲基红(Methyl red)、 活性亮蓝(Remazol brilliant blue R, RBBR)均购自Sigma公司; 聚合酶链式反应(PCR)引物、 质粒提取试剂盒和胶回收试剂盒均购自上海生工生物工程公司; 限制性内切酶、 DNA连接酶、 Taq酶、 pfu保真酶、 蛋白酶以及DNA、 蛋白质Marker均购自日本TaKaRa公司; RNA酶(RNase)购自天根生化科技有限公司; 漆酶CAR、 重组载体pET28a-CAR、 枯草芽孢杆菌BS-CAR和大肠杆菌BL21(DE3)均为本课题组保存.
TC-25/H型PCR仪(杭州博日科技有限公司); WD-9403D型紫外分析仪(北京市六一仪器厂); DNP-9082型电热恒温培养箱(上海精宏实验设备有限公司); Parstat 2273 电化学工作站(美国Princeton Applied Research公司).
1.2 引物设计
针对漆酶点突变R155H, A158E, S210G和I224F, 应用Primer Premier 5.0软件设计引物, 并应用Oligo 6.0软件分析引物合理性, 最终确定的4对引物序列如表1所示.
1.3 突变体漆酶基因的克隆
以重组载体pET28a-CAR为模板, 使用表1所示的引物, 分别采用全质粒PCR扩增方法获得突变体漆酶基因的重组载体pET28a-CAH, pET28a-CAHE, pET28a-CAHEG和pET28a-CAHEGF, 后者分别转化E.coliBL21(DE3), 经筛选获得阳性克隆. 所获得的突变体漆酶基因由北京华大基因(BGI)科技有限公司分析确定.

Table 1 Designed primers
1.4 漆酶的诱导表达与纯化
将各种酶的工程菌于37 ℃振荡培养至OD600值为0.4~0.6后, 加入异丙基-β-D-硫代半乳糖苷(IPTG, 终浓度0.02~0.2 mmol/L)和CuSO4·5H2O(终浓度0.25 mol/L), 于16 ℃诱导目的基因表达12 h. 超声破碎收集的菌体, 收集上层清液. 对表达的目的蛋白进行亲和层析纯化, 最终获得纯度达96%以上的各种漆酶制剂.
1.5 漆酶活力的测定
以ABTS(ε420 nm=36000 L·mol-1·cm-1)为底物, 在60 ℃, pH=4.6反应体系中反应5 min后, 使用分光光度计测定反应体系的OD420 nm值, 计算漆酶的活力[25]. 反应体系: 50 μL酶液+10 μL ABTS(100 mmol/L)+50 μL CuSO4·5H2O(100 mmol/L)+100 μL 醋酸-醋酸钠缓冲液(0.2 mol/L, pH=4.6). 漆酶活力单位定义: 每分钟催化1.0 μmol底物氧化所需的酶量为一个酶活力单位(U). 所有测定均重复3次, 取平均值.
1.6 漆酶动力学参数的测定
分别以0.05, 0.1, 0.15, 0.2, 0.25, 0.5和1.0 mmol/L的ABTS为底物, 在60 ℃, pH=4.6条件下分别测定各种漆酶的反应初速度, 以Lineweaver-Burk双倒数作图法计算相应的Km和kcat值.
1.7 漆酶氧化还原电势的测定
采用循环伏安法(CV)测定各种漆酶的氧化还原电势. 使用饱和甘汞电极(25 ℃, 0.245 V)为参比电极, Pt电极为对电极, 玻碳电极为工作电极; 所有电动势均相对标准氢电极而计; 扫描速率为120 mV/s.
1.8 漆酶最适温度、 最适pH值及稳定性测定
1.8.1 最适温度测定 以ABTS为底物, 分别在pH=4.6和不同温度(20~90 ℃)下测定各种漆酶的催化活性. 所有测定均重复3次, 取平均值.
1.8.2 温度稳定性测定 分别将漆酶CAR, CAH, CAHEG和CAHEGF置于30~90 ℃的反应体系(pH=4.6)中孵育1 h, 再加入ABTS, 测定相应漆酶的催化活性. 所有测定均重复3次, 取平均值. 各种漆酶以其活力最高者计为100%.
1.8.3 最适pH值测定 以ABTS为底物, 在60 ℃条件下, 分别在柠檬酸-磷酸氢二钠缓冲液(pH=2.0~8.0)和Tris-HCl缓冲液(pH=9.0)中测定漆酶CAR, CAH, CAHEG和CAHEGF的催化活性. 所有测定均重复3次, 取平均值.
1.8.4 酸碱稳定性测定 分别将漆酶CAR, CAH, CAHEG和CAHEGF置于不同pH值的反应体系中孵育1 h, 再加入ABTS, 测定相应漆酶的催化活性. 所有测定均重复3次, 取平均值. 各种漆酶以其活力最高者计为100%.
1.9 染料脱色率的测定
以ABTS为介体, 测定了各种漆酶对表2所示5种染料的脱色率. 在60 ℃, pH=4.6的反应体系中加入染料, 分别在30, 60, 90, 120, 150和180 min 时测定最大光吸收值(A1); 同样测定相应的对照组(A0), 根据公式: Decolorization(%)=[(A0-A1)/A0]×100%计算脱色率. 所有测定均重复3次, 取平均值.

Table 2 Final concentration and maximum absorbance wavelengths of the tested dyes
1.10 漆酶三维结构同源建模
利用Discovery StudioTM分子模拟软件同源建模分析漆酶的三维结构[26]. 利用InsightⅡ软件包中的Modeler程序进行同源建模构建出漆酶的初始结构模型, 再利用NAMD软件包对漆酶的初始模型进行优化, 最后获得漆酶的三维结构模型.
2 结果与讨论
2.1 突变体酶基因克隆的表达载体构建
分别从pET28a-CotA-CAR, pET28a-CotA-CAH, pET28a-CotA-CAHE, pET28a-CotA-CAHEG和pET28a-CotA-CAHEGF转化大肠杆菌BL21(DE3)的平板上挑取单克隆, 提取质粒, 经限制酶鉴定正确后再进行DNA序列分析. 结果表明, 所获得的单克隆分别为pET28a-CAR, pET28a-CAH, pET28a-CAHE, pET28a-CAHEG和pET28a-CAHEGF阳性克隆, 所有突变体基因序列正确.
2.2 漆酶的诱导表达与纯化

Fig.2 SDS-PAGE analysis of the purified laccases
分别将漆酶CAH, CAHEG, CAHEG和CAHEGF工程菌扩大培养后, 用IPTG诱导目的蛋白的表达. 通过SDS-PAGE分析表达产物分子量均约为66000, 与理论值相符, 说明CAH, CHAE, CAHEG和CAHEGF均实现了正确表达. 表达宿主经超声破碎后离心, 收集上层清液, 再经过Ni柱亲和层析纯化, 获得纯化的突变体漆酶CAH, CAHE, CAHEG和CAHEGF, 经SDS-PAGE分析其纯度均在96%以上, 结果如图2所示.
以ABTS为底物, 测得的所有突变体酶的催化活力结果如表3所示. 可知, 与野生型漆酶CAR相比, 所有突变体酶的催化活力均有不同程度的提高, 其中突变体酶CAH的活力提高得最显著, 约提高了13倍. 这说明H155位点对漆酶的催化是必需的, 同时其它位点(A158, S210和I224)对漆酶的催化作用也有不同的影响. R155H和S210G突变可提高漆酶的催化活力, 而A158E和I224F突变有相反影响, 说明A158和I224的保守性对漆酶的催化是有利的.
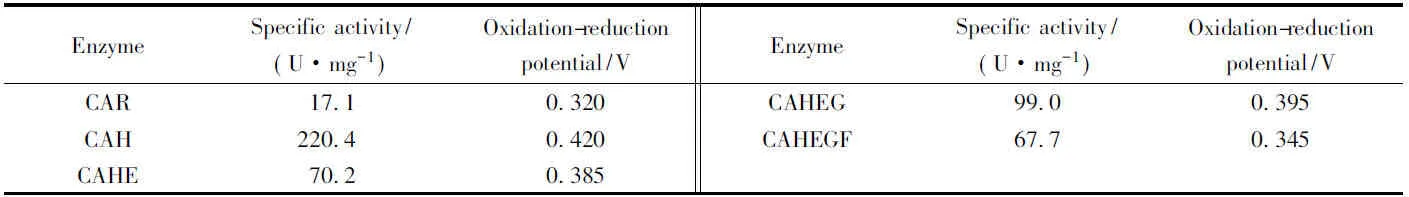
Table 3 Specific activities and oxidation-reduction potentials of the wild type and mutant laccases
通过漆酶氨基酸序列对比分析发现, 所研究的漆酶CAR中的R155位点通常是漆酶中与铜离子形成配位键的位点之一[26]. 虽然Arg与His是同义氨基酸, 但表3数据显示, CAH(R155H)的催化活力明显高于CAR, 说明该位点为His是此类漆酶功能所必需的.
2.3 漆酶氧化还原电势的分析与比较
采用循环伏安法测定了野生型酶CAR及4种突变体酶的氧化还原电势, 结果如表3所示. 可知, 4种突变体酶的氧化还原电势均高于野生型漆酶, 而且相应的变化与其活力水平呈正相关, 说明4个位点(R155, A158, S210和I224)的突变均直接影响漆酶的氧化还原电势, 且这种影响直接体现在催化功能上, 氧化还原电势的改变与其相应的催化活力的改变是统一的, 其中R155H和S210G为有益突变, 而A158E和I224F为有害突变.
2.4 漆酶动力学分析
由野生型漆酶CAR及突变体酶CAH, CAHE, CAHEG和CAHEGF的L-B双倒数曲线得出其动力学参数如表4所示. 由表4可知, 与野生型漆酶CAR相比, 4种突变体酶的动力学参数均有不同程度的改变,Km值均降低而kcat值均增高, 其中CAH的参数变化幅度最显著. 由于Km值与kcat值分别与酶的底物亲和性和催化活力呈负相关与正相关, 而比值kcat/Km代表酶的催化效率, 因此4种突变体酶的催化效率均有不同程度的提高, 其中仍以CAH提高最为明显. 显然, 这些酶的活力水平(表3)与其催化动力学参数(表4)数值变化是一致的, 其中突变体酶CAH的kcat值最大(85 s-1),Km值最小(0.10 mmol/L), 因此其效率也最高(850.0 L·s-1·mmol-1).

Table 4 Kinetic parameters of the wild type and mutant laccases
2.5 漆酶的最适温度、 最适pH值及稳定性
以ABTS为底物, 测定了野生型漆酶及突变体酶的最适温度与最适pH值, 结果显示, 野生型酶CAR以及突变体酶CAHE, CAHEG和CAHEGF的最适温度均为80 ℃, 突变体酶CAH的最适温度为70 ℃, 均属于耐热酶. 野生型酶CAR的最适pH=4.0, 说明其较适宜在弱酸性条件下应用, 而所有突变体酶的最适pH值发生了碱移, CAH, CAHEG和CAHEGF的最适pH=5.0, 而CAHE的最适pH=6.0, 说明突变体酶更适宜在近中性条件下应用. 因为在实际应用中, 用到漆酶的环境较少呈弱酸性, 因此, 与野生型酶CAR相比, 突变体酶的应用性拓宽了, 更有实用价值.

Fig.3 Thermostabilities(A) and acid-base stabilities(B) of the wild type and mutant laccases
野生型酶CAR及突变体酶的热稳定性及酸碱稳定性分析结果如图3所示. 图3(A)结果显示, 突变体酶CAH的热稳定性最高, 其它突变体酶次之, 而野生型酶CAR的热稳定性最低; 但是CAHE在50 ℃以下时热稳定性要低于CAR, 表明CAHE是一种不耐冷的突变体酶. 虽然CAH的最适温度(70 ℃)较其它酶的(80 ℃)低, 但其更耐热. 进一步分析发现, 这些漆酶在70 ℃以下时, 其活力随着孵育温度的升高(如1 h)而升高, 推测有可能在孵育过程中, 漆酶分子及其中的铜离子得到了进一步的活化. 本文的漆酶特有的催化性质与大多数酶不同, 说明该漆酶有其独特的功能调节机制. 图3(B)结果表明, 虽然所有漆酶均在pH=6.0时稳定性最好, 但突变体酶的酸碱稳定性均较野生型酶CAR高, 结合上述不同酶的最适pH值可见, 突变体酶对酸碱的耐受性拓宽了, 其中CAH的耐受性最强, 在pH=4.5~8.0范围内, 其酶活力仍保持在80%以上.
2.6 漆酶对不同染料的脱色作用
实验选取的5种染料靛蓝胭脂红(靛蓝类)、 结晶紫(三苯甲烷类)、 刚果红(偶氮类)、 甲基红(偶氮类)和活性亮蓝(蒽醌类)分属于4类染料, 在分子量、 分子形状和性质等方面略有不同. 以ABTS为介体, 测定野生型酶CAR及突体酶对这5种染料的脱色效率, 结果见图4.
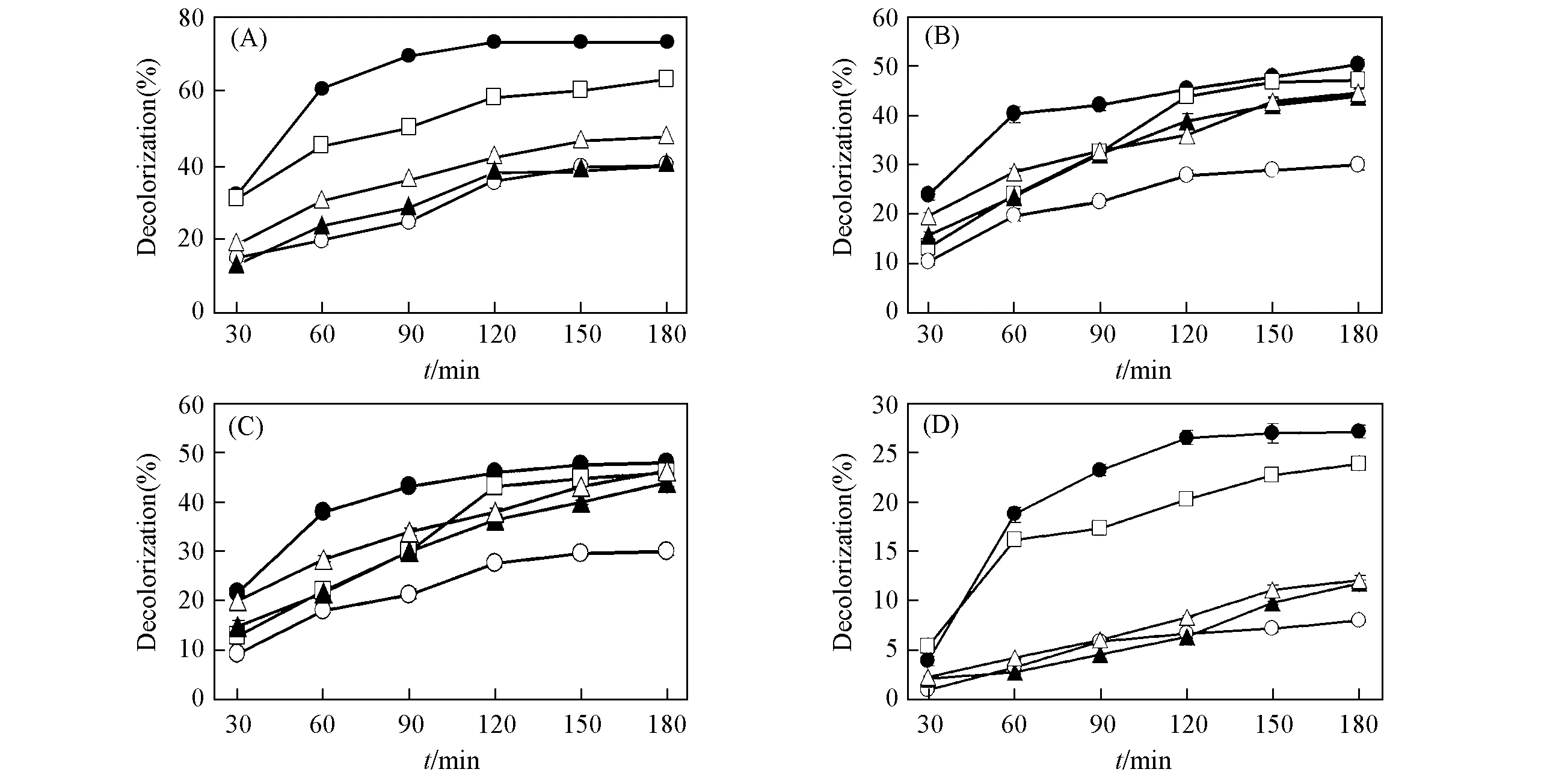
Fig.4 Decolorization of several dyes by the wild type and mutant laccases
由图4可知, 野生型酶CAR对5种染料的脱色效力均较低, 而突变体酶CAH, CAHEG和CAHEGF脱色效力均有不同程度的提高, 其中突变体酶CAH对5种染料的脱色率均最高. 显然, 脱色率与漆酶的活力水平(表3)一致. 另外, 所有的漆酶对靛蓝胭脂红(靛蓝类)和结晶紫(三苯甲烷类)的相对脱色率均较高, 而对活性亮蓝(RBBR)的相对脱色率均较低, 但不同的漆酶对刚果红和甲基红(偶氮类)的相对脱色率却有明显差别. 这说明枯草芽孢杆菌漆酶对作用的染料有一定的选择性, 其脱色效果既与染料本身有关, 也与酶的分子结构有关.
进一步比较不同漆酶对染料脱色率(图4)发现, 虽然总体上枯草芽孢杆菌漆酶对染料的脱色率与酶的活力水平呈正相关性, 但是不同的染料分子与漆酶分子底物结合通道(单核中心)的构象呈不同程度的相关性. 图4结果表明, 漆酶催化染料物质脱色的效率与染料物质的分子量不相关, 但与染料物质的分子结构(或结构类别)似乎有一定的关联. 野生型和突变体漆酶对靛蓝胭脂红的相对脱色效果均较强, 而对活性亮蓝(RBBR)的相对脱色效果均较弱. 这表明靛蓝类物质是此类漆酶较合适的底物, 而蒽醌类物质并不合适, 其它的介于二者之间. 另一方面, 漆酶底物通道的构象以及S210与I224之间肽段的柔性似乎对靛蓝类(靛蓝胭脂红)、 三苯甲烷类(结晶紫)和蒽醌类(活性亮蓝)染料的影响较小, 故相对脱色率较稳定, 但对偶氮类染料(刚果红、 甲基红)的影响较显著, CAHEG与CAHEGF催化偶氮类染料的相对脱色率明显高于CAH与CAR, 这主要是由S210G突变引起的. 显然, 枯草芽孢杆菌漆酶底物通道的构象以及S210与I224之间肽段的柔性对不同染料的特异性有不同程度的影响.
综合以上结果并结合野生型和突变体漆酶的三维空间结构(图5)发现, 漆酶CAR中的R155位点通常是漆酶中与铜离子形成配位键的位点之一[26], 虽然Arg与His是同义氨基酸, 但该位点为His是此类漆酶功能所必需的; 同时, 虽然A158位点为非保守区位点, 但因与H155位点相靠近, 而且两者的侧链基团在肽链的同侧, 该位点为小分子非极性氨基酸残基如Ala(CAH)对漆酶催化氧化的电子传递更有利, 而若突变为极性氨基酸如Glu(CAHE), 则可能因其电荷或极性严重干扰了电子传递而导致酶的活力下降(表3和图5), 因此A158的保守性对漆酶的催化性能也是必要的.
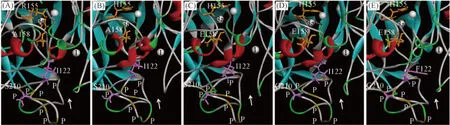
Fig.5 3D structures and the active sites of wild type and mutant laccases
S210和I224位点分别位于有机底物结合入口处的一段富Pro区的两端, 而且I224还位于底物通道的侧面, I224F突变导致Phe的侧链苯环伸向该通道, 影响有机物底物的进入和产物的释出(图5中CAHEG和CAHEGF), 故酶表现出活力下降. S210位点位于富Pro区的另一端, 会影响富Pro区肽段的柔性和空间排布, 显然S210G突变可增加富Pro区的柔性, 有利于某些底物的结合. 结果表明, S210G和I224F突变从底物亲和性方面影响漆酶的功能, 两者的效果相反, S210G突变与I224保守性对漆酶的催化是有利的. 此外, 漆酶的一个重要应用是催化染料物质氧化脱色, 其脱色率与染料的结构和性质均有关.
3 结 论
所研究的漆酶CAR中的R155H突变是此类漆酶功能所必需的, 而其邻近的A158位点的保守性对漆酶的催化也是必要的, 两者均为漆酶第二个保守区中的关键位点. 位于有机底物结合入口处的一段富Pro肽段的柔性增加有利于底物的结合, 而该肽段两端的S210G突变与I224保守性对底物的结合和漆酶的催化是有利的.
[1] Gao J., Guan K. X., Jiao J., Jiang W. Z., Zhang Y. J.,JournalofMolecularCatalysis, 2014, 28(2), 188—196(高键, 关可兴, 焦晶, 姜文洙, 张应玖. 分子催化, 2014, 28(2), 188—196)
[2] Giardina P., Sannia G.,CellMol.LifeSci.J., 2015, 72(5), 855—856
[3] Shraddha, Shekher R., Sehgal S., Kamthania M., Kumar A.,EnzymeRes., 2011, 217861
[4] Moccelini S. K., Franzoi A. C., Vieira I. C., Dupont J., Scheeren C. W.,Biosens.Bioelectron., 2011, 26(8), 3549—3554
[5] Guan Z. B., Shui Y., Song C. M., Zhang N., Cai Y. J., Liao X. R.,Environ.Sci.Pollut.Res.Int., 2015, 22(12), 9515—9523
[6] Chandra R., Chowdhary P.,Environ.Sci.ProcessesImpacts., 2015, 17(2), 326—342
[7] Virk A. P., Sharma P., Capalash N.,BiotechnologyProg., 2012, 28(1), 21—32
[8] Osma J. F., Toca-Herrera J. L., Rodríguez-Couto S.,EnzymeRes., 2010, 918761
[9] Abdel-Hamid A. M., Solbiati J. O., Cann I. K.,Adv.Appl.Microbiol., 2013, 82, 1—28
[10] Pollegioni L., Tonin F., Rosini E.,FEBSJ.Lignin-degradingEnzymes, 2015, 282(7), 1190—1213
[11] Wang J., Feng J., Jia W., Chang S., Li S., Li Y.,Biotechnol.Biofuels, 2015, 8, 145
[12] Roth S., Spiess A. C.,BioprocessBiosyst.Eng., 2015, 38(12), 2285—2313
[13] Reiss R., Ihssen J., Thöny-Meyer L.,BMCBiotechnol., 2011, 11, 9
[14] Mollania N., Khajeh K., Ranjbar B.,EnzymeMicrob.Technol., 2013, 52(6/7), 325—330
[15] Mohammadian M., Fathi-Roudsari M., Mollania N.,J.Ind.MicrobiologyBiotechnol.J., 2010, 37(8), 863—869
[16] Pezzella C., Guarino L., Piscitelli A.,CellMol.LifeSci., 2015, 72(5), 923—940
[17] Kudanga T., le Roes-Hill M.,Appl.Microbiol.Biotechnol., 2014, 98(15), 6525—6542
[18] Sitarz A. K., Mikkelsen J. D., Meyer A. S.,Crit.Rev.Biotechnol., 2016, 36(1), 70—86
[19] Gündüz Ergün B., Çalk P.,BioprocessBiosyst.Eng., 2015, 39(1), 1—36
[20] Hakulinen N., Rouvinen J.,CellMol.LifeSci., 2015, 72(5), 857—868
[21] Mate D. M., Alcalde M.,Biotechnol.Adv., 2015, 33(1), 25—40
[22] Jia H., Lee F. S., Farinas E. T.,ACSComb.Sci., 2014, 16(12), 665—669
[23] Gupta N., Farinas E. T.,ProteinEng.Des.Sel., 2010, 23(8), 679—682
[24] Xia Y., Cao H., Zhang Y. J.,Chem.J.ChineseUniversities, 2015, 36(2), 330—335(夏莹, 曹昊, 张应玖. 高等学校化学学报, 2015, 36(2), 330—335)
[25] Bourbonnais R., Paice M. G.,FEBSLett., 1990, 267(1), 99—102
[26] Enguita F. J., Martins L. O., Henriques A. O., Carrondo M. A.,J.Biol.Chem., 2003, 278(21), 19416—19425
(Ed.: P, H, V, K)
Conservative and Variability of the Important Functional Sites in a Laccase from Bacillus Subtilis†
† Supported by the Jilin Provincial Science and Technology Department Program, China(No.20140101020JC) and the Project of Collaborative Innovation Center of Modern Bio-manufacture, Anhui University, China(No.BM2014001).
JIAO Jing1, YANG Xue1, JIN Lanna1, GAO Jian1, ZHOU Yang1,XIAO Yazhong3*, ZHANG Yingjiu1,2*
(1.KeyLaboratoryforMolecularEnzymologyandEngineeringoftheMinistryofEducation,2.SchoolofLifeSciences,JilinUniversity,Changchun130012,China;3.CollaborativeInnovationCenterofModernBio-manufacture,AnhuiUniversity,Hefei230601,China)
A laccase from Bacillus subtilis has more than 96% residue identity to most other bacterial laccases, but has lower catalytic activity. Four mutant laccases were designed and their catalytic properties and functions were investigated. The results demonstrated that residue H155 was particularly essential for the catalytic activity of this laccase, and was one of the key residues in the second conserved region of laccases. Replacement of this residue reduced the oxidation-reduction potential and the catalytic activity of the laccase, and also reduces its thermal or pH stability, and caused a shift of its optimum pH from 5.0 to 4.0. Conservation of residues A158 and I224 in non-conserved region of the laccase was also advantageous for the catalysis of the laccase. A158 was conducive to the electron transport in enzymatic oxidation process, while I224 was appropriate to make the substrate into the mononuclear center of the laccase. S210G mutation enhanced the catalytic efficiency of the laccase perhaps by increasing of the flexibility of the pro-rich loop adjacent to the entrance of the substrate channel of this laccase. The laccase in this study decolorized indigo dyes such as indigo carmine more effectively than triphenylmethane dyes such as crystal violet, azo dyes such as methyl red or Congo red, and anthraquinone dyes such as Remazol Brilliant Blue R(RBBR), indicated that the laccase in this study had certain substrate selectivity. These results would provide some insights into the relationship between the structure and function of bacterial laccases.
Laccase; Structure; Catalysis; Baculus subtilis
2016-02-06.
日期: 2016-06-17.
吉林省科技厅计划项目(批准号: 20140101020JC)和安徽大学现代生物制造协同创新中心开放课题(批准号: BM2014001)资助.
10.7503/cjcu20160092
O625.75; Q554
A
联系人简介: 张应玖, 女, 博士, 教授, 博士生导师, 主要从事酶学方面的研究. E-mail: yingjiu@jlu.edu.cn
肖亚中, 男, 博士, 教授, 博士生导师, 主要从事生物催化方面的研究. E-mail: yazxiao@ahu.edu.cn

