CTR1和ATP7B在人肺腺癌细胞A549的表达及其与顺铂耐药的关系
罗霞,陈明伟
(1.新疆医科大学第一附属医院呼吸与危重症医学科,新疆 乌鲁木齐 830000;2.西安交通大学第一附属医院呼吸内科,陕西 西安 710061)
论著
CTR1和ATP7B在人肺腺癌细胞A549的表达及其与顺铂耐药的关系
罗霞1,陈明伟2
(1.新疆医科大学第一附属医院呼吸与危重症医学科,新疆 乌鲁木齐 830000;2.西安交通大学第一附属医院呼吸内科,陕西 西安 710061)
目的探讨人肺腺癌细胞株A549和肺腺癌顺铂耐药细胞株A549/DDP对顺铂的耐药机制。方法利用噻唑蓝法检测顺铂对A549/DDP及其亲代细胞株的细胞毒作用和生长曲线的影响,探讨A549/DDP细胞株凋亡敏感性的变化规律。采用Western blot检测该细胞株铜离子转运蛋白1(CTR1)、铜离子转运磷酸化ATP酶(ATP7B)及聚腺苷二磷酸-核糖聚合酶(PARP)剪切蛋白表达,分析A549细胞对顺铂耐药与CTR1、ATP7B及PARP剪切蛋白表达量的相关性。结果A549/DDP较其亲代细胞株对顺铂引起的细胞毒性和凋亡敏感性下降;较其亲代细胞株A549/DDP中ATP7B表达增加,CTR1表达降低。结论人肺腺癌细胞株A549对顺铂耐药的产生与细胞凋亡敏感性降低有关,且细胞内ATP7B表达增加,CTR1表达降低,或可作为细胞对顺铂的增敏靶点。
顺铂耐药;肺癌A549细胞株;铜转运蛋白;铜离子转运磷酸化ATP酶;铜离子转运蛋白1
肺癌是最常见的一种恶性肿瘤,每年新发肺及支气管癌达109.52万,而死亡人数达95.10万,位居各种癌症第1位。接近70%肺癌患者在确诊时已经是晚期或全身转移。顺铂已被广泛用于治疗各种恶性肿瘤化疗20多年。因其耐药的发生,导致肺癌中仅<20%的患者对化疗有效。有关顺铂耐药的机制,在前期研究中证实可能与铂类药物的转运、解毒、DNA损伤,以及凋亡蛋白的发现等有关[1-2],但具体机制尚不清楚。本研究选用人肺腺癌细胞株A549及其顺铂耐药细胞株,观察顺铂处理后,耐药细胞和亲代细胞对顺铂的细胞毒性、凋亡敏感性,以及铜离子转运磷酸化ATP酶(copper transporting phosphorylated ATPase,ATP7B)、铜离子转运蛋白1(copper transporters 1,CTR1)表达是否存在差异,进一步探讨细胞耐药机制,为临床解决化疗耐药提供实验依据。
1 材料与方法
1.1 主要试剂及细胞株
无血清细胞冻存培养基(roswell park memorial institute-1640,RPMI 1640)、胎牛血清购自杭州四季青生物工程材料有限公司,兔抗人多聚腺苷二磷酸核糖聚合酶(poly ADP-ribose polymerase,PARP)抗体、兔抗人ATP7B、CTR1抗体、鼠抗兔免疫球蛋白G(Immunoglobulin G,IgG)二抗均购自美国CST公司,人A549肺癌细胞株、A549/顺氯氨铂[cis-Dichlorodiamineplatinum(Ⅱ),DDP]均购自中国科学院上海生命科学研究院生物化学与细胞生物学研究所。
1.2 细胞培养及噻唑蓝检测细胞增殖活力
各细胞株置于含10%小牛血清的RPMI 1640完全培养液中,在37℃二氧化碳CO2体积分数为5%的饱和湿度条件下培养,取对数生长期细胞进行实验。细胞密度调整为1×104个/ml,接种于96孔细胞培养板,100μl/孔。细胞株给予不同浓度的顺铂处理(终浓度依次为0.25、0.50、1.00、2.00、4.00、8.00、16.00和32.00μg/ml),分别培养24和48 h后,加入试剂二甲基亚砜(dimethyl sulfoxide,DMSO)150μl,震荡10 min,使噻唑蓝[3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl-2-H-tetrazolium bromide,MTT]还原产物完全溶解。酶联免疫检测仪在490 nm波长处检测光密度(optical delnsity,OD)值,OD值代表活细胞数量。按以下公式计算细胞活力:细胞生存率(%)=(D实验组-D空白对照)/(D对照组-D空白对照)×100%。半数抑制浓度IC50通过SPSS 16.0统计软件计算,耐药指数(resistance index,RI)=耐药细胞株IC50/亲代细胞株IC50。
1.3 Western blot检测
收集对数生长期的各细胞株,分别用含蛋白酶抑制剂的RIPA细胞裂解液裂解,提取蛋白并定量。聚氰基丙烯酸正丁酯法测定蛋白浓度后,以30μg总蛋白量进行聚丙烯酰胺凝胶电泳,用湿法转膜至硝酸纤维素(nitrocellulose filter membrane,NC)膜上,转膜后以5%~10%脱脂牛奶室温封闭2 h,在1∶1 000浓度的PARP抗体,兔抗人ATP7B、CTR1抗体中温育16 h,三羟甲基氨基甲烷缓冲盐溶液(tris buffered saline and tween 20,TBST)洗涤6次,1∶3 000浓度的鼠抗兔IgG二抗温育1 h,洗膜,增强化学发光,显影。以目的条带与内参条带灰度值的比值计算目的蛋白的相对表达量。
1.4 统计学方法
采用SPSS 16.0统计软件进行数据分析,计量资料以均数±标准差(x±s)表示,两种细胞生长曲线差异用配对样本t检验,两组细胞不同药物浓度对生存率变化趋势分析采用单因素方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 顺铂对耐药细胞A549/DDP及其亲代细胞A549的细胞毒性作用
A549/DDP及其亲代细胞A549在分别在0.25、0.50、1.00、2.00、4.00、8.00、16.00和32.00μg/ml浓度顺铂作用48 h后,利用MTT法检测A549/DDP与亲代细胞A549的OD值,采用重复测量数据方差分析,结果:①不同浓度顺铂作用下,两组细胞生存率有差别(F=24.829,P=0.000),②不同浓度对不同细胞的生存率影响有差异(F=24.829,P=0.000)。见附表。
利用MTT法检测顺铂耐药细胞株A549/DDP与亲代细胞A549在顺铂处理48 h后细胞生存曲线,计算A549细胞株的IC50为(1.35±1.97),A549/ DDP细胞株的IC50为(13.77±3.54),RI为10.2。见图1。
2.2 A549/DDP及其亲代细胞A549的生长曲线
为观察诱导细胞耐药后,是否影响细胞的增殖速度,绘制耐药细胞A549/DDP及其亲代细胞A549的生长曲线。为比较两组细胞增殖速度是否相同,以细胞密度为1×104个/ml,接种于96孔细胞培养板(共5个),100μl/孔,每天取1块细胞培养板用MTT法测得OD值,5 d后,使用SPSS统计软件对每天测得OD值采用配对样本t检验,两组细胞OD值比较,差异无统计学意义(t=0.968,自由度=4,双侧检验P=0.339),说明顺铂诱导耐药后,细胞增殖未受影响,因此该细胞株适合用于顺铂耐药性研究。见图2。
附表A549/DDP与亲代细胞A549在不同浓度顺铂作用下OD值比较(±s)
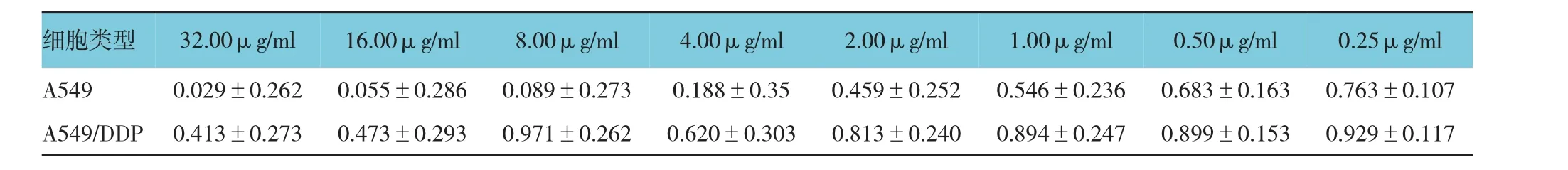
附表A549/DDP与亲代细胞A549在不同浓度顺铂作用下OD值比较(±s)
细胞类型32.00μg/ml16.00μg/ml8.00μg/ml4.00μg/ml2.00μg/ml1.00μg/ml0.50μg/ml0.25μg/ml A5490.029±0.2620.055±0.2860.089±0.2730.188±0.350.459±0.2520.546±0.2360.683±0.1630.763±0.107 A549/DDP0.413±0.2730.473±0.2930.971±0.2620.620±0.3030.813±0.2400.894±0.2470.899±0.1530.929±0.117
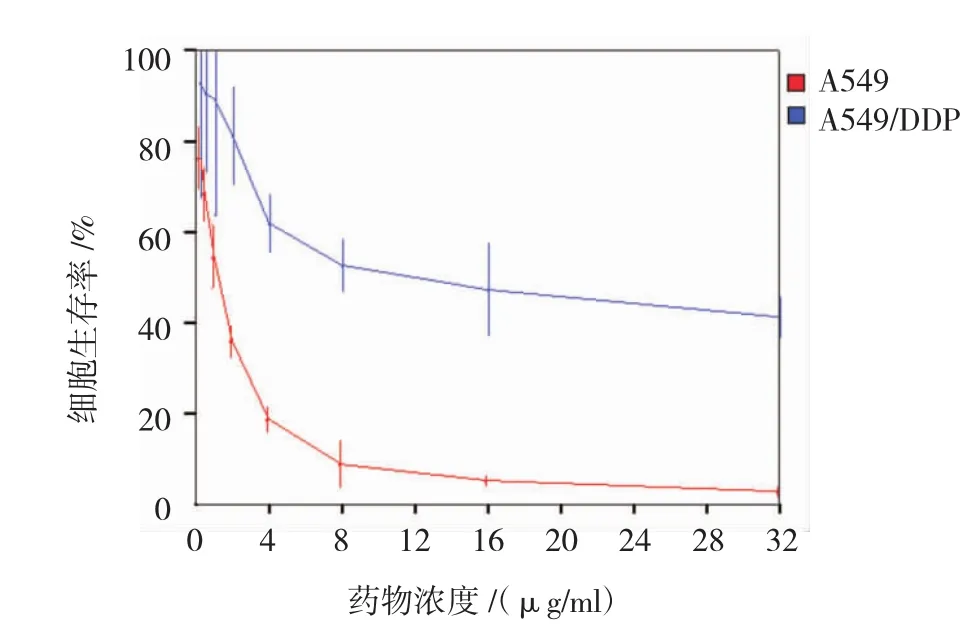
图1 顺铂耐药细胞A549/DDP与亲代细胞A549经顺铂处理48 h后细胞生存曲线

图2 顺铂耐药细胞A549/DDP与亲代细胞A549 5 d内的生长曲线
2.3顺铂对耐药细胞A549/DDP及其亲代细胞A549凋亡敏感性的影响
将两组细胞分别用不同浓度顺铂处理24 h后,提取蛋白,利用Western blot检测PARP的剪切情况。人肺腺癌亲代细胞株A549在2μg/ml顺铂浓度开始出现PARP剪切,而其顺铂耐药细胞株A549/ DDP需要增加顺铂干预浓度,在16μg/ml时开始出现PARP剪切,且剪切片段的表达逐渐增强。根据A549/DDP发生PARP剪切浓度上升(阳性结果即可说明),说明人肺腺癌耐药细胞株A549/DDP较其亲代细胞株的凋亡敏感性下降。见图3。
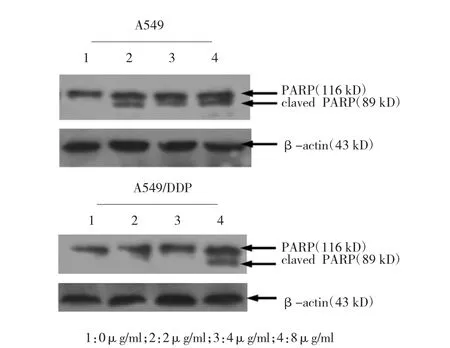
图3 顺铂处理耐药细胞株A549/DDP及其亲代细胞A549 24 h后引起的PARP剪切
2.4顺铂对耐药细胞A549/DDP及其亲代细胞A549细胞膜上ATP7B表达的影响
利用Western blot检测顺铂处理耐药细胞株A549/DDP及其亲代细胞A549经5μg/ml顺铂处理48h后ATP7B蛋白的表达水平。可见,经药物处理后,人肺腺癌耐药细胞株A549/DDP的ATP7B表达量较其亲代细胞株明显增加。见图4。

图4 顺铂处理耐药细胞株A549/DDP及其亲代细胞A549经5μg/ml顺铂处理48 h后ATP7B蛋白的表达水平
2.5顺铂对耐药细胞A549/DDP及其亲代细胞A549细胞膜上CTR1表达的影响
利用Western blot检测A549/DDP细胞株及其亲代细胞A549经15μg/ml顺铂处理5min后细胞膜CTR1蛋白的表达水平。可见,无顺铂干预时(0μg/ml),人肺腺癌耐药细胞株A549/DDP中CTR1的表达量明显少于其亲代细胞株。而利用15μg/ml顺铂干预细胞5 min后,两细胞细胞株的CTR1表达量较未行顺铂干预时并无明显变化。见图5。
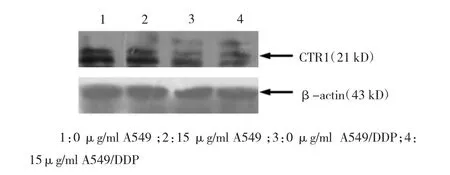
图5 顺铂处理耐药细胞株A549/DDP及其亲代细胞A549经15μg/ml顺铂处理5 min后CTR1蛋白的表达水平
3 讨论
全身化疗是目前大多数非小细胞肺癌患者的主要治疗手段,而主要的铂类方案有效率只有30%~47%。肿瘤细胞对抗癌药物耐药是临床化疗失败的主要原因。克服肿瘤细胞耐药性,提高抗癌药物疗效,是目前临床上亟需解决的问题。然而肿瘤耐药产生是一个多途径、多环节、多重机制的过程,需深入研究以阐明其机制。
文献中报道,人肺腺癌顺铂耐药细胞株对顺铂的抗性是亲代细胞的7.88倍[3],在不含药物的培养基中稳定培养几个月耐药性仍然不变化。本研究结果表明,人肺腺癌耐药细胞株A549/DDP较其亲代细胞株耐药指数为10.2,本实验中A549/DDP耐药指数稍高于文献报道数值,主要考虑与细胞实验前用低浓度顺铂(2μg/ml)稳定培养2个月左右,增加了细胞的耐药性。通过绘制A549、A549/DDP生长曲线,发现两细胞株经过顺铂药物诱导后,增殖速度未受到影响,因此认为该细胞株适合用于顺铂耐药性研究。
PARP是一种重要的DNA修复基因,在细胞凋亡的研究中,可作为凋亡的标志。目前,对于PARP的单核苷酸多态性与肿瘤的易感性研究,主要集中在生殖系肿瘤、肺癌、乳腺癌等方面。其是碱基切除修复系统通路的核心成员之一,在维持基因组稳定性及调节转录方面发挥重要作用。研究表明,PARP的高度保守的接触反应区存在的两个多态性位点与吸烟的交叉作用可明显增加肺癌的易感性[4]。PARP基因多态性与非小细胞肺癌铂类化疗敏感性相关尚无定论[5]。本实验中A549细胞株在顺铂浓度2μg/ml是即出现PARP剪切,而在A549/DDP细胞株中,顺铂浓度达16μg/ml后出现PARP剪切,说明人肺腺癌耐药细胞株A549/DDP对顺铂引起的凋亡敏感性减低。
顺铂的分子极性高,不易通过扩散方式穿过细胞膜,进入细胞。铜离子转运蛋白家族包括铜离子转运蛋白家族包括铜离子转运蛋白和铜离子转运磷酸化ATP酶。ATP7A和ATP7B是主要的铜离子泵出蛋白,两者也参与转运铂类药物出胞[6]。KOMATSU等[7]在调节铂类药物对细胞耐药性研究中首次提出,ATP7B过度表达表现出对高浓度顺铂药物的耐受性。鼠在体实验发现,ATP7B降调节使肿瘤细胞生长减少40%,且会增加顺铂的化疗效果[8]。非小细胞肺癌细胞异位种植试验证实,ATP7B表达与顺铂耐药有关,对顺铂耐药细胞中ATP7A、ATP7B基因表达水平高于敏感细胞,可以作为非小细胞癌耐药标记物[9]。YIN等[10]发现,在体外检测21例确诊肺癌的标本对铂类药的敏感性,采用逆转录聚合酶链反应监测ATP7B基因的表达,结果发现,铂类耐药的肺癌比铂类敏感的肺癌ATP7B的表达要高。以上结果表明,ATP7B可能参与铂类抗肿瘤药物的泵出。本实验中,人肺腺癌耐药细胞株A549/DDP的ATP7B表达量较其亲代细胞株增加,且随着干预药物浓度增高呈逐渐上升趋势。
CTR1是主要的铜离子摄入蛋白,研究证实其参与铂类抗肿瘤药物的摄入。LEE等[11]采用RT-PCR检测40例卵巢癌患者中CTR1和CTR2的表达水平,研究表明,CTR1的高表达是对铂类药高敏感和高生存率预后的预测因子之一,而CTR2的高表达与CTR1的低表达的卵巢癌患者对铂类药愈耐药和生存期愈短。CHEN等[12]采用免疫组织化学法研究发现,54例初次接受铂类化疗的Ⅲ期非小细胞肺癌患者中,CTR1高表达的化疗反应效果越好,PFS及OS越好,结果表明,CTR1不仅是一种独立的铂类化疗的预测因子,也是一种很好的预后因子。XU等[13-14]对282例经过≥2周期以顺铂为基础化疗的非小细胞肺癌患者通过单核苷酸多态性研究发现,CTR1基因多态性rs7851395和rs12686377与非小细胞肺癌对顺铂耐药相关,GT单体型的患者对顺铂耐药性增加,而AG单体型患者生存期较长,同时发现非小细胞患者rs10981694为C等位基因时,对顺铂的敏感性和耳毒性均增加。文献报道,哺乳动物CTR1在细胞内铂类药物积聚研究发现,CTR1促进药物的入胞作用发挥于药物吸收早期;CTR1缺失会减少早期顺铂的入胞,其药物暴露的前5 min吸收减少81%[15]。本实验中,不同浓度顺铂诱导下人肺腺癌耐药细胞株A549/DDP的CTR1的表达量较其亲代细胞株减少。但是15μg/ml顺铂干预细胞5 min后,两细胞细胞株的CTR1表达量并无明显变化。
总之,人肺腺癌耐药细胞株A549/DDP细胞中ATP7B表达较其亲代细胞增加,而CTR1表达较亲代细胞降低,从而使细胞内顺铂蓄积减少,可以推断肺癌细胞对顺铂的耐药与细胞内ATP7B表达增加,CTR1表达降低相关,同时顺铂进出细胞可能对铜离子转运通道存在一定的依赖性。铜离子转运蛋白ATP7B、CTR1与肺腺癌细胞对顺铂耐药存在明显相关性,人肺腺癌耐药细胞株A549/DDP的凋亡敏感性下降,该研究对临床克服肿瘤细胞对顺铂耐药有重要意义。
[1]LI R,LIU G Z,LUO S Y,et al.CyclinⅠpromotes cisplatin resistance via Cdk5 activation in cervical cancer[J].European Review for Medical Pharmacological Sciences,2015,19(23):4533-4541.
[2]XI Z,GUO W,TIAN C,et al.Copper binding modulates the platination of human copper chaperone Atox1 by antitumor transplatinum complexes[J].Metallomics,2014,6(3):491-497.
[3]SONG L,LI Y,LI W,et al.miR‐495 enhances the sensitivity of non-small cell lung cancer cells to platinum by modulation of copper-transporting p-type adenosine triphosphatase a(ATP7A)[J]. Journal of Cellular Biochemistry,2014,115(7):1234-1242.
[4]LI Z,GUAN W,LI M X,et al.Genetic polymorphism of DNA base-excision repair genes(APE1,OGG1 and XRCC1)and their correlation with risk of lung cancer in a Chinese population[J]. Archives of Medical Research,2011,42(3):226-234.
[5]LI D R,YANG Y Q,LING T,et al.Association of DNA repair gene polymorphisms with response to platinum-based chemotherapy in patients with non-small cell lung cancer[J].Tumor,2011, 31(4):348-353.
[6]MIGOCKA M.Copper-transporting ATPases:the evolutionarily conserved machineries for balancing copper in living systems[J]. International Union of Biochemistry Molecular Biology Life,2015, 67(10):737-745.
[7]KOMATSU M,SUMIZAWA T,MUTOH M,et al.Copper-transporting P-type adenosine triphosphatase(ATP7B)is associated with cisplatin resistance[J].Cancer Research,2000,60(5):1312-1316.
[8]KATAGIRIH,NAKAYAMAK,RAHMANMT,etal.Is ATP7B a predictive marker in patients with ovarian carcinoma treated with platinum-taxane combination chemotherapy[J].International Journal of Gynecological Cancer Official Journal of the International Gynecological Cancer Society,2013,23(1):60-64.
[9]LI Z H,QIU M Z,ZENG Z L,et al.Copper-transporting P-type adenosine triphosphatase(ATP7A)is associated with platinum-resistance in non-small cell lung cancer(NSCLC)[J].Journal of Translational Medicine,2012,10(1):1409.
[10]YIN T,ZHANG J,YAN S,et al.FATS expression is associated with cisplatin sensitivity in non small cell lung cancer[J]. Lung Cancer,2012,76(3):416-422.
[11]LEE Y Y,CHOI C H,DO I G,et al.Prognostic value of the copper transporters,CTR1 and CTR2,in patients with ovarian carcinoma receivingplatinum-based chemotherapy[J].Gynecol Oncol, 2011,122(2):361-365.
[12]CHEN H H,YAN J J,CHEN C,et al.Predictive and prognostic value of human copper transporter 1(hCtr1)in patients with stageⅢnon-small-cell lung cancer receiving first-line platinum-based doublet chemotherapy[J].Lung Cancer,2012,75(2): 228-234.
[13]XU X,DUAN L,ZHOU B,et al.Genetic polymorphism of copper transporter protein 1 is related to platinum resistance in Chinesenon-smallcelllungcarcinomapatients[J].ClinExp Pharmacol Physiol,2012,39(9):786-792.
[14]XU X,REN H,ZHOU B,et al.Prediction of copper transport protein 1(CTR1)genotype on severe cisplatin induced toxicity in non-small celllung cancer(NSCLC)patients[J].Lung Cancer, 2012,77(2):438-442.
[15]LARSON C A,BLAIR B G,SAFAEI R,et al.The role of the mammalian copper transporter 1 in the cellular accumulation of platinum-based drugs[J].Mol Pharmacol,2009,75(2):324-330.
(童颖丹 编辑)
Resistance to cisplatin is mediated by synergistic action of CTR1 and ATP7B in A549 cell linein vitro
Xia Luo1,Ming-wei Chen2
(1.Department of Respiratory and Critical Care Medicine,the First Affiliated Hospital of Xinjiang Medical University,Urumqi,Xinjiang 830000,China;2.Department of Respirology,the First Affiliated Hospital of Xi'an Jiao Tong University, Xi'an,Shannxi 710061,China)
Objective To study the mechanisms of cisplatin resistance of human lung adenocarcinoma cell lines A549 and A549/DDP.Methods Human lung adenocarcinoma A549 cells and a cisplatin-resistant derivative A549/DDP were treated with varying concentrations of cisplatin.The changes in cell growth, cytotoxicity and apoptosis were explored.Western blot was used to determine the expression of copper transporter 1(CTR1),copper transporting phosphorylated ATPase(ATP7B)and poly-ADP-ribose polymerase (PARP).The correlations of cisplatin resistance with CTR1,ATP7B and PARP were analyzed.Results Compared to the A549 cells,the A549/DDP cells were less sensitive to cisplatin-induced cytotoxicity and apoptosis.ATP7B expression increased but CTR1 expression decreased in the A549/DDP cells compared to the A 549 cells.Conclusions Our results demonstrate that reduced expression of the copper influx transporter CTR1 and overexpression of the copper efflux transporter ATP7B are responsible for the resistance of A549/ DDP cells to cisplatin.These results indicate well that the expression of ATP7B and CTR1 may provide markers for chemoresistance and chemosensitivity,respectively,to cisplatin-based chemotherapy.
cisplatin-resistance;lung adenocarcinoma cell line;copper transporters 1;copper transporting phosphorylated ATPase
10.3969/j.issn.1005-8982.2016.23.006
1005-8982(2016)23-0027-05
2016-07-06
R91
A

