伊马替尼干预中危胃间质瘤的疗效分析
冯秋生,李怡红,王晓娜,董郁红,翟东良,毕俊忠,赵连增
(河北省唐山市丰南区医院1.外一科,2.超声科,3.病理科,河北 唐山 063300;4.天津肿瘤医院胃部肿瘤科,天津 300060)
伊马替尼干预中危胃间质瘤的疗效分析
冯秋生1,李怡红2,王晓娜3,董郁红4,翟东良1,毕俊忠3,赵连增1
(河北省唐山市丰南区医院1.外一科,2.超声科,3.病理科,河北 唐山 063300;4.天津肿瘤医院胃部肿瘤科,天津 300060)
目的探讨中危胃间质瘤患者使用伊马替尼干预后患者的临床疗效,以及基质金属蛋白酶-9(MMP-9)和蛋白酶激活受体(PAR-2)水平的变化。方法选取2010年1月-2012年1年该院收治的60例中危胃间质患者分为观察组和对照组两组,所有患者进行手术治疗,对照组患者行常规护理及治疗方案进行干预,观察组患者在对照组基础上使用伊马替尼进行辅助治疗,记录患者临床疗效,并在手术前及术后1年采集患者空腹静脉血5 ml,使用酶联免疫吸附法检测血清MMP-9蛋白水平,使用一步逆转录聚合酶链反应法检测血清PAR-2 mRNA水平。结果两组1、2和3年无复发生存率比较,差异无统计学意义(P>0.05);治疗前两组患者血清MMP-9蛋白和PAR-2 mRNA水平比较,差异无统计学意义(P>0.05),治疗后两组患者血清MMP-9蛋白和PAR-2 mRNA水平比较,差异有统计学意义(P<0.05),且观察组患者血清MMP-9蛋白和PAR-2 mRNA水平低于对照组,差异有统计学意义(P<0.05)。结论使用伊马替尼对中危胃间质瘤患者进行治疗后,可显著降低患者血清MMP-9及PAR-2 mRNA表达水平,并有可能提高临床疗效。
伊马替尼;中危胃间质瘤;疗效;基质金属蛋白酶-9;蛋白酶激活受体
胃间质瘤是临床中常见的间叶源性的胃肠道肿瘤,近年来伴随分子生物学、免疫组织化学法、基因诊断及治疗技术的不断发展,胃间质瘤的临床诊断及治疗取得极大发展[1]。基质金属蛋白酶-9(matrix metalloproteinases-9,MMP-9)是人体内重要的蛋白水解酶,在人体内发挥十分重要的作用。有研究指出,MMP-9可促进肿瘤细胞生长,增强肿瘤细胞的转移和侵袭能力并参与调控新生血管生成[2]。蛋白酶激活受体(protease activated receptor 2,PAR-2)是重要的蛋白酶激活受体,其在肿瘤组织中常过量表达[3]。有研究指出,PAR-2的过量表达常与肿瘤的浸润、静脉和淋巴转呈正相关,并与肿瘤的发生、发展及患者预后密切相关[4]。伊马替尼是现阶段治疗晚期胃间质瘤的一线药物,其可显著提高患者的中位生存期。大量研究结果显示,中高危患者可选用伊马替尼进行辅助治疗,其可改善患者生存治疗、总生存率、术后无复发生存率(recurrence-free survival,RFS)[5]。但中危胃间质瘤患者选用伊马替尼干预后,患者体内MMP-9及PAR-2等蛋白酶水平变化尚无文献报道。为分析中危胃间质瘤患者采用伊马替尼后患者病情变化情况,以及伊马替尼临床疗效与MMP-9和PAR-2水平的关系,探讨伊马替尼发挥药理活性的可能机制。为此,笔者分析60例中危胃间质瘤患者临床资料,探讨患者使用伊马替尼干预后患者的临床疗效,以及MMP-9和PAR-2水平的变化。
1 资料与方法
1.1 一般资料
选取2010年1月-2012年1年本院收治的60例中危胃间质患者,将所有患者依照就诊顺序进行编号后,依照随机数表将患者分为观察组和对照组,每组30例,两组患者一般临床资料比较,差异无统计学意义(P>0.05)。所有患者及法定监护人对本组研究内容知情并签署知情同意书,并经本院伦理委员会批准。
1.2 纳入标准
参与本研究患者均符合如下标准:①患者免疫组织化学法和病理检查结果证实为胃间质瘤;②临床诊断结果符合美国国立卫生研究院(national institutes of health,NIH)危险度分级标准的中危险度[6];③患者美国东部肿瘤协作组(eastern cooperative oncology group,ECOG)体能评分<2分[7]。
1.3 排除标准
若患者符合以下任意一项标准则将其排除出本研究:①患者为哺乳期妇女或孕妇;②患者合并其他脏器严重损伤;③已出现转移病灶患者;④主动申请退出本组研究或失访。
1.4 实验方法
所有患者进行手术治疗,切除肿瘤病灶,对照组患者不接受伊马替尼辅助治疗,定期进行随访。观察组患者口服伊马替尼(江苏豪森,甲磺酸伊马替尼片)进行辅助治疗,400 mg/d,共服用1年。
1.5 观察指标
2016年3月31日为本研究的最终随访日期,患者最低随访时间为36个月,患者在治疗期间均进行血液学检查并评估疗效,每3个月使用计算机体层摄影扫描或B超检查评估患者病情,记录并统计患者不良反应发生情况。所有患者在手术前及术后1年采集患者空腹静脉血5 ml,室温静置15 min后3 000 r/min收集血清,使用酶联免疫吸附法检测血清MMP-9蛋白水平,使用一步逆转录聚合酶链反应(reverse transcription polymerase chain reaction,RTPCR)法检测血清PAR-2 mRNA水平。MMP-9酶联免疫试剂盒购买自(上海生工生物工程有限公司),首先将特异性抗体与载体相连,后加血清样本,再加入酶标抗体,在520 nm波长下测定吸光度,依照标准曲线进行定量分析。PAR-2一步RT-PCR试剂盒购买自大连自宝生生物工程有限公司,引物由上海生工生物工程有限公司合成。一步法RT-PCR严格参照试剂盒说明书进行操作。见表1。
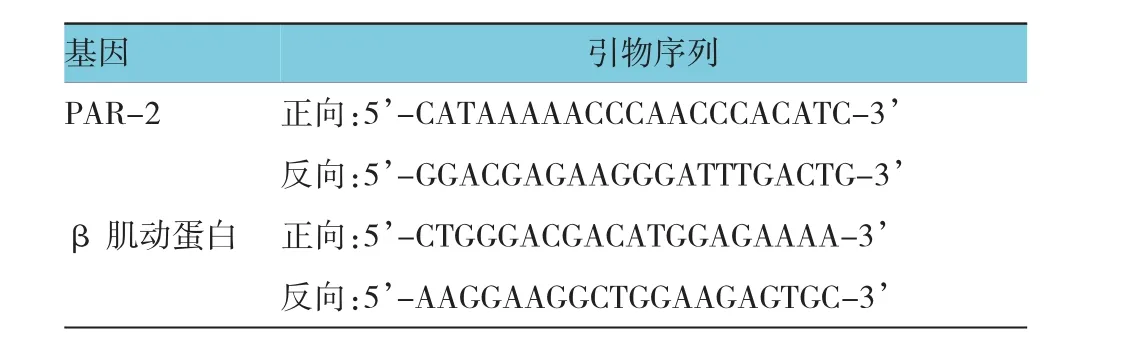
表1 RT-PCT引物表
1.6 统计学方法
采用SPSS 19.0统计软件进行数据处理,计量资料以均数±标准差(±s)表示,用t检验,Cox风险比例回归进行多因素分析,置信区间为95%,使用K-M生存分析法分析患者累积RFS,P<0.05为差异有统计学意义。
2 结果
2.1 一般资料
观察组男性19例,女性11例;年龄47~75岁,平均(58.21±6.32)岁;对照组男性21例,女性9例;年龄48~76岁,平均(59.02±6.83)岁,两组患者性别、年龄等一般资料比较,差异无统计学意义(P>0.05)。见表2。
表2两组一般资料比较(n=30)
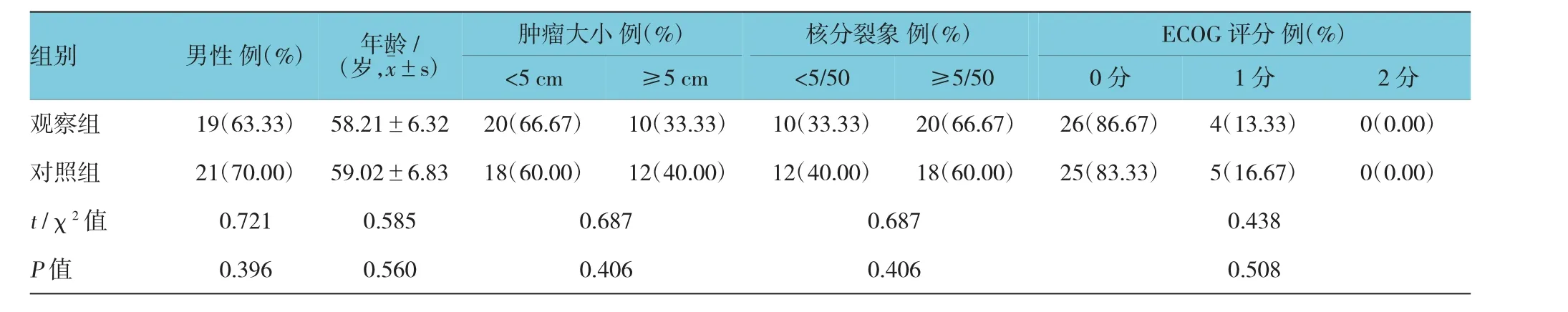
组别男性例(%)年龄/(岁,x±s)<5 cm肿瘤大小例(%)≥5 cm核分裂象例(%)<5/50≥5/50 ECOG评分例(%)0分1分2分观察组19(63.33)58.21±6.3220(66.67)10(33.33)10(33.33)20(66.67)26(86.67)4(13.33)0(0.00)对照组21(70.00)59.02±6.8318(60.00)12(40.00)12(40.00)18(60.00)25(83.33)5(16.67)0(0.00)t/χ2值0.7210.5850.6870.6870.438 P值0.3960.5600.4060.4060.508
2.2 临床疗效
本组研究中,患者中位随访时间为41个月,观察组1例患者在术后停药后15个月出现肝转移现象,对照组6例患者出现转移或复发症状。两组1、2和3年RFS比较,差异无统计学意义(P>0.05)。对患者服药与预后质量的关系进行Cox风险回归分析发现,β值0.062,β标准误0.037,β值/β标准误比值1.676,危险比为0.265(95%CI:0.024,2.763),P= 0.268。见附图。
附图两组患者生存曲线
2.3 MMP-9水平的变化
治疗前两组患者血清MMP-9蛋白水平比较,差异无统计学意义(P>0.05),治疗后两组患者血清MMP-9蛋白水平比较,差异有统计学意义(P<0.05),且对照组患者血清MMP-9蛋白水平低于对照组(P<0.05)。见表3。
表3 两组患者血清MMP-9蛋白水平比较(n=30,ng/ml±s)
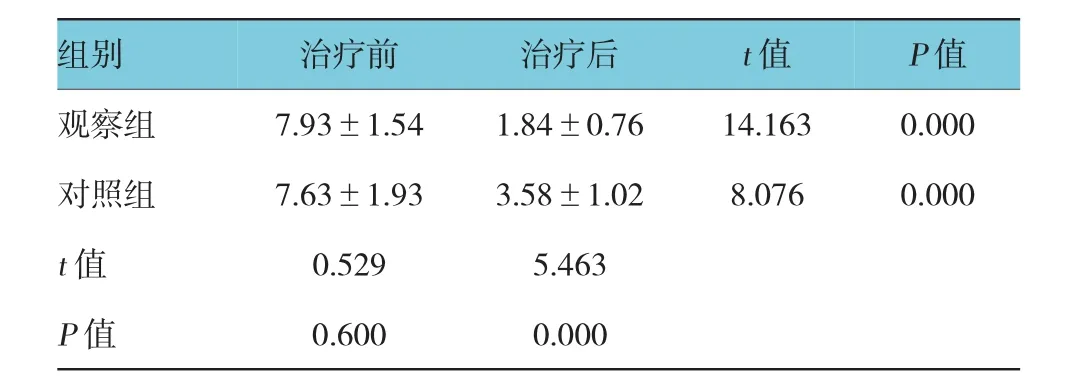
表3 两组患者血清MMP-9蛋白水平比较(n=30,ng/ml±s)
组别治疗前治疗后t值P值观察组7.93±1.541.84±0.7614.1630.000对照组7.63±1.933.58±1.028.0760.000 t值0.5295.463 P值0.6000.000
2.4 PAR-2 mRNA水平的变化
治疗前两组患者血清PAR-2 mRNA水平比较,差异无统计学意义(P>0.05),治疗后两组患者血清PAR-2 mRNA水平比较,差异有统计学意义(P<0.05),且对照组患者血清PAR-2 mRNA水平低于对照组。见表4。
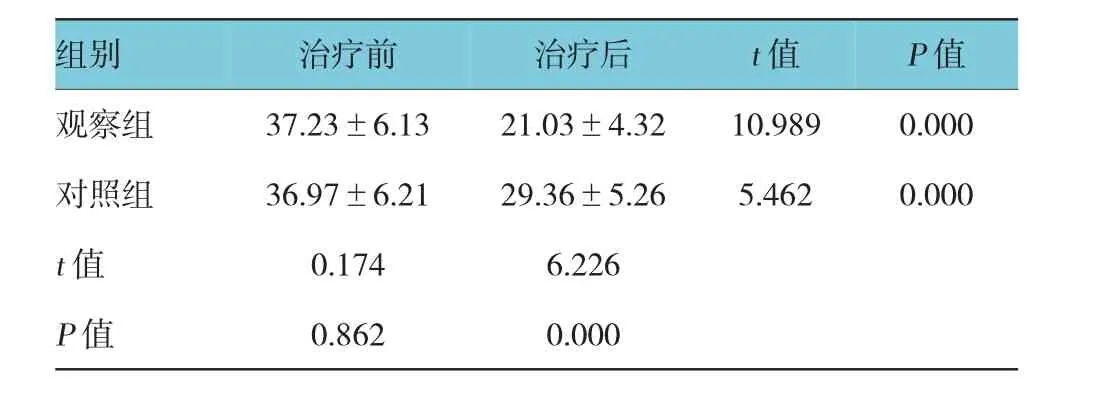
表4患者血清PAR-2 mRNA水平比较(n=30±s)
2.5 患者不良反应调查结果
观察组13例患者出现恶心呕吐,14例出现水肿,9例白细胞下降,6例出现贫血,2例患者出现皮疹,脱发及肌肉震颤各发生1例,且所有患者经门诊对症处理后明显好转。对照组中患者并未出现明显不良反应。
3 讨论
胃间质瘤是临床中较为常见的间叶源性胃肠道肿瘤,被认为是具有高度恶性倾向的肿瘤之一,肿瘤病灶区大小、有丝分裂指出、基因突变、肿瘤病灶位置、细胞构成等均与胃肠道间质瘤(gastrointestinal stromal tumors,GIST)的恶性程度密切相关。但胃间质瘤患者术后极易复发,行为不可预测性,即使将患者病灶完全切除,也有约50%患者可能出现复发甚至转移。有研究指出,完全切除高危GIST患者病灶后,使用伊马替尼辅助患者进行治疗,可有效提高患者的总生存率和RFS,因而临床中广泛使用伊马替尼辅助GIST患者进行治疗,且有患者治疗时间≥1年[8]。但依据NIH分级标准,胃部是中危GIST的高发部位,现阶段有关伊马替尼与胃间质瘤患者预后的相关性研究仍较缺乏。本研究结果显示,使用400 mg/d伊马替尼对中危胃间质瘤患者进行辅助治疗后,可有效提高患者的RFS,但Cox风险回归分析显示,两组患者比较差异无统计学意义。分析认为其可能与患者的随访时间较短相关,但K-M曲线显示,随访期间内观察组患者RFS曲线高于对照组,且伴随患者随访时间增加,两组差异更加明显,因而有待于延长随访时间进行深入研究。另外,中危度胃间质瘤的临床复发转移率较低也是可能导致两组Cox风险回归差异并不明显的因素之一。鉴于相关研究并不充分,本组随访时间较短且样本容量较小,因而有待于进一步扩大临床样本数进行验证。
MMPs是人体内重要的蛋白水解酶,其在肿瘤微环境的形成和变化过程中均起到十分重要的作用。MMP-9是MMP家族中重要成员,其分子量最大为92 kD,因而又称为92 kDⅣ型胶原。正常生理状态下,MMP-9以酶原形式存在并无生物活性,且Ⅳ型胶原是主要的降解物[9]。本研究结果显示,治疗后两组患者血清MMP-9水平虽都明显降低,但观察组患者血清MMP-9水平下降水平更为明显。当MMP-9表达量降低后,间减少细胞外基质中的Ⅳ型胶原和Ⅴ型胶原降解,调节细胞的黏附能力,减少肿瘤新生血管生成,减弱肿瘤侵袭能力增强和转移概率[10]。大多数肿瘤中MMP-9呈过量表达状态,其在肿瘤的浸润及转移过程中发挥十分重要作用[11-12]。但本研究结果提示,使用伊马替尼对中危胃间质瘤患者治疗后,可有效控制患者血清MMP-9水平,降低患者体内MMP-9过量表达状态,有利于控制患者肿瘤的复发和转移,提高患者治疗效果,延长患者生存时间,且伴随时间延长该优势可能更为明显。
在诸多恶性肿瘤中,PAR-2常呈现异常高表达转移,且肿瘤的发生、发展及预后与PAR-2密切相关。大量研究结果证实,PAR-2可通过促进细胞黏附、加速细胞增殖和细胞外基质降解、增强血管迁移和促进血管新生等途径有诱使肿瘤的发生、发展、侵袭与转移[13]。本研究结果显示,与MMP-9蛋白表达水平相似,两组患者在治疗后血清PAR-2 mRNA水平均降低,但观察组患者血清PAR-2 mRNA水平下降更为明显。伴随患者NIH分级程度提高,PAR-2表达水平也随之上调,且黏膜受侵情况与PAR-2水平密切相关[14-15]。本研究结果显示,伊马替尼可有效降低PAR-2的异常高表达状态,抑制肿瘤的增殖、黏附及运动能力,降低胃间质瘤的侵袭和转移概率。本实验结果提示,伊马替尼可有效降低患者血清PAR-2的表达,降低细胞黏附能力,抑制细胞增殖,有利于患者预后。通过本研究可以发现,中危胃间质瘤患者采用伊马替尼进行治疗时,可有效提高患者临床治疗效果。本实验对伊马替尼的疗效进行深入分析发现,患者血清MMP-9和PAR-2水平也出现显著变化,分析认为患者血清MMP-9与PAR-2的变化是伊马替尼改善中危胃间质瘤患者疗效和预后质量的重要途径。
综上所述,使用伊马替尼对中危胃间质瘤患者进行治疗后,可显著降低患者血清MMP-9和PAR-2 mRNA表达水平,并有可能提高临床疗效。但本组临床样本数较少,且随访时间较短有待于后续深入研究探讨。
[1]HECHTMAN J F,DEMATTEO R,NAFA K,et al.Additional primary malignancies in patients with gastrointestinal stromal tumor(GIST):Aclinicopathologicstudyof260patientswith molecular analysis and review of the literature[J].Annals of Surgical Oncology,2015,22(8):2633-2639.
[2]CANDIDO S,MALAPONTE G,SALEMI R,et al.MMP-9 as a marker of response to treatment with B-Raf inhibitors in cutaneous melanoma[J].Cancer Research,2015,75(15 Suppl):4304.
[3]AZUMA M,YOSHIMURA F,TANIKAWA S,et al.Factor xa inhibition by rivaroxaban attenuates cardiac remodeling due to hypoxic stress via par-2/erk/nf-κb signaling pathway[J].Journal of the American College of Cardiology,2016,67(13S):2238.
[4]DRIESBAUGH K H,BUZZA M S,MARTIN E W,et al.Prote-olytic activation of the protease-activated receptor(PAR)-2 by the glycosylphosphatidylinositol-anchored serine protease testisin[J]. Journal of Biological Chemistry,2015,290(6):3529-3541.
[5]杨弘鑫,陈海宁,张波,等.伊马替尼治疗中危胃间质瘤效果及预后临床分析[J].中华医学杂志,2013,93(16):1230-1233.
[6]JOENSUU H.Risk stratification of patients diagnosed with gastrointestinal stromal tumor[J].Human Pathology,2008,39(10): 1411-1419.
[7]VON ROENN J H,CLEELAND C S,GONIN R,et al.Physician attitudes and practice in cancer pain management:a survey from the easterncooperative oncologygroup[J].AnnalsofInternal Medicine,1993,119(2):121-126.
[8]毕新宇,黄振,王健,等.90例老年胃间质瘤患者手术治疗及预后分析[J].医学研究杂志,2013,42(6):45-48.
[9]ROINE I,PELKONEN T,LAUHIO A,et al.Changes in MMP-9 and TIMP-1 concentrations in cerebrospinal fluid after 1 week of treatment of childhood bacterial meningitis[J].Journal of Clinical Microbiology,2015,53(7):2340-2342.
[10]DAYER C,STAMENKOVIC I.Recruitment of matrix metalloproteinase-9(MMP-9)to the fibroblast cell surface by lysyl hydroxylase3(LH3)triggerstransforminggrowthfactor-β (TGF-β)activation and fibroblast differentiation[J].Journal of Biological Chemistry,2015,290(22):13763-13778.
[11]CHIA-LAN T,CHEN W C,HSIEH H L,et al.Erratum to: TNF-α induces MMP-9 expression and soluble ICAM-1 release via TRAF2,c-Src,MAPKs and NF-κB in osteoblastlike MC3T3-E1 cells[J].Journal of Biomedical Science,2015, 22(1):20.
[12]KEUL P,HEUSCH G,LEVKAU B.Sphingosine-1-phosphate (S1P)inhibitsTNFA-inducedMMP-9expression(TIME) through S1P2-mediated activation of PTEN[J].Atherosclerosis, 2015,241(1):e76-e77.
[13]SALES K U,FRIIS S,KONKEL J E,et al.Non-hematopoietic PAR-2 is essential for matriptase-driven pre-malignant progression and potentiation of ras-mediated squamous cell carcinogenesis[J].Oncogene,2015,34(3):346-356.
[14]KIM J Y,KIM D S,SOHN H,et al.PAR-2 is involved in melanogenesis by mediating stem cell factor production in keratinocytes[J].Experimental Dermatology,2016,25(6):487-489.
[15]HE R Q,TANG X F,ZHANG B L,et al.Protease-activated receptor 1 and 2 contribute to angiotensinⅡ-induced activation of adventitial fibroblasts from rat aorta[J].Biochemical and Biophysical Research Communications,2016,473(2):517-523.
(童颖丹 编辑)
Efficacy of Imatinib in treatment of gastric stromal tumors
Qiu-sheng Feng1,Yi-hong Li2,Xiao-na Wang3,Yu-hong Dong4, Dong-liang Zhai1,Jun-zhong Bi3,Lian-zeng Zhao1
(1.Department of General Surgery;2.Department of Ultrasonography;3.Department of Pathology,Fengnan District Hospital,Tangshan,Hebei 063300,China;4.Department of Stomach Cancer,Tianjin Cancer Hospital,Tianjin 300060,China)
Objective To investigate the clinical efficacy of Imatinib in patients with intermediate-risk gastric stromal tumor and the changes of matrix metalloproteinase 9(MMP-9)and protease activated receptor 2(PAR-2)levels.Methods Sixty patients with intermediate-risk gastric stromal tumor treated in our hospital from Jan.2010 to Jan.2012 were divided into observation group and control group.All the patients received surgical treatment.The control group had routine nursing and treatment intervention,while the observation group had adjuvant therapy with Imatinib in addition to the treatment of the control group.The clinical efficacy was recorded.Fasting venous blood(5 ml)was collected from the patients before operation and 1 year after surgery.Enzyme-linked immunosorbent assay was used for the detection of serum MMP-9 protein level. One-step RT-PCR was used to detect serum PAR-2 mRNA level.Results The differences of 1-year,2-year and 3-yearrecurrence-free survival(RFS)were not significant between the two groups(P>0.05).Before treatment serum MMP-9 protein or PAR-2 mRNA level had no significant difference between the two groups (P>0.05).After treatment,the serum MMP-9 protein and PAR-2 mRNA levels of the observation group were significantly lower than those of the control group(P<0.05).Conclusions The use of Imatinib in the treatment of intermediate-risk gastric stromal tumor can significantly reduce the serum levels of MMP-9 proteinand PAR-2 mRNA expression,and may improve the clinical efficacy.
Imatinib;intermediate-risk gastric stromal tumor;therapeutic effect;matrix metalloproteinases 9;protease activated receptor 2
R735.2
B
10.3969/j.issn.1005-8982.2016.23.026
1005-8982(2016)23-0123-05
2016-07-05

