增强子结合蛋白同源蛋白在糖尿病大鼠膀胱内质网应激中的作用
池俊杰,王东文,原小斌,王 东
(山西医科大学:1.第一临床医学院;2.第一医院泌尿外科,山西太原 030001)
·基础研究·
增强子结合蛋白同源蛋白在糖尿病大鼠膀胱内质网应激中的作用
池俊杰1,王东文2,原小斌1,王 东1
(山西医科大学:1.第一临床医学院;2.第一医院泌尿外科,山西太原 030001)
目的 观察增强子结合蛋白同源蛋白(CHOP)在糖尿病大鼠DSM细胞内质网应激中的表达变化,探讨内质网应激与糖尿病膀胱的关系。 方法 通过注射链脲菌素诱导1型糖尿病大鼠模型,于不同的时点(造模成功后4、 8、12、16周),电镜下观察内质网超微结构,应用TUNEL技术检测糖尿病大鼠膀胱逼尿肌细胞的凋亡水平,RT-PCR技术和Western-blotting技术分别测定DSM细胞内质网应激标志性因子CHOP mRNA和蛋白的表达水平。结果 电镜下内质网肿胀、融合,逼尿肌细胞核变形;逼尿肌细胞凋亡水平、CHOP mRNA和蛋白水平随着时间的延长明显升高。结论 内质网应激参与了糖尿病大鼠DSM细胞凋亡过程,CHOP与糖尿病膀胱病程进展呈正相关。
糖尿病膀胱;逼尿肌;内质网应激;CHOP
糖尿病是目前全世界范围内最常见的一种慢性代谢性疾病[1],其可以影响多个器官功能。糖尿病膀胱(diabetes cystopathy, DCP)作为糖尿病在泌尿系统主要的并发症,严重影响人们的生活质量,研究显示,DCP在糖尿病患者中的合并率高达80%以上[2]。DCP主要特点为伴随糖尿病病程出现的膀胱感觉及收缩功能的进行性下降。
内质网(endoplasmic reticulum,ER)是真核细胞中合成和折叠分泌蛋白所必需的细胞器,参与细胞的生理及病理过程,对细胞正常生理功能的发挥起着重要作用[3-4]。当细胞受到如钙失衡、病毒感染、pH变化等不利环境的影响,内质网网腔中堆积大量未折叠蛋白或错误折叠蛋白,致使其平衡紊乱,干扰蛋白质折叠过程,引发内质网应激(endoplasmic reticulum stress,ERS)[5]。在ERS发生时,通过质量控制系统,上调内质网应激分子伴侣和相关的蛋白质基因表达和降解折叠蛋白起作用的机制称为未折叠蛋白反应(unfolded protein response,UPR)。在ERS早期阶段,UPR修复受损细胞,但长期持续的ERS超过UPR的调节能力时,内质网严重受损,ERS启动凋亡信号[6-7],诱导细胞凋亡。增强子结合蛋白同源蛋(CCAAT / enhancer-binding protein homologous protein,CHOP)(GADD153)是内质网应激诱导凋亡信号下游通路中的一个关键因子。
ERS及其诱导的凋亡已在多种糖尿病并发症中发挥了重要作用[8-9],但其是否参与了糖尿病膀胱的发病过程,及其在DCP发病过程中起什么作用,仍不清楚。由于DCP发生发展过程伴随着逼尿肌细胞凋亡水平显著升高[10],我们推测ERS在DCP病变过程中可能也发挥了一定作用,本研究主要观察ERS凋亡通路中特异性因子CHOP的表达变化以探讨他们之间的关系。
1 材料与方法
1.1实验动物 健康成年雌性Sprague-Dawley(SD)大鼠45只,由山西医科大学动物实验中心提供,无特定病原体级,体质量220~250 g。
1.2 主要试剂 链脲佐菌素(streptozocin,STZ)购自美国Santa Cruz公司上海分公司。TUNEL相关试剂盒购自武汉博士德公司。
1.3 分组与模型制备 经过1周适应性饲养后,将45只SD大鼠随机分为5组,每组9只,1组作为正常对照组,其余4组作为实验组,分别设为4周组、8周组、12周组和16周组。
实验组以50 mg/kg的剂量腹腔注射STZ,对照组以同等剂量生理盐水行腹腔注射。注射后72 h尾静脉采血测定血糖浓度,以血糖浓度>300 mg/dL(即16.7 mmol/L)为符合1型糖尿病大鼠成模标准。
1.4 内质网超微结构观察 对照组、4、8、12、16周组大鼠成模后,分别于3 d、4、8、12、16周行腹腔麻醉后,切除膀胱组织,去除黏膜,将其分成4份,1份样本放在2.5%戊二醛溶液中硬化,1%锇酸固定,经梯度乙醇脱水,将样本切割成400~600 nm的薄片,1%醋酸双氧铀染色后透色电子显微镜观察(×20 000),其余3份,液氮冰冻后-80 ℃保存。
1.5 检测DSM细胞凋亡水平 将样本用4%中性甲醛固定,石蜡包埋切片。切片脱蜡,放置于20 mg/mL蛋白酶K缓冲液中。加入末端脱氧核苷转移酶(TDT酶)缓冲液(含生物素、TDT酶及缓冲液),终止反应,Tris-HCl缓冲液(TBS)液清洗,置于联苯二胺(DAB)底物溶液,苏木素染色,在400倍焦距下随机观察3个不同视野,计算DSM细胞凋亡率[11]。
1.6 RT-PCR检测CHOP mRNA表达水平 用 Trizol试剂提取总RNA。CHOP引物为F5′CGGAACCTGAGGAGAGAGTG3′,R5′CGTTTCCTGGGGATGAGATA3′,扩增条带219 bp,β-actin引物F5′GTCAGGTCATCACTATCGGCAAT3′,R5′AGAGGTCTTTACGGATGTCAACGT3′,扩增条带147 bp。PCR反应条件:94 ℃,10 min;94 ℃,15 s,60 ℃,60 s,共45个循环。逆转录及扩增反应完成后读取数据,取相对定量值统计结果。
1.7 Western-blotting检测CHOP蛋白表达水平 样本中加入RIPA提取总蛋白,在10%SDS聚丙烯酰胺凝胶中以200 mA电流转膜2 h,溶液封闭后,加(1∶2 000稀释的CHOP) 一抗过夜,TBST洗涤后加二抗孵育,再次洗涤后通过ECL显影检测,以β-actin作为内参,吸光度通过凝胶成像系统处理量化,灰度比值表示。
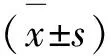
2 结 果
2.1 大鼠DSM内质网超微结构变化 对照组:大鼠DSM细胞呈类圆柱形,包膜完整,肌浆网呈小管状,内质网呈层叠管状样结构,整齐排列,浆膜极少见或无核糖小体附着。实验组:逼尿肌细胞和内质网分散在逼尿肌细胞核周围,可见不同程度肿胀的内质网,层叠管状样结构改变甚至消失,呈空泡样结构,浆膜附着核糖体逐渐增多。4周组见轻度肿胀内质网,浆膜上附着少量核糖小体。8周组内质网肿胀程度明显。12周组逼尿肌细胞核出现扭曲、固缩,其内可见深染色颗粒,肿胀的内质网明显融合,呈不规则囊泡,有脱颗粒表现。16周组逼尿肌细胞核扭曲甚至塌陷,内质网呈不规则巨型空泡样结构(图1)。
2.2 DSM细胞凋亡形态及凋亡水平 对照组:凋亡DSM细胞少见,均匀分布,细胞间结构紧密,细胞核染色浅,呈淡蓝色。实验4周组逼尿肌凋亡细胞增多,细胞核染色加深。8周组逼尿肌凋亡细胞大小不一,排列明显紊乱,细胞间可见明显纤维结缔组织增生,12周组可见固缩细胞核,呈褐色。16周组固缩核数量明显增多,颜色进一步加深,呈黑褐色(图2)。
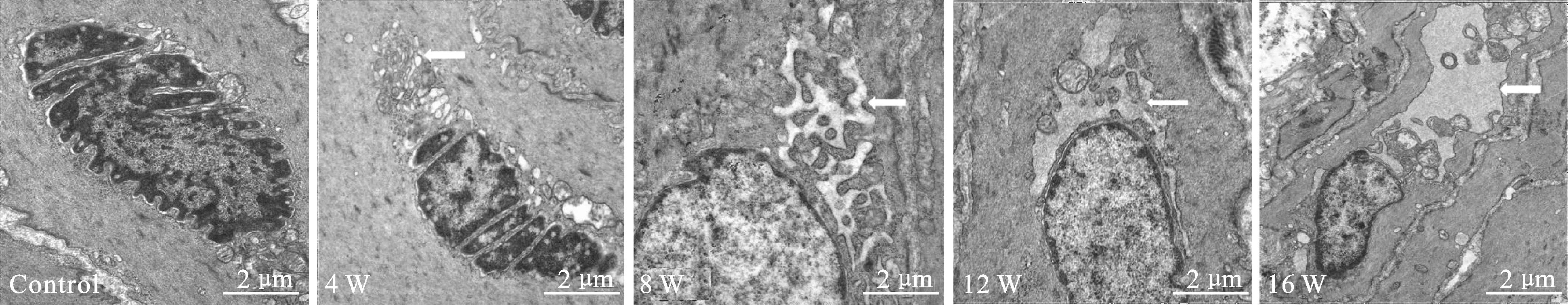
图1 电镜下各组内质网超微结构
各图依次为对照组、4周组、8周组、12周组、16周组;Control组:对照组;W:周。
在逼尿肌细胞凋亡率的比较中,4周组(17.9±2.0)%表达高于对照组(5.8±0.5)%,比较差异有统计学意义(P<0.05);8周组(27.5±3.9)%明显高于对照组及4周组,有显著性统计学差异(P<0.01);12周组(55.2±6.6)%表达高于对照组、4周组及8周组,比较差异有统计学意义(P<0.05);16周组(67.4±6.0)%表达水平最高(P<0.05)。
图2 各组细胞凋亡情况
A、B、C、D、E:分别为对照组、4周、8周、12周、16周组凋亡细胞表达;F:各组DSM细胞凋亡率的变化(与对照组比较,P<0.05);Control组:对照组;W:周。
2.3 RT-PCR实验 大鼠DSM细胞CHOP mRNA表达水平4周组(1.83±0.33)较对照组(1.03±0.27)增加(P<0.01);8周组(4.10±0.94)表达明显高于对照组及4周组,有显著性统计学差异(P<0.01);12周组mRNA表达(5.04±0.58)高于对照组、4周组及8周组,比较差异有统计学意义(P<0.05);16周组(5.61±0.76)表达水平最高(P<0.05,图3)。

图3 RT-PCR检测CHOP mRNA的表达水平
2.4 Western-blotting蛋白印迹实验 Western-blotting蛋白印迹图显示各组蛋白条带随时间的递增而增粗(图4)。相对灰度值显示,大鼠DSM细胞CHOP蛋白表达水平4周组(0.73±0.06)明显高于对照组(0.32±0.04),有显著性统计学差异(P<0.01);8周组(0.97±0.04)表达高于对照组及4周组,比较差异均有统计学意义(P<0.01);12周组(1.06±0.06)mRNA表达高于对照组、4周组及8周组,有显著性统计学差异(P<0.01);16周组(1.12±0.08)表达水平最高(P<0.05)(图5)。
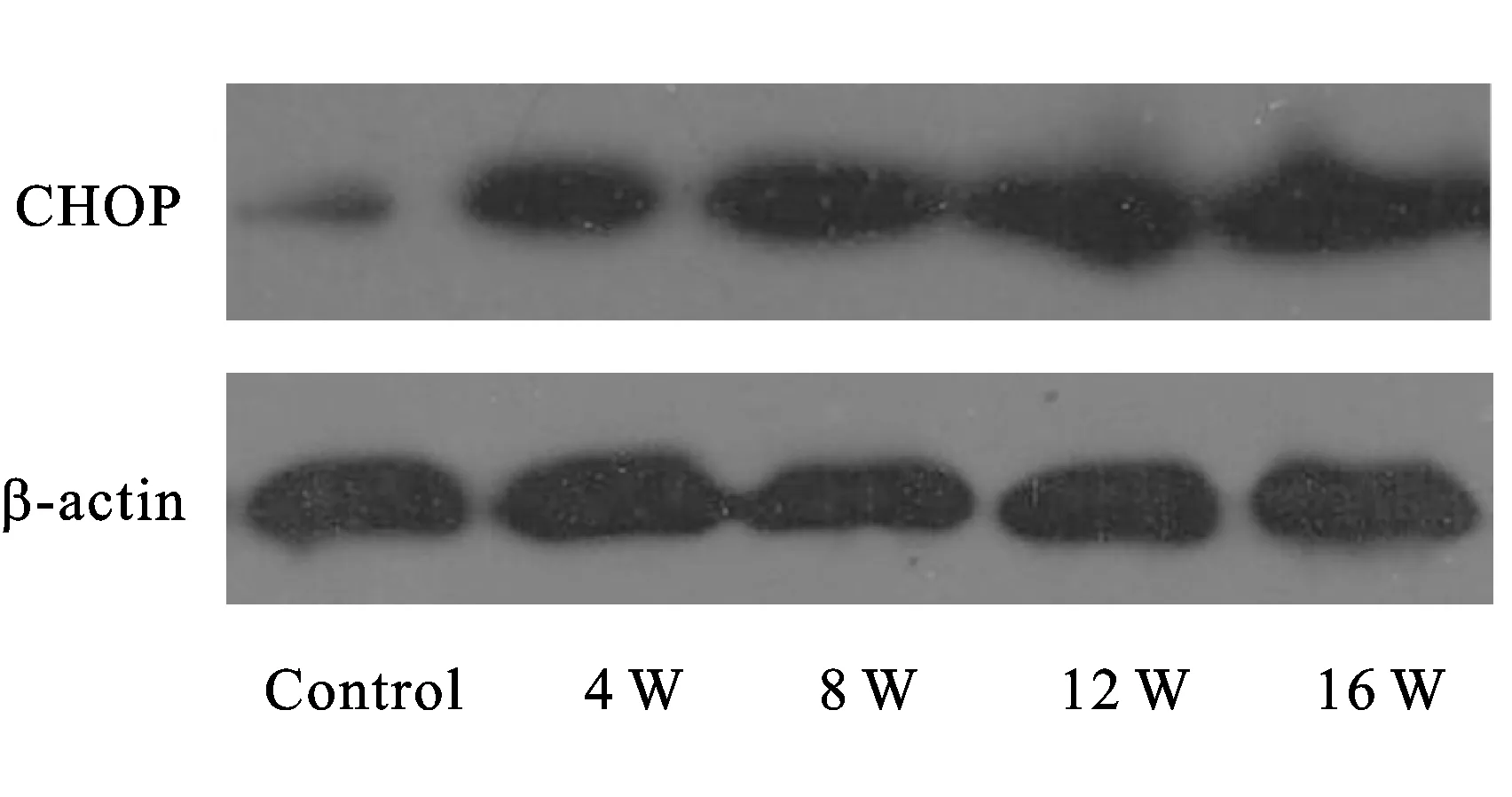
图4 Western-blotting蛋白印迹图
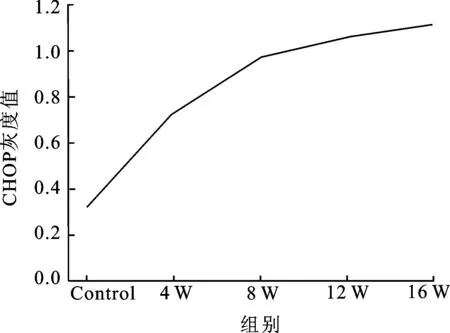
图5 Western-blotting检测CHOP蛋白的表达水平
3 讨 论
随着糖尿病病程进展,DSM细胞受损不断加重,膀胱功能由代偿期发展到失代偿期。在发病早期,膀胱功能障碍主要表现为逼尿肌过度活动导致的储尿期症状;发病晚期,毒性代谢产物不断堆积,主要表现为膀胱活动度减低症状[2,12-13]。
当细胞受到钙离子平衡紊乱、毒性产物堆积等因素影响时,内质网感受刺激发生ERS,UPR调控内质网功能基因表达上调,进而恢复或增强内质网折叠和处理蛋白质的能。UPR主要有三个经典特异性反应,其包括三个内质网应激感受器,PRKR样内质网调节激酶(PKR-like ER kinase,PERK)、激活转录因子6(activating transcription factor 6,ATF6),肌醇需酶1(inositol-requiring enzyme 1,IRE1)[14]。正常情况下,他们处于无活性状态,发生ERS时,与免疫球蛋白结合蛋白分离后活化。
CHOP,属于CCAAT/增强子结合蛋白、C/EBP 转录因子家族,其参与调节细胞增殖、分化和表达,以及细胞特异性基因的能量代谢[15-16]。CHOP是分子量29 ku的蛋白。CHOP有两个功能域,一个N末端转录激活结构域和C-末端亮氨酸链(bZIP蛋白)结构域[17]。CHOP基因启动子中含有结合UPR中XBP1、ATF6、ATF4等蛋白的位点。当ERS诱导凋亡时,IRE1信号通路、ATF6信号通路及PERK信号通路可以诱导CHOP的表达,进而促进CHOP的转录生成。ERS诱导细胞凋亡三条通路中,PERK信号通路起主要作用[18-19]。CHOP可以下调抗凋亡蛋白Bcl-2[20],减弱其调节钙离子能力,同时使BAX结合减少,游离的促凋亡蛋白BAX增多,激活caspase,诱导线粒体凋亡。CHOP也可以上调相关促凋亡蛋白[21-22],改变内质网膜通透性,激活caspase家族。TRB3是一个调节细胞内多个信号传导级联反应的伪激酶,影响细胞生存和代谢,干扰细胞信号传导。转染CHOP基因的足细胞中TRB3表达增加[23]。在脑部肿瘤的研究中发现,TRB3可以抑制Akt而激活自噬,也可以激活caspase,从而诱导细胞凋亡[24]。GADD34可以增强细胞对凋亡信号敏感性,敲除GADD34基因减轻了细胞内质网的功能负荷,同时降低内质网应激水平[25-27]。
对照组CHOP蛋白表达量低,提示通常情况下,CHOP的表达低;实验组由4周至16周,细胞凋亡率明显升高,提示随着DCP发生发展,DSM细胞凋亡数量逐渐增多;CHOP mRNA及蛋白表达均持续增加,内质网肿胀程度明显增加,提示随着DCP发生发展,内质网功能受损,内质网应激诱导的凋亡不断增强。内质网应激参与了糖尿病大鼠DSM细胞凋亡过程,CHOP与糖尿病膀胱病程进展呈正相关。
内质网应激依赖的胰岛素抵抗与膀胱过度活动的表现相关,胰岛素可以激活UPR减轻OAB症状[28]。研究显示,CHOP除诱导凋亡外,可以加重炎症反应[29-30]。据此我们推测,发病早期,内质网中UPR起主导作用,恢复或增强内质网折叠和处理蛋白质的能力,减轻膀胱逼尿肌功能损害,缓解逼尿肌过度活动,延缓DCP病情发展,与其他因素共同作用使膀胱处于代偿期。发病晚期,ERS主要诱导凋亡,大量逼尿肌细胞凋亡,同时CHOP的大量表达加重炎症反应,长期的炎症刺激,逼尿肌细胞损伤加重,膀胱功能进一步恶化,和线粒体应激诱导的凋亡等因素共同作用使膀胱处于失代偿期,表现为膀胱活动度减低症状。
本研究没有针对每个时间序列的实验组设置相应的对照组,结果可能产生偏差,需要更精准的研究。ERS在DCP发生发展中如何发生作用以及CHOP通过哪些途径影响逼尿肌细胞功能尚不清楚,今后我们将围绕时间序列做进一步的研究。
[1] BERGMAN M,BUYSSCHAERT M,SCHWARZ PE,et al.Diabetes prevention: global health policy and perspectives from the ground[J].Diabetes Manag (Lond),2012,2(4):309-321.
[2] GOMEZ CS,KANAGARAJAH P,GOUSSE AE.Bladder dysfunction in patients with diabetes[J].Curr Urol Rep,2011,12(6):419-426.
[3] MEI Y,THOMPSON MD,SHIRAISHI Y,et al. Sarcoplasmic/endoplasmic reticulum Ca2+ATPase C674 promotes ischemia- and hypoxia-induced angiogenesis via coordinated endothelial cell and macrophage function[J]. J Mol Cell Cardiol,2014,76:275-282.
[4] BINERT F,MAWAMBO G,SITARAS N,et al.Neuronal ER stress impedes myeloid-cell-induced vascular regeneration through IRE1α degradation of netrin-1[J]. Cell Metab,2013,17(3):353-371.
[5] SZEGEZDI E,LOGUE SE,GORMAN AM,et al. Mediators of endoplasmic reticulum stress-induced apoptosis[J]. EMBO Rep,2006,7(9):880-885.
[6] TRUSINA A,PAPA FR,TANG C,et al.Rationalizing translation attenuation in the network architecture of the unfolded protein response[J].Proc Natl Acad Sci,2008, 105(51):20280-20285.
[7] SCHRODER M,KAUFMAN RJ.ER stress and the unfolded protein response[J]. Mutat Res,2005,569(1-2):29-63.
[8] YANG H,LIU R,CUI Z,et al.Functional characterization of 58-kilodalton inhibitor of protein kinase in protecting against diabetic retinopathy via the endoplasmic reticulum stress pathway[J]. Mol Vis,2011,17:78-84.
[9] ZHAO Y,YAN Y,ZHAO Z.The dynamic changes of endoplasmic reticulum stress pathway markers GRP78 and CHOP in the hippocampus of diabetic mice[J].Brain Res Bull,2015,111:27-35.
[10] BESHAY E,CARRIER S.Oxidative stress plays a role in diabetes-induced bladder dysfunction in a rat model[J].Urology,2004,64(5):1062-1067.
[11] JOHNSON EL,SINGH R,SINGH S,et al.CCL25-CCR9 interaction modulates ovarian cancer cell migration,metalloproteinase expression,and invasion[J]. World J Surg Oncol,2010,8:62.
[12] DANESHGARI F,LIU G,IMERY PB,et al.Time dependent changes in diabetic cystopathy in rats include compensated and decompensated bladder function[J]. J Urol,2006,176(1):380-386.
[13] DANESHGARI F,HUANG X,LIU G,et al.Temporal differences in bladder dysfunction caused by diabetes,diuresis,and treated diabetes in mice[J].Am J Physiol Regul Integr Comp Physiol,2006,290(6):R1728-R1735.
[14] OYADOMARI S,MORI M.Roles of CHOP/GADD153 in endoplasmic reticulum stress[J]. Cell Death Differ,2004,11(4):381-389.
[15] BIRKENMEIER EH,GWYNN B,HOWARD S,et al.Tissue-specific expression, developmental regulation, and genetic mapping of the gene encoding CCAAT/enhancer binding protein[J].Genes Dev,1989,3(8):1146-1156.
[16] UMEK RM,FRIEDMAN AD,MCKNIGHT SL.CCAAT-enhancer binding protein: a component of a differentiation switch[J].Science,1991,251(4991):288-292.
[17] UBEDA M,WANG XZ,ZINSZNER H,et al.Stress-induced binding of the transcriptional factor CHOP to a novel DNA control element[J]. Mol Cell Biol,1996,16(4):1479-1489.
[18] LIU ZW,ZHU HT,CHEN KL,et al.Protein kinase RNA- like endoplasmic reticulum kinase(PERK) signaling pathway plays a major role in reactive oxygen species(ROS)- mediated endoplasmic reticulum stress- induced apoptosis in diabetic cardiomyopathy[J]. Cardiovasc Diabetol,2013,12:158.
[19] SCULL CM,TABAS I.Mechanisms of ER stress-induced apoptosis in atherosclerosis[J].Arterioscler Thromb Vasc Biol,2011,31(12):2792-2797.
[20] BOUMAN L,SCHLIERF A,LUTZ AK,et al.Parkin is transcriptionally regulated by ATF4:evidence for an interconnection between mitochondrial stress and ER stress[J].Cell Death Differ,2011,18(5):769-782.
[21] TSUKANO H,GOTOH T,ENDO M,et al.The endoplasmic reticulum stress-C/EBP homologous protein pathway-mediated apoptosis in macrophages contributes to the instability of atherosclerotic plaques[J]. Arterioscler Thromb Vasc Biol, 2010,30(10):1925-1932.
[22] GHOSH AP,KLOCKE BJ,BALLESTAS ME.CHOP Potentially co-operates with FOXO3a in neuronal cells to regulate PUMA and BIM expression in response to ER stress[J]. PLoS One,2012,7(6):e39586.
[23] MORSE E,SCHROTH J,YOU YH,et al.TRB3 is stimulated in diabetic kidneys, regulated by the ER stress marker CHOP, and is a suppressor of podocyte MCP-1[J]. Am J Physiol Renal Physiol,2010,299(5):F965-972.
[24] SALAZAR M,CARRACEDO A,SALANUEVA IJ,et al.Cannabinoid action induces autophagy-mediated cell death through stimulation of ER stress in human glioma cells[J]. J Clin Invest,2009,119(5):1359-1372.
[25] HOLLANDER MC,ZHAN Q,BAE I,et al.Mammalian GADD34, an apoptosis- and DNA damage-inducible gene[J].J Biol Chem,1997,272(21):13731-13737.
[26] MARCINIAK SJ,YUN CY,OYADOMARI S.CHOP induces death by promoting protein synthesis and oxidation in the stressed endoplasmic reticulum[J].Genes Dev,2004,18(24):3066-3077.
[27] OHRI SS,MULLINS A,HETMAN M,et al.Inhibition of GADD34,the stress-inducible regulatory subunit of the endoplasmic reticulum stress response,does not enhance functional recovery after spinal cord injury[J]. PLoS One,2014,9(11):e109703.
[28] LEIRIA LO,SOLLON C,BáU FR,et al.Insulin relaxes bladder via PI3K/AKT/eNOS pathway activation in mucosa:unfolded protein response-dependent insulin resistance as a cause of obesity-associated overactive bladder[J].J Physiol,2013,591(Pt9):2259-2273.
[29] ALLAGNAT F,FUKAYAL M,NOGUEIRA TC,et al.C/EBP homologous protein contributes to cytokine-induced pro-inflammatory responses and apoptosis in β-cells[J]. Cell Death Differ,2012,19(11):1836-1846.
[30] DEZWAAN-MCCABE D,RIORDAN JD,ARENSDORF AM.The stress-regulated transcription factor CHOP promotes hepatic inflammatory gene expression,fibrosis,and oncogenesis[J].PLoS Genet,2013,9(12):e1003937.
(编辑 王 玮)
The role of CHOP in the endoplasmic reticulum stress of diabetic rats’ bladder
CHI Jun-jie1, WANG Dong-wen2, YUAN Xiao-bin1, WANG Dong1
(1.the First College of Clinical Medicine, Shanxi Medical University, Taiyuan 030001; 2.Department of Urology,the First Hospital of Shanxi Medical University, Taiyuan 030001, China)
Objective To evaluate the effect of CHOP on the endoplasmic reticulum stress of diabetic rats’ detrusor muscle and investigate the relationship between the endoplasmic reticulum stress and development of diabetic cystopathy(DCP). Methods Rat models of type 1 diabetes mellitus were induced by injecting streptozocin. At different time points(4, 8, 12, 16 weeks after rat models were established), the ultrastructure of endoplasmic reticulum(ER) was observed with transmission electron microscopy(TEM), and the apoptosis was identified with terminal deoxynucleotidyl transferase-mediated DNA nick-end labeling(TUNEL) staining. The expression of the hallmarks of ERS-associated apoptosis, and CCAAT/enhancer-binding protein homologous protein(CHOP), were detected with quantitative real-time polymerase chain reaction(RT-PCR) and Western blotting. Results The ultrastructural changes featuring the swollen and fused cisternaes in ER zone and deformed nucleus were observed in the detrusor smooth muscle(DSM). Increased apoptosis of DSM and elevated expression of CHOP at both mRNA and protein levels in a time-dependent fashion were detected.Conclusion Endoplasmic reticulum stress(ERS) contributes to the apoptosis of the DSM cells of SD rats. CHOP was positively correlated with the development of DCP.
diabetic cystopathy; detrusor; endoplasmic reticulum stress; CHOP
2015-11-26
2016-02-07
国家自然科学基金(No.81370861)
王东文,教授.E-mail:Urology2007@126.com
池俊杰(1988-),男(汉族),在读硕士研究生.研究方向:尿动力学.E-mail:chijunjie.999@163.com
R332
A
10.3969/j.issn.1009-8291.2016.06.014

