EGFR、IGF1R、Ki67及Weiss评分对肾上腺皮质肿瘤诊断和预后预测的价值
徐烈雨,徐云泽,廉建坡,林登强,沈周俊,祝 宇
(上海交通大学医学院:1.附属瑞金医院泌尿外科,2.附属仁济医院泌尿外科,上海 200025)
·临床研究·
EGFR、IGF1R、Ki67及Weiss评分对肾上腺皮质肿瘤诊断和预后预测的价值
徐烈雨1,徐云泽2,廉建坡1,林登强1,沈周俊1,祝 宇1
(上海交通大学医学院:1.附属瑞金医院泌尿外科,2.附属仁济医院泌尿外科,上海 200025)
目的 探讨表皮生长因子受体(EGFR)及胰岛素样生长因子受体(IGF1R)在肾上腺皮质肿瘤中的表达,分析EGFR、IGF1R、细胞增殖抗原标记物(Ki67)及Weiss评分与肾上腺皮质癌(ACC)总体预后的关系。方法 选取ACT标本37例(其中良性腺瘤17例,恶性皮质癌20例),采用免疫组化及蛋白免疫印迹法检测其中EGFR和IGF1R的表达,并通过生存曲线分析各项指标与恶性组预后的关系。结果 EGFR在恶性组中表达阳性率明显高于良性组(15/20vs.3/17;P<0.01),恶性组中IGF1R的表达亦高于良性组(14/20vs.4/17;P<0.01),两者在恶性组中的蛋白水平高于良性组;预后分析发现Ki67>10%的皮质癌患者预后明显差于<10%的患者(P<0.01),而>6分的ACC生存期明显短于Weiss<6分的患者(P<0.01)。结论 EGFR和IGF1R表达有助于鉴別肾上腺肿瘤良恶性,而Ki67指数及Weiss评分可以作为ACC预后预测指标。
肾上腺皮质癌;EGFR;IGF1R;Ki67;Weiss评分
目前肾上腺皮质癌(adrenocortical carcinoma,ACC)发病机制尚未完全阐明,早期诊断困难[1];目前主要依靠Weiss评分,其通过细胞形态学、肿瘤结构及侵袭特征来分析鉴别,但敏感度和特异度并不十分理想[2]。表皮生长因子受体(epidermal growth factor receptor,EGFR)参与细胞增殖、代谢等过程[3];另外胰岛素样生长因子受体(insulin-like growth factor 1 receptor,IGF1R)亦参与肿瘤的增殖进展等[4]。本研究通过检测EGFR和IGF1R在ACT中的表达情况,从而为良恶性鉴别诊断提供依据。最新研究证明,EGFR和IGF1R的过表达与其他肿瘤增殖和远处转移有关,但两者在肾上腺皮质肿瘤(adrenocortical tumor, ACT)中的表达情况国内尚无相关研究。ACC预后较差,进展期五年生存率<15%[5];关于ACC的预后预测指标研究甚少,既往报道称EGFR及IGF1R的表达与其他肿瘤的长期预后有关[6]。因此本研究进一步分析EGFR、IGF1R表达阳性与ACC总体预后之间的关系。另外本研究亦同时探讨Ki67及Weiss评分与ACC预后关系。
1 资料与方法
1.1 临床资料 收集1996年8月至2013年8月上海交通大学医学院附属瑞金医院泌尿外科手术治疗的37例ACT患者标本的临床病理资料。术前根据症状、体征、内分泌检查以及B超、CT、MRI等影像学检查初步诊断,术后病理诊断根据改良的Weiss评分法,≥ 3分诊断为ACC,<3分诊断为肾上腺皮质腺瘤(adrenocortical adenoma,ACA)。良性肿瘤组(ACA)17例,恶性肿瘤组(ACC)20例。所有术后标本均经4%(体积分数)中性甲醛液固定、脱水后石蜡包埋。
良性组17例患者中,男性8例,女性9例;平均年龄(44.7±16.3)岁,分别包括库欣综合征6例、原发性醛固酮增多症5例、无功能性肾上腺皮质腺瘤6例;恶性组20例患者中,男8例,女12例,平均年龄(57.5±17.2)岁。根据2004年ACC的TNM分期标准,恶性组(ACC)20例中包括Ⅰ期5例,Ⅱ期9例,Ⅲ期6例。所有研究对象均签署知情同意书,本研究经上海交通大学医学院附属瑞金医院伦理委员会批准备案。在患者诊断后开始随访,直至患者死亡或者到2013年8月研究终止;所有的患者均获得完整随访资料,其中恶性组患者平均随访时间为(6.26±5.11)年,良性组为(10.12±3.46)年,详见表1。
最终所有20例恶性组患者中,18例死亡;而良性组中仅1例死亡。18例随访期间死亡的恶性组患者平均生存期为(4.2±3.3)年,余2例患者随访结束后仍存活,2例患者分别随访9.5和7.8年,且EGFR表达均为阳性,而IGF1R表达则为1例阳性,1例阴性;同时该2例患者的Ki67指数<10分,Weiss<6分。1.2 主要试剂及实验方法 免疫组化实验:一抗为鼠抗人多克隆EGFR抗体(Abcam,USA,1︰100稀释),兔抗人多克隆IGF1R抗体(Abcam,USA,1∶150)以及兔抗人Ki67多克隆抗体(Immuno Technology,France,1∶50稀释);二抗为DAKO公司EnVisionTM抗兔及EnVisionTM抗鼠IgG试剂盒。
采用免疫组化半定量方法;标本经4%(体积分数)中性甲醛固定脱水及石蜡包埋后,4 μm厚连续切片;再经二甲苯脱蜡15 min;之后用3%H2O2孵育以抑制内源性过氧化物酶,PBS洗涤3次,微波抗原修复,滴加10%正常山羊血清,室温封闭。分别滴加上述三种一抗,湿盒中4 ℃孵育过夜,PBS洗涤3次,之后分别滴加生物素标记二抗,37℃孵育30 min。PBS洗涤3次后再二氨基联苯胺显色,苏木素复染,常规脱水,透明,封片。
表1 ACC和ACA组患者一般资料
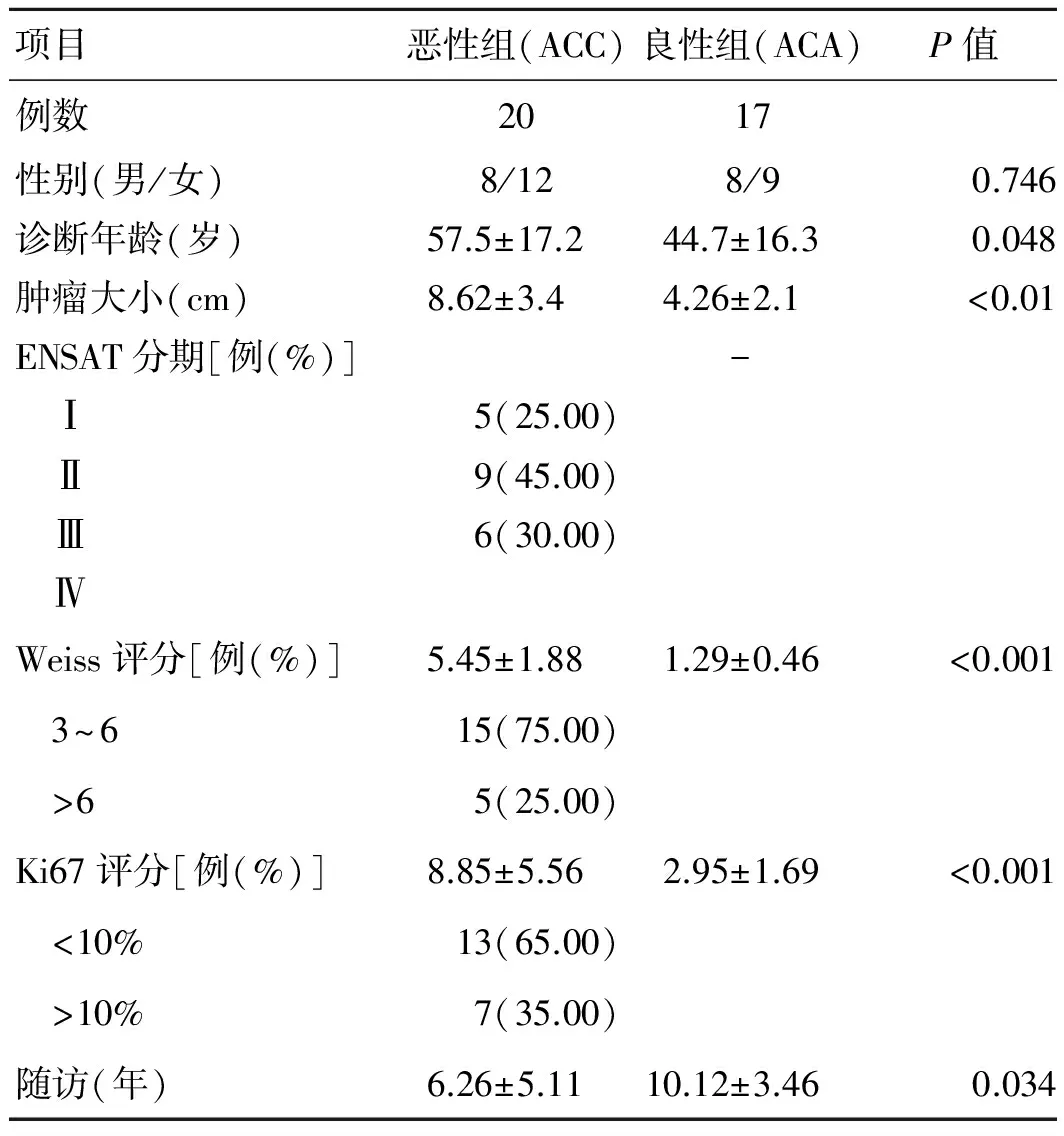
项目恶性组(ACC)良性组(ACA)P值例数2017性别(男/女)8/128/90.746诊断年龄(岁)57.5±17.244.7±16.30.048肿瘤大小(cm)8.62±3.44.26±2.1<0.01ENSAT分期[例(%)]- Ⅰ5(25.00) Ⅱ9(45.00) Ⅲ6(30.00) ⅣWeiss评分[例(%)]5.45±1.881.29±0.46<0.001 3~615(75.00) >65(25.00)Ki67评分[例(%)]8.85±5.562.95±1.69<0.001 <10%13(65.00) >10%7(35.00)随访(年)6.26±5.1110.12±3.460.034
蛋白免疫印迹实验:提取肾上腺皮质肿瘤和正常肾上腺组织蛋白,分别加入RIPA、Cocktail及PMSF蛋白酶抑制剂,冰上裂解30 min后离心;之后采用BCA法蛋白质定量计算样品蛋白的浓度。取蛋白加样于10%的SDS聚丙烯酰胺凝胶中电泳,100 V恒压转膜2 h后以3%BSA封闭1 h,与相应一抗4 ℃过夜(稀释1∶1 000)。TBST洗涤3次后与含相应种属的二抗作用1h(稀释1∶10 000),机器显影。
1.3 免疫组织化学检测结果判定标准 EGFR和IGF-1R染色均以肿瘤细胞胞质内或胞膜出现棕褐色或棕黄色颗粒为阳性,否则为阴性,由2位病理科医师独立完成。高倍镜下(×400)对每张切片随机选择5个视野,每个视野计数200个细胞,共计1 000个。阳性染色细胞为细胞结构清晰、阳性颗粒定位好、着色与背景对比清晰。判断阳性或阴性的根据为细胞染色强度和染色细胞所占比例两种指标的积分之和。其中染色强度积分为:不染色=0,轻度染色=1,中度染色=2,强染色=3;阳性细胞比例积分为:无细胞染色=0,<30%细胞染色=1,30~60%细胞染色=2,>60%细胞染色=3.若两种积分之和>3分则表达为阳性,≤3分则为阴性[7]。
Ki67指数及Weiss评分的判定:通过选择高倍镜视野下,每100个肾上腺细胞中Ki67阳性的细胞数量及比率计作为Ki67指数(%)。Weiss评分主要通过9种不同的组织学特征:细胞核分裂指数≥5/50高倍镜视野,核异型性增生,不典型核分裂,低百分比透明细胞,肿瘤坏死,窦状样结构浸润,弥漫分布,包膜外侵犯以及血管侵袭,上述任一组织学特征出现即赋值1分,然后将分数加权。

2 结 果
2.1 EGFR及IGF1R 在ACC中呈明显高表达 EGFR在恶性组中阳性表达率为75.00%(15/20),但其在良性组中阳性表达率仅为17.64%(3/17,P<0.01); 同时IGF1R在恶性组中呈高表达(70.00%,14/20),在良性组中表达较低(23.52%,4/17),两组之间表达存在显著性差异(P<0.001,图1,表2)。同时发现恶性组中EGFR及IGF1R同时表达增高的阳性率为60.00%(12/20),而在良性组中EGFR及IGF1R同时表达增高的阳性率仅为11.76%(P<0.01)。通过Spearman等级相关分析证实恶性组患者中EGFR与IGF1R的表达呈正相关(r_s=0.814,P<0.01)。另外通过Western blot检测恶性组、良性组及正常对照组蛋白表达水平(图2),结果显示EGFR和IGF1R在恶性组中的蛋白表达水平同样高于良性组,而正常肾上腺皮质组织中EGFR和IGF1R表达水平最低,差异有统计学意义(P<0.01)。
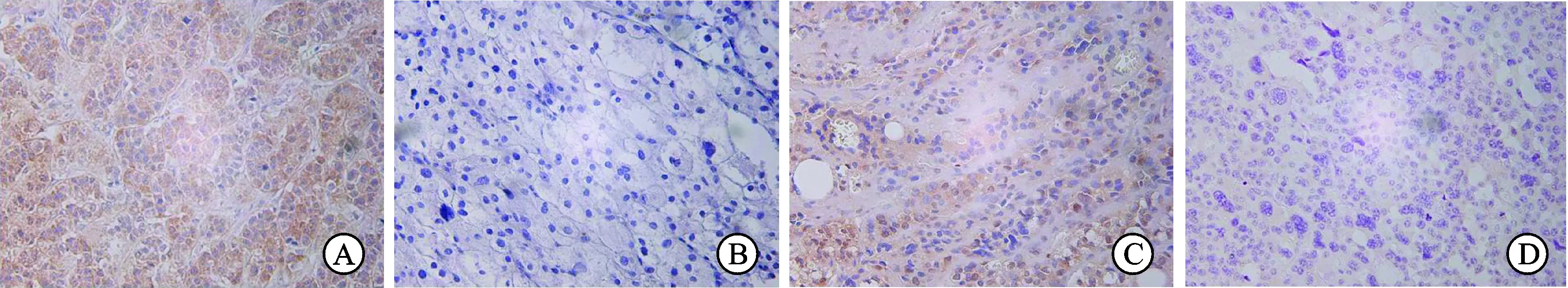
图1 ACC和ACA患者EGFR及IGF1R免疫组化结果(×400)
A:恶性组中EGFR阳性;B:良性组中EGFR阴性;C:恶性组中IGF1R阳性;D:良性组中IGF1R阴性。
2.2 EGFR、IGF1R、Ki67及Weiss评分与ACC患者总体生存期的关系Kaplan-Meier预后分析曲线表明(图3),EGFR表达阳性组ACC患者生存期与阴性组无显著差别(P=0.115);ACC患者中IGF1R表达阳性组与阴性组总体预后无明显差别(P=0.197)。而分析Ki67及Weiss评分与总体预后相关,结果发现Ki67指数以10分为临界值,Ki67>10分组ACC患者生存期要明显短于Ki67<10分组(P<0.001),而Weiss评分<6分的患者总体生存期同样明显长于>6分组(P<0.001)。
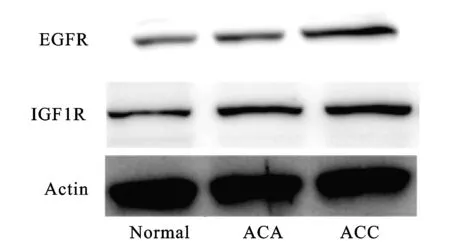
图2 恶性组、良性组及正常肾上腺标本EGFR及IGF1R蛋白表达水平
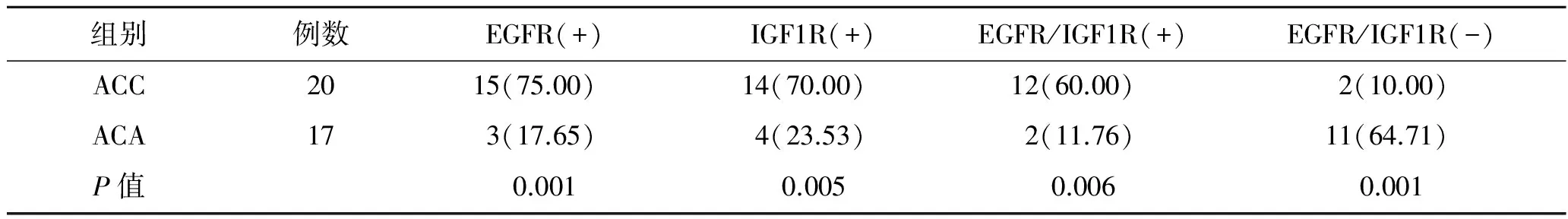
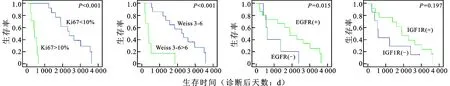
图3 Ki67、Weiss评分、EGFR及IGF1R指标与ACC患者预后Kaplan-Meier曲线
3 讨 论
肾上腺皮质肿瘤已逐渐成为人体最常见的实体肿瘤之一,虽然良性腺瘤患者行肿瘤切除后均能获得满意的疗效和预后;但恶性皮质癌恶性程度极高,预后极差,且临床确诊时由于肿瘤已发生转移,因此肾上腺皮质癌的早期诊断显得尤为重要,但目前的生化检查及影像学技术尚不能有效鉴别出肾上腺肿块的良、恶性,如何做到及时发现与早期决策有着非常重要的临床意义。而当肿瘤进展至中晚期时,米托坦联合细胞毒药物为目前惟一可选的一线治疗方案,但患者的总体生存率仍非常低,最新的研究显示伴有远处转移或复发的肾上腺皮质癌五年生存率仅为5%,且中位生存期低于15个月[5]。
晚期肿瘤的靶向治疗己成为当前抗肿瘤治疗的有效手段之一,针对不同分子靶点的单克隆抗体及酪氨酸激酶抑制剂等多种靶向治疗药物已应用于临床多种不同种类的肿瘤,而探索针对ACC的潜在靶点也显得十分有必要。EGFR是一种膜表面具有酪氨酸激酶活性的糖蛋白受体,属于蛋白激酶超家族的成员,可以被EGF、THF-α等配体结合而活化,继而激活下游信号转导通路,引起胞内一系列信号的级联反应,最终参与细胞的分化、迁移、血管生成和抑制凋亡等过程[3]。继研究者首次在非小细胞肺癌中检测出EGFR过表达后,人们相继在多种实体瘤如乳腺癌、结直肠癌、头颈部肿瘤、膀胱癌、肾癌中检测到EGFR的超表达或扩增[8]。我们对临床收集的37例肾上腺皮质肿瘤标本进行免疫组化半定量分析,结果显示EGFR在肾上腺皮质癌中呈高表达,在肾上腺皮质腺瘤中表达低,两者之间EGFR的表达存在显著性差异(P<0.001)。并应用Western blot技术进一步验证肾上腺皮质癌中的EGFR水平明显高于肾上腺皮质腺瘤和正常肾上腺皮质组织。
IGF1R蛋白也是一种跨膜酪氨酸蛋白激酶受体,而IGF-2基因位于11p5号染色体,编码表达的生长因子IGF2可以特异性结合IGF1R。既往研究发现85%的肾上腺皮质癌患者的染色体11p5上IGF2过度表达,RT-PCR亦显示80%以上的患者过表达IGF2[9];而IGF2与IGF1R特异性结合后,导致受体自身的磷酸化,进一步通过PI3K-AKT和STAT等途径,或激活RAS-MAPK级联反应,从而促进细胞生长增殖并抑制凋亡[10]。我们通过对收集的肾上腺皮质肿瘤标本进行免疫组化和蛋白印迹实验检测,研究结果证实ACC中IGF1R的表达水平远高于良性的肾上腺皮质腺瘤。
同时,我们通过Kaplan-Meier预后曲线分析,发现EGFR及IGF1R表达阳性患者总体生存期并无明显相关(P>0.05),提示可能EGFR及IGF1R并不能用于预测ACC患者的总体预后。Ki67抗原存在于细胞周期中除G0期外所有阶段,它开始表达于G1期,在S期及G2期表达增加,至M期达高峰,在分裂晚期消失,是检测肿瘤细胞增殖活性最可靠的指标[11]。在肾上腺肿瘤中,Ki67在恶性组中指数较高,而在良性腺瘤中一般均小于5分。本研究中发现将Ki67指数分为<10%及>10%,发现>10%组ACC患者预后总体生存期明显更差(P<0.01),这与近期其他报道类似[12];同时既往亦有文章报道Ki67与疾病复发有关[13],进一步确认了Ki67作为ACC预后观察指标的应用。而Weiss评分主要根据9项组织学指标来鉴别肾上腺肿瘤的良恶性,本研究发现将Weiss评分分为3~6分及>6分,大于6分组患者总体生存期明显更短(P<0.01),亦提示可以将Weiss评分作为ACC患者总体预后的观察指标。进一步比较Ki67指数及Weiss评分的预测效能,提示两者预测能力类似。
通过本研究我们推测,EGFR和IGF1R的过度表达与ACC肿瘤的发生、发展均有密切关系,两者可以作为鉴別良、恶性肾上腺皮质肿瘤一种有价值的分子标志物,且可能成为抑制ACC细胞增殖和远处转移的治疗新的分子靶标;同时Ki67及Weiss评分可以作为肾上腺皮质癌患者的预后预测指标。
[1] FASSNACHT M, KROISS M, ALLOLIO B. Update in adrenocortical carcinoma [J]. J Clin Endocrinol Metab, 2013, 98(12): 4551-4564.
[2] PAPOTTI M, LIBE R, DUREGON E, et al. The Weiss score and beyond--histopathology for adrenocortical carcinoma [J]. Horm Cancer, 2011, 2(6): 333-340.
[3] SHELTON J G, STEELMAN L S, ABRAMS S L, et al. The epidermal growth factor receptor gene family as a target for therapeutic intervention in numerous cancers: what’s genetics got to do with it? [J]. Expert Opin Ther Targets, 2005, 9(5): 1009-1030.
[4] TOGNON C E, SORENSEN P H. Targeting the insulin-like growth factor 1 receptor(IGF1R) signaling pathway for cancer therapy [J]. Expert Opin Ther Targets, 2012, 16(1): 33-48.
[5] BERRUTI A, BAUDIN E, GELDERBLOM H, et al. Adrenal cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up [J]. Ann Oncol, 2012, 23 Suppl 7: 131-138.
[6] GATELY K, FORDE L, CUFFE S, et al. High coexpression of both EGFR and IGF1R correlates with poor patient prognosis in resected non-small-cell lung cancer [J]. Clin Lung Cancer, 2014, 15(1): 58-66.
[7] ZHU Y, HE H C, YUAN F, et al. Heparanase-1 and Cyclooxygenase-2: prognostic indicators of malignancy in pheochromocytomas [J]. Endocrine, 2010, 38(1): 93-99.
[8] LI W, ZHOU F, ZHOU C. Role of erlotinib in the targeted treatment of non-small-cell lung cancer in Chinese patients [J]. Onco Targets Ther, 2014, 13(7): 253-261.
[9] WEST A N, NEALE G A, POUNDS S, et al. Gene expression profiling of childhood adrenocortical tumors [J]. Cancer Res, 2007, 67(2): 600-608.
[10] BARLASKAR F M, SPALDING A C, HEATON J H, et al. Preclinical targeting of the type I insulin-like growth factor receptor in adrenocortical carcinoma [J]. J Clin Endocrinol Metab, 2009, 94(1): 204-212.
[11] HALL P A, LEVISON D A, WOODS A L, et al. Proliferating cell nuclear antigen(PCNA) immunolocalization in paraffin sections: an index of cell proliferation with evidence of deregulated expression in some neoplasms [J]. J Pathol, 1990, 162(4): 285-294.
[12] BEUSCHLEIN F, WEIGEL J, SAEGER W, et al. Major prognostic role of Ki67 in localized adrenocortical carcinoma after complete resection [J]. J Clin Endocrinol Metab, 2015, 100(3): 841-849.
[13] MORIMOTO R, SATOH F, MURAKAMI O, et al. Immunohistochemistry of a proliferation marker Ki67/MIB1 in adrenocortical carcinomas: Ki67/MIB1 labeling index is a predictor for recurrence of adrenocortical carcinomas [J]. Endocr J, 2008, 55(1): 49-55.
(编辑 何宏灵)
The diagnostic and prognostic value of EGFR, IGF1R, Ki67 and Weiss score for adrenocortical tumors
XU Lie-yu1, XU Yun-ze2, LIAN Jian-po1, LIN Deng-qiang1, SHEN Zhou-jun1, ZHU Yu1
(1.Department of Urology,Ruijin Hospital; 2. Department of Urology, Renji Hospital, School of Medicine, Shanghai Jiaotong University, Shanghai 20025, China)
Objective To investigate the expressions of epidermal growth factor receptor(EGFR) and insulin like growth factor 1 receptor(IGF-1R) in adrenocortical carcinoma(ACC), and to further evaluate the prognostic value of Ki67 and Weiss score for ACC. Methods A total of 37 adrenal cortical neoplasm specimens resected from patients were examined with immunohistochemistry and western immunoblot for the expressions of EGFR and IGF-1R. The patients were divided into two groups(17 benign and 20 malignant cases). The association between these markers with the prognosis of ACC was investigated withKaplan-Meiercurve. Results The expression of EGFR in the malignant group was significantly higher than that of benign group(15/20vs. 3/17,P<0.01), and the positive expression of IGF1R was significantly higher in the malignant group than in the benign group(14/20vs. 4/17,P<0.01). Moreover, the protein expression levels of EGFR and IGF1R were higher in the malignant group than in the benign group. Prognosis analysis indicated that patients with Ki67>10% had poor prognosis than those with Ki67<10%(P<0.01), while patients with Weiss score>6 had shorter survival than those with Weiss score<6(P<0.01). Conclusion The high expressions of EGFR and IGF-1R in ACC contribute to tumor angiogenesis, which provide the theoretical evidence for anti-angiogenesis regime in ACC. Meanwhile, the Ki67 and Weiss score can serve as valuable prognostic marker for ACC.
adrenocortical carcinoma; epidermal growth factor receptor(EGFR); insulin like growth factor 1 receptor(IGFIR); Ki67 index; Weiss score
2015-10-19
2016-03-05
国家自然科学基金(No.81272936),上海市科委引导基金(No.134119a2700)
祝宇,主任医师. E-mail:zyyyhyq@126.com
徐烈雨(1991-),男(汉族),硕士研究生.研究方向:肾上腺肿瘤.E-mail:877312540@qq.com
R736.6
A
10.3969/j.issn.1009-8291.2016.06.003

