精制对蚕蛹油抗氧化活性的影响
刘 军 郑翠翠 廖森泰 邹宇晓 施 英 穆利霞 林光月
(广东省农业科学院蚕业与农产品加工研究所/农业部功能食品重点实验室/广东省农产品加工重点实验室,广州 510610)
精制对蚕蛹油抗氧化活性的影响
刘 军 郑翠翠 廖森泰 邹宇晓 施 英 穆利霞 林光月
(广东省农业科学院蚕业与农产品加工研究所/农业部功能食品重点实验室/广东省农产品加工重点实验室,广州 510610)
分别采用超临界CO2萃取和溶剂浸提2种途径从蚕蛹中提取毛油,再通过脱胶、脱酸、脱色、脱臭等工艺精制蚕蛹油,收集不同精制阶段的蛹油样品,测定色差变化,利用不同的抗氧化评价方法(包括总抗氧化能力FRAP、DPPH清除率、总酚含量、总类胡萝卜素含量)评估其抗氧化活性,并对评估结果进行相关性分析和主成分分析。结果表明,超临界萃取的蚕蛹毛油抗氧化活性明显优于正己烷浸提;随着精制过程的进行,蛹油亮度增加,黄色减少,自身抗氧化成分逐步损失,蛹油氧化稳定性下降,精制过程造成2种途径获得的蛹油总酚损失24.73%~65.14%,类胡萝卜素损失12.0%~69.27%,其中脱色阶段损失最为显著。相关性分析发现,蚕蛹油的抗氧化能力与总酚和类胡萝卜素的含量密切相关,而总抗氧化能力FRAP与DPPH清除率之间的相关性不显著;主成分分析发现,溶剂提取和超临界萃取2种途径制备的蚕蛹毛油抗氧化活性差异较大,但经精制处理后,二者的抗氧化能力又大幅下降至同一水平。
蚕蛹油 提取 精制 抗氧化
蚕蛹油含量丰富的活性成分,不饱和脂肪酸质量分数在75%以上,其中α-亚麻酸的质量分数约为35%,具有增长智力、保护视力、延缓衰老、降血脂、降血压及预防心脑血管疾病和抑制老年性痴呆等作用[1]。提取的蚕蛹毛油由于含有磷脂、蛋白质、水分和色素等物质,对蚕蛹油的贮藏品质不利,在后期加工、贮藏和运输过程中极易受到氧、水分、高温、光照、射线以及催化剂的影响而氧化变质,严重影响了产品的品质,因此必须对蚕蛹毛油进行精制处理,以获得品质优良的蚕蛹油成品,延长货架期。
酚类和类胡萝卜素是油脂中存在的2类重要天然抗氧化剂,可以同油脂氧化酸败产生的过氧化物结合,对不饱和脂肪酸起到一定的保护作用,与油脂的总抗氧化能力息息相关[2-4]。但酚类和类胡萝卜素极易在加工过程中流失,尤其是精制的脱色阶段[5],因此有必要对整个精制工艺进行系统研究,掌握抗氧化成分的损失情况并加以控制。现阶段关于油脂的抗氧化评价方法众多,不同的评价体系侧重点各不相同,油脂的总抗氧化能力可通过FRAP法[6]、DPPH法[7]、ABTS法[6]和β-胡萝卜素含量[7]进行评价,而针对蚕蛹油的抗氧化评价体系的研究鲜有报道。本试验采用超临界CO2萃取和溶剂浸提2种方法从蚕蛹中提取毛油,精制加工后收集不同精制阶段的蛹油样品,利用不同的抗氧化评价方法跟踪蚕蛹油加工过程中的抗氧化活性变化规律,明确其抗氧化活性与酚类和类胡萝卜素物质的关系,为蚕蛹油的工业化生产及产品货架期的延长提供理论参考。
1 材料与方法
1.1 材料与试剂
新鲜蚕蛹:两广二号品种,广东省农业科学院蚕业与农产品加工研究所。
福林酚试剂(FC):广州市齐云生物技术有限公司,总抗氧化能力检测试剂盒:南京建成生物科技有限公司,其余试剂均为分析纯。
1.2 仪器
HL-1L/50Mpa-11B超临界萃取仪:杭州华黎泵业有限公司;HZQ-QX恒温振荡器哈尔滨市东联电子技术开发有限公司;Infinite200酶标仪:瑞士TECAN公司;Ultrascan VIS色度仪:北京晶光仪器有限公司;UV-1800分光光度仪:日本岛津公司; Sorvall Stratos高速冷冻离心机:美国Checkpoint有限公司;pHS-3C pH计:上海理达仪器厂;GHRH-20热泵干燥机:广东省农业机械研究所。
1.3 试验方法
1.3.1 蚕蛹油提取精制工艺流程

1.3.2 蚕蛹粉的制备
新鲜蚕蛹经沸水中烫漂3 min后置于60 ℃的热泵干燥机中,干燥至含水量为5%左右,粉碎过40目筛,存放于-18 ℃的冰箱中待用。
1.3.3 蚕蛹油的提取
正己烷浸提:按照蚕蛹粉∶正己烷=1∶4(m/V)置于恒温振荡器提取4 h(控制转速160 r/min,温度38 ℃),然后真空抽滤除去滤渣,滤液40 ℃旋蒸回收正己烷,获得蚕蛹毛油Z1。
超临界CO2萃取:压力25 MPa、温度45 ℃、时间2.5 h,获得蚕蛹毛油C1。
1.3.4 蛹油的精制
脱胶:参照郭无瑕等[8]的方法稍加修改,将2种提取方法获得的蚕蛹毛油水浴加热到70 ℃并不断搅拌,缓慢加入占油质量1%的磷酸(体积分数80%),离心分别获得上层脱胶油Z2和C2。
脱酸:参照刘玉兰[9]的碱炼脱酸法,向脱胶蛹油中加入3.6 mol/L的NaOH溶液和0.3%的超量碱,缓慢滴加并均匀搅拌加热到70 ℃保温30 min,冷却至室温,分离得油层,再用去离子水洗涤3次,离心分别获得上层脱酸蛹油Z3和C3。
脱色:参照郭华等[10]的方法稍加修改,用白土做脱色剂,将脱酸后的蚕蛹油水浴加热到60 ℃,加入蚕蛹油质量4%的白土,搅拌时间为30 min,再真空抽滤,滤液即为脱色蛹油Z4和C4。
脱臭:蛹油置于圆底烧瓶,水浴80 ℃旋转蒸发15 min,即得到脱臭蛹油Z5和C5。
搜集精制各阶段的蛹油样品置于4 ℃以下避光保存。
1.4 测定方法
1.4.1 总抗氧化能力(FRAP法)测定
准确称取5 g蚕蛹油样品置于250 mL三角瓶中,加入70 mL 甲醇后,放入65 ℃恒温水浴锅中冷凝回流90 min,提取完成后,冷冻(-20 ℃,30 min)分离,上层液旋蒸浓缩,甲醇定容到10 mL,4 ℃以下避光保存待测[5]。
参照Benzie等[11]建立的FRAP方法:试剂TPTZ可以被样品中的物质还原成二价的铁离子,颜色呈蓝色,在593 nm下测定蓝色的Fe2+-TPTZ即可获得样品中的总抗氧化能力。96孔板的每个检测孔中加入180 μL FRAP工作液,空白对照孔中加入5 μL蒸馏水或PBS等适当溶液;标准曲线检测孔内加入5 μL各种浓度的FeSO4标准溶液;样品检测孔内加入5 μL各种样品。轻轻混匀;37 ℃孵育3~5 min后测定A593,根据标曲计算总抗氧化能力。
标准曲线的制备:称取27.8 mg本试剂盒提供的FeSO4·7H2O,溶解并定容到1mL,此时浓度即为100 mmol/L。取适量100 mmol/L FeSO4溶液稀释至0.15、0.3、0.6、0.9、1.2和1.5 mmol/L的Trolox标准品溶液,然后按上述方法操作,获得以吸光度为纵坐标、Fe2+浓度为横坐标的标准曲线y=0.286 8x-0.009 9(R2=0.996)。
1.4.2 DPPH法测定[12]
DPPH溶液(105 μmol/L):称取DPPH 0.008 28 g加乙酸乙酯溶解并定容于200 mL混合均匀,得到105 μmol/L DPPH溶液。Trolox标准储备液(0.1 g/L Trolox):称取Trolox标准物0.001 g,用适当的乙酸乙酯溶解并定容到10 mL的容量瓶中混合均匀,即为0.1 g/L Trolox标准储备液。
按油样与乙酸乙酯体积比为1∶0、1∶0.5、1∶1、1∶1.5、1∶2、1∶2.5配制,待测。样品和标准曲线(Trolox)的测定方法根据表1的顺序向试管中加入所需试剂并按照表所列规定进行操作。
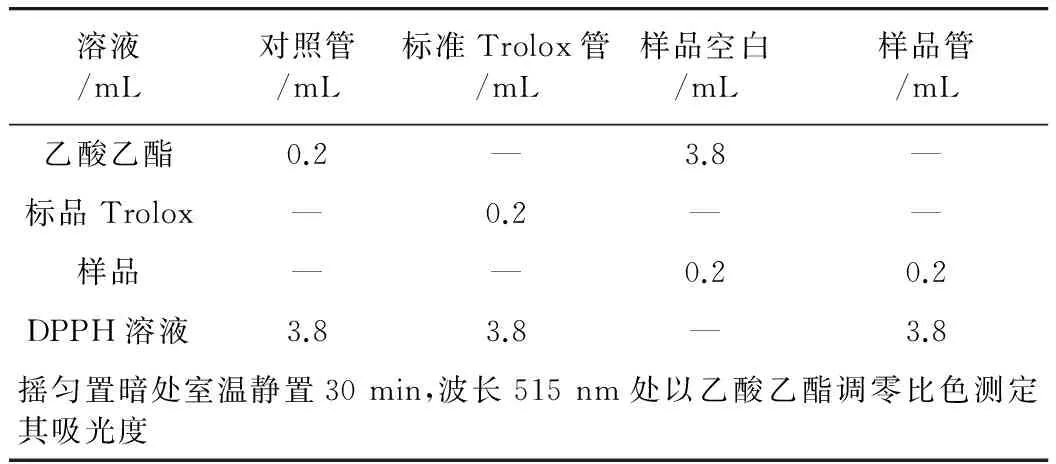
表1 样品及标准曲线的测定方法
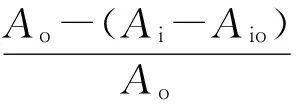
式中:Ao为3.8 mL的DPPH溶液+0.2 mL乙酸乙酯溶液所测吸光值;Ai为3.8 mL的乙酸乙酯溶液+0.2 mL样品的乙酸乙酯稀释液所测吸光值;Aio为3.8 mL的DPPH溶液+0.2 mL样品的乙酸乙酯稀释液所测吸光值。
标准曲线的绘制:取0.1 g/L(相当于0.4 mmol/L) Trolox标准储备液,稀释成0.16、0.08、0.04、0.02、0.01、0 mmol/L的Trolox标准品溶液,然后按照表1测定,重复测定3次,获得以清除率为纵坐标、Trolox浓度为横坐标的标准曲线y=0.907 4x-0.032(R2=0.991 9)。
1.4.3 总酚含量(TPC)的测定[13]
分别吸取50 μL待测样(按1.4.1方法提取)到刻度试管中,用蒸馏水补足至6 mL,再顺序加入1 mL FC显色剂溶液,3 mL NaCO3(7.5%)溶液,摇匀,室温放置显色2 h,在765 nm下测吸光值,由标曲求总酚质量浓度,以没食子酸(GA)计。
标准曲线的测定:配制没食子酸标准品的质量浓度分别为0、0.50、1.00、1.50、2.00、2.50、3.00、3.50 mg/L,按照上述方法操作,获得以吸光值为纵坐标、GA浓度为横坐标的标准曲线y=0.140 1x+0.018 9(R2=0.997)。
1.4.4 总类胡萝卜素含量(TCC)的测定[14]
称取蚕蛹油1.5 g,用正己烷溶解并定容至10 mL,再从中取1 mL稀释到适当的质量浓度,采用紫外分光光度仪在450 nm下测定吸光值,样品中总类胡萝卜素的含量(mg/g)用标准品β-胡萝卜素计。以质量浓度作横坐标,吸光值作纵坐标绘制标准曲线y=0.088 5x-0.282(R2=0.993 9)。
1.5 数据处理
试验数据采用Excell 2010处理,采用SPSS16.0、ORIGIN7.5、SAS9.2软件绘图。
2 结果与分析
2.1 精制对蚕蛹油色差的影响
针对不同提取方法制备的蚕蛹毛油,分别收集各精制阶段的蛹油样品,测定其色差的变化,具体结果如表2所示。由表2可以看出,随着精制过程的进行,2种方式提取的蛹油均呈现L*值逐渐增大,b*值逐渐减少,a*值则呈现先减小后增大的趋势,说明精制过程会逐步增加蛹油的亮度,减少黄色,绿色先呈现增加,在脱色阶段后又大幅减少,这是由于精制过程会使油样中的蛋白质、糖类、磷脂和色素等成分被脱除,特别是脱色阶段,在吸附剂的作用下蛹油中的天然色素(包括类胡萝卜素、叶黄素等)大量减少,b*值(黄色)下降明显,油脂变得更加澄清透明。

表2 精制对蚕蛹油色差的影响
注:同列含有相同字母表示差异不显著(P>0.05 ),下同。
2.2 精制对蚕蛹油抗氧化能力的影响
以FRAP、DPPH、TPC和TCC为抗氧化评估指标,分别测定不同提取方法制备的蚕蛹油精制过程中的各抗氧化水平,结果见表3和图1。

表3 精制对蚕蛹油抗氧化活性的影响
Duncan分析可以看出,2种不同提取方法制备的蚕蛹油精制阶段的FRAP、DPPH、TPC和TCC水平存在显著性差异,这是由于原料、环境和提取工艺等因素的差异造成。而超临界萃取(模式2)的蚕蛹毛油的抗氧化能力明显高于正己烷提取(模式1),其中模式2 FRAP=131.19>模式1 FRAP=52.53,模式2 TPC=18.85>模式1 TPC=11.08,模式2 TCC=22.73>模式1 TCC=17.09,可以预测模式2的提取工艺优于模式1,这是由于超临界萃取工艺的高浓度CO2和低温环境对蛹油起到了很好的保护作用,降低了蚕蛹油的氧化程度。
结合图1可以看出,随着精制阶段的进行,各抗氧化水平基本呈下降趋势,说明精制过程导致蚕蛹油的抗氧化性能逐步降低,特别是脱色阶段,在脱除色素的同时带走了大量的抗氧化成分(包括酚类和类胡萝卜素),影响蚕蛹油的氧化稳定性。以FRAP指标为例,精制过程中造成2种途径制备的蛹油总抗氧化能力损失高达45.57%~71.51%,总酚损失24.73%~65.14%,类胡萝卜素损失12.0%~69.27%。酚类和类胡萝卜素是油脂的2类重要的天然抗氧化剂,脱色阶段造成正己烷组的TPC和TCC损失分别达到9.57%和23.17%,造成超临界组的TPC和TCC损失分别达到29.12%和17.25%,从而影响蚕蛹油后期加工和储藏的稳定性,因此补充外源性抗氧化剂对蚕蛹油的保存具有重要意义。

图1 精制过程对FRAP、DPPH、TPC和TCC的影响
2.3 相关性分析
对精制各阶段蚕蛹油的抗氧化评估结果进行相关性分析,结果见表4,其中FRAP与TPC和TCC之间存在极显著相关(r分别为0.965和0.803),DPPH与TPC之间存在显著相关,与TCC之间存在极显著相关(r分别为0.734和0.894),而FRAP与DPPH间相关性不显著(r为0.6),从而说明FRAP和DPPH 2种评价体系评估蚕蛹油的抗氧化能力各有侧重点,FRAP与TPC相关性较大,DPPH与TCC相关性较大,这可能与各自的抗氧化机理不同有关,FRAP体系倾向于评价还原金属离子的能力,DPPH体系则倾向于评价清除自由基的能力。但总体来讲,蚕蛹油的抗氧化能力与自身存在的总酚和类胡萝卜素的含量密切相关。

表4 蛹油抗氧化结果的相关性分析
注:**表示P< 0.01 的水平,*表示P<0.05 的水平。
2.4 主成分分析
对不同蛹油样品的4项抗氧化水平进行主成分分析,得到4个主成分见表5,其中第1主成分的特征值高达3.463,方差贡献率为86.564%,其他3个主成分(PC2,PC3和PC4)的特征值逐渐减小(<1;分别为0.472,0.056和0.009),不能很好地描述其抗氧化能力,因此选用前2个主成分用于接下来的因子分析。主成分1与4个变量间均呈正相关性:TPC(0.974)、TCC(0.971)、FRAP(0.909)、DPPH(0.864),而且DPPH(0.488)和TCC(0.159)对主成分2的贡献率较高。

表5 主成分分析表
由系数矩阵将2个公因子表示为4个指标的线性形式,因子得分函数分别为:
PC1=0.769ZX1-0.509ZX2+0.513ZX3-0.018X4
PC2=-0.458ZX1+0.933ZX2-0.148ZX3+0.438ZX4
以主成分1为X轴,主成分2为Y轴做4个变量的因子得分函数如图2,由对应分析图的规律可知:Z1、Z2、Z3靠的较近,而C1、C2、C3靠的较近,且二者之间没有明显交集,说明正己烷提取和超临界萃取2种工艺制备的蚕蛹油在脱色工艺前的抗氧化能力差异较大,但2种制备的毛油经脱胶、脱酸工艺后其各自的抗氧化能力变化并不大;Z4、Z5、C4、C5靠的非常近,具有明显的关联性,说明2种方法制备的蚕蛹油在精制工艺(尤其是脱色)后总抗氧化能力趋向同一水平。

图2 因子得分分析图
3 结论
3.1 色差分析表明,精制过程会逐步增加蛹油的亮度,减少黄色,绿色先呈现增加,在脱色阶段后又大幅减少,精制工艺后蛹油色泽淡黄、澄清透明。
3.2 超临界CO2萃取的蚕蛹油氧化稳定性明显优于正己烷浸提的蚕蛹油,随着精制过程的进行,蚕蛹油自身抗氧化成分酚类和类胡萝卜素逐步减少,蚕蛹油的抗氧化能力也逐步降低。精制过程中造成2种途径获得的蛹油总抗氧化能力损失高达45.57%~71.51%,总酚损失24.73%~65.14%,类胡萝卜素损失12.0%~69.27%,其中脱色阶段损失最为显著。
3.3 相关性分析发现,蚕蛹油的抗氧化活性与总酚和类胡萝卜素的含量密切相关,而总抗氧化能力FRAP与DPPH清除率之间的相关性不显著;主成分分析发现,溶剂提取和超临界萃取2种工艺制备的蚕蛹毛油氧化稳定性差异较大,但经精制处理后,二者的抗氧化能力又大幅下降至同一水平。
[1]Loria R M, Padgett D A. α-Linolenic acid prevents the hypercholesteremic effects of cholesterol addition to a corn oil diet[J]. The Journal of Nutritional Biochemistry, 1997, 8(3): 140-146
[2]Biglari F, AlKarkhi A F M, Easa A M. Antioxidant activity and phenolic content of various date palm (Phoenix dactylifera) fruits from Iran[J]. Food Chemistry, 2008, 107(4): 1636-1641
[3]Davarnejad R, Kassim K M, Zainal A, et al. Supercritical fluid extraction of β-carotene from crude palm oil using CO2[J]. Journal of Food Engineering, 2008, 89(4): 472-478
[4]Fernandez R X E, Shier N W, Watkins B A. Effect of alkali saponification, enzymatic hydrolysis and storage time on the total carotenoid concentration of Costa Rican crude palm oil[J]. Journal of Food Composition and Analysis, 2000, 13(2): 179-187
[6]Neo Y P, Ariffin A, Tan C P, et al. Phenolic acid analysis and antioxidant activity assessment of oil palm (E. guineensis) fruit extracts[J]. Food Chemistry, 2010, 122(1):353-359
[7]Chan K W, Ismail M. Supercritical carbon dioxide fluid extraction of Hibiscus cannabinus L. seed oil:A potential solvent-free and high antioxidative edible oil[J]. Food Chemistry, 2009, 114(3): 970-975
[8]郭无瑕, 胡建恩, 王秀武, 等. 鱿鱼肝脏鱼油的制备及其脂肪酸组成分析[J]. 大连水产学院学报, 2007, 22(1): 77-80
[9]刘玉兰. 油脂制取与加工工艺学[M].北京:科学出版社, 2003:383-386
[10]郭华, 罗军武, 周建平. 茶籽油的超临界 CO2萃取[J]. 现代食品科技, 2008, 23(12): 40-43
[11]Benzie I F F, Strain J J. The ferric reducing ability of plasma (FRAP) as a measure of “antioxidant power”: the FRAP assay[J]. Analytical Biochemistry, 1996, 239(1): 70-76
[13]何志勇,橄榄酚类化的分离纯化和结构研究[D]. 无锡:江南大学,2007
[14]Ranjith A, Kumar K S, Venugopalan V V, et al. Fatty acids, tocols, and carotenoids in pulp oil of three sea buckthorn species (Hippophae rhamnoides, H. salicifolia, and H. tibetana) grown in the Indian Himalayas[J]. Journal of the American Oil Chemists' Society, 2006, 83(4):359-364.
The Effect of Refining Processes on Antioxidant Activity of Silkworm Pupa Oil
Liu Jun Zheng Cuicui Liao Sentai Zou Yuxiao Shi Ying Mu Lixia Lin Guangyue
(Sericultural & Agri-Food Research Institute Guangdong Academy of Agricultural Sciences/Key Laboratory of Functional Foods, Ministry of Agriculture/ Guangdong Key Laboratory of Agricultural Products Processing, Guangzhou 510610)
Supercritical CO2fluid extraction (SFE) and solvent extraction were used to extract crude oil in silkworm pupa. During refining processes of degumming, deacidification, decoloration and deodorization, oil samples in each stage were collected to determine their color changes and evaluate the antioxidant capacity with different antioxidant measuring methods including FRAP, DPPH clearance, TPC and TCC. In addition, correlation and principal component analysis of different levels of antioxidant capacity were run. The experimental results showed that antioxidant activity of silkworm pupa oil from SFE was superior to N-hexane clearly. During the refining process, brightness of silkworm pupa oil increased, but yellow decreased, antioxidant ingredients lost and oxidation stability also decreased gradually. The refining process of silkworm pupa oil from two ways caused 24.73%~65.14% losses of TAC, 12.0%~69.27% losses of TCC, especially the highest losses during decoloring step. Correlation analysis found that antioxidant capacity of silkworm chrysalis oil was closely related to the contents of total phenol and carotenoids, but no significant correlation between FRAP and DPPH clearance was found. Principal component analysis suggested that, antioxidant activity of crude oil from SFE and solvent extraction had big differences, but after refining treatment, both total antioxidant capacity decreased to the same level significantly.
silkworm pupa oil, extraction, refining, antioxidation
Q5R91
A
1003-0174(2016)04-0051-06
公益性行业(农业)科研专项(201403064),现代农业产业技术体系专项(CARS-22),国家科技支撑计划(2013BAD16B00)
2014-08-07
刘军,男,1981年出生,助理研究员,农产品加工与贮藏

