玉米直链淀粉的分离与鉴定
钟雨越 张旭东 石涵羽 刘林三 吴权明 张仁和 徐淑兔 薛吉全 郭东伟
(西北农林科技大学农学院 农业部西北旱区玉米生物学与遗传育种重点实验室,杨凌 712100)
玉米直链淀粉的分离与鉴定
钟雨越 张旭东 石涵羽 刘林三 吴权明 张仁和 徐淑兔 薛吉全 郭东伟
(西北农林科技大学农学院 农业部西北旱区玉米生物学与遗传育种重点实验室,杨凌 712100)
以高直链玉米淀粉和普通玉米淀粉为原料,比较凝沉法等5种提取方法在直链淀粉提取效率及品质上的差异。结果表明:在同一提取方法下,不同淀粉原料的直链淀粉平均提取率无明显差异;利用同种淀粉原料,5种提取方法中以蒸馏分散法和DMSO盐析法提取率最高,分别为33.22%和34.67%;高速凝沉法提取率最低,为16.36%。不同提取方法获得的直链淀粉在蓝值、吸收光谱、扫描电镜(SEM)、X射线衍射(XRD)5个纯度参数上存在差异;提取率高的方法获得的直链淀粉往往纯度偏低,提取率低的方法获得的直链淀粉纯度高。综合考虑认为,高转速凝沉法和二甲基亚砜(DMSO)分散法优于其他3种方法。虽然提取率略低,但纯度更高。
高直链玉米淀粉 直链淀粉 分离 纯度 鉴定
直链淀粉是淀粉的重要组成部分,其含量对淀粉的分子结构、物理化学性质、加工特性有着重要影响。直链淀粉在食品加工过程中形成的抗性淀粉在小肠中难以被消化,使其具有了类似膳食纤维的生理功效[1],能选择性地促进肠内有益菌(如双歧杆菌)的生长繁殖,抑制结肠癌的发生[2]。另外,高直链淀粉(直链淀粉质量分数大于50%的淀粉)食品能够减少餐后血糖和胰岛素响应,降低血浆胆固醇和甘油三酯的浓度,因此,是糖尿病人的理想食品,被称为“功能性食品”[3]。在食品工业领域,用高直链玉米淀粉制成的低脂食品具有很好的流变学特性及稳定性,与全脂奶油产品具有相同的口感,因此可当作冰淇淋及蛋糕中脂肪的代替物[4]。此外,直链淀粉具有较好的抗拉伸性能,可取代聚苯乙烯用来生产光降解塑料,从而应用于包装业和薄膜加工业,有助于解决目前日益严重的“白色污染”[5]。
目前,市场上的直链淀粉主要从普通淀粉中提取,提取率低,而真正商品化的高纯直链淀粉仍鲜有出售,这极大限制了直链淀粉的加工和应用。为此,本试验以自育的高直链淀粉玉米为原料,采用凝沉法(低转速、高转速)、蒸馏法、DMSO法(分散、盐析法)等5种常用方法来提取直链淀粉,并且从提取率、蓝值、碘-淀粉复合物吸收光谱、扫描电子显微镜分析、晶体特性等方面比较5种方法的优劣,以期为直链淀粉的规模化生产提供参考。
1 材料与方法
1.1 材料
1.2 方法
1.2.1 高直链玉米淀粉的提取
玉米籽粒去除胚芽及种皮,加水研磨成糊后,经100 μm尼龙网过滤至50 mL离心管, 2 000 r/min离心15 min,弃上清,加0.5%的NaOH溶液20 mL静置4 h,4 000 r/min离心10 min, NaOH溶液重复洗涤至上清无色,沉淀加5 mL丙酮4 000 r/min离心10 min,去上清,通风橱内自然干燥后备用。
1.2.2 直链淀粉的提取
1.2.2.1 凝沉分离法
参考洪雁等的方法[6],取原料淀粉5 g,依次加入2 mL无水乙醇和350 mL 0.5 moL/L的氢氧化钠,沸水浴中搅拌10 min,冷却至室温后置于-20 ℃冷冻24 h,8 000 r/min高速离心15 min, HCl溶液中和至中性,加10 mL丁醇-异戊醇(3∶1)混合液,沸水浴搅拌10 min,冷却至室温,4 ℃静置24 h,4 000 r/min离心10 min,沉淀移入丁醇饱和水溶液,加热溶解至溶液透明,冷却至室温后4 ℃静置24 h,分别以4 000r/min(低转速)和8 000 r/min(高转速)离心,沉淀同法纯化6次后,再依次用70 %乙醇、95 %乙醇和无水乙醇各洗涤3次,沉淀于真空冷冻干燥仪中干燥24 h备用。
1.2.2.2 蒸馏分散法
参考Liu等[7]的方法,称量淀粉5 g于烧杯中,加蒸馏水100 mL,沸水浴中搅拌至凝胶状,冷却到50 ℃时,用磷酸缓冲液调 pH到6.5,于100 ℃蒸煮3 h后在沸水浴中搅拌样品2 h。将样品转移到1 000 mL圆底烧瓶并加适量正丁醇回流1 h。当样品冷却到50 ℃,将圆底烧瓶取出,自然冷却过夜。溶液转移到50 mL离心管, 8 000 r/min离心30 min。弃上清,沉淀转移到1 000 mL圆底烧瓶,加正丁醇80 mL回流1 h。重复离心和回流2次。去上清,沉淀在真空冷冻干燥机中干燥24 h备用。
1.2.2.3 DMSO分散法
参考杨泽敏等[8]的方法,5 g淀粉加入适量DMSO后置于全温摇瓶柜中缓缓搅动24 h,2 000 r/min离心15 min。取上清液注入2倍体积正丁醇,静止24 h,4 000 r/min离心10 min。正丁醇洗涤沉淀3次,转入足量水中,加热至完全溶解,自然冷却至60 ℃时加8 g百里酚,室温放置3 d,4 000 r/min离心15 min。沉淀转入足量水中,加热至完全溶解,冷却后加入正丁醇10 mL,室内静置24 h,2 000 r/min离心10 min,无水乙醇洗涤3次,沉淀真空冷冻干燥机中干燥24 h获得直链淀粉。
经济学家利用博弈模型比较独立研发和合作研发的市场绩效,从而揭示企业从事合作研发的条件和内在机理。他们主要从三个维度展开比较:企业的研发投资量、产品市场势力、利润和社会福利。他们的基本观点是,技术溢出(technology spillover)是减少企业研发投入的主要原因,而合作研发可以克服这一缺陷。1998年之前的早期研究模型抽象,假设条件苛刻。而之后的近期模型放松了假定条件同时拓展了研究对象,研究朝着更为具体和细致的方向发展,也更具应用性。
1.2.2.4 DMSO盐析法
5 g淀粉加入40 mL DMSO和10 mL去离子水,搅拌至乳液状转移至60 ℃恒温水浴,持续搅拌30 min后, 移除水浴,加10 mL正丁醇,混匀后冷却至室温,待溶液中析出细针型沉淀,2 000 r/min离心30 min,去上清,沉淀加10 mL 2% NaCl,振荡混匀,缓慢加入10 mL正丁醇,涡旋混匀后,2 000 r/min离心30 min,重复结晶过程6次,真空冷冻干燥机中干燥24 h备用。
1.3 直链淀粉质量测定
直链淀粉提取率=直链淀粉质量/原淀粉质量(干基)。
蓝值(mg/100 mL)测定:配制直链淀粉、支链淀粉和CK标准对照后,进行测定[9-11]。
蓝值=A×4/样品的浓度
碘-淀粉复合物吸收光谱:以蓝值测定所用的标准溶液于500~800 nm进行连续光谱扫描分析。
晶体特性的测定:X-衍射条件:Cuka辐射,管压40 kV,管流40 mA,扫描速度4 (°)/min。淀粉样品粉碎后通过60目筛。
扫描电子显微镜(SEM)分析:将干燥样品充分混合,均匀黏附于样品台表面,离子溅射仪喷金固定8 min,扫描电子显微镜(HITACHI SN3500)检测成像。
2 结果与讨论
2.1 原料及方法对提取率的影响
结果如表1所示,不同方法的提取率存在显著差异。以DMSO盐析法和蒸馏分散法最高,当分别用普通玉米淀粉和高直链淀粉为原料时,提取率依次为22.67%、22.70%和46.67%、43.73%,显著高于其他3种方法。以高速凝沉法提取率最低,平均提取率仅16.36%。以从普通淀粉(相对直链淀粉质量分数25%)和高直链淀粉(相对直链淀粉质量分数53%)实际抽提直链淀粉的量占这2种淀粉中总直链淀粉量(分别为1.25、2.65 g)的百分比计算直链淀粉提取率时,普通淀粉5种方法的平均提取率为63.46%,高直链淀粉为64.88%,二者在提取率上没有明显差异。这说明高直链淀粉中,直链淀粉在淀粉粒中的分布方式可能与普通淀粉类似,这种直链淀粉含量的差异并未对直链淀粉的提取率带来明显影响。
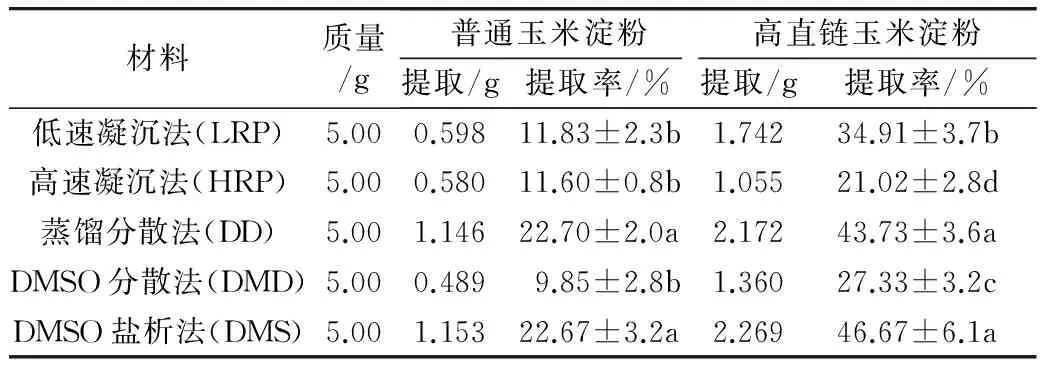
表1 普通玉米淀粉和高直链玉米淀粉的直链淀粉提取率
注:所有数据均为3次重复的平均值。不同字母表示差异显著(P<0.05)。
2.2 不同提取方法对直链淀粉蓝值的影响
蓝值是表征直链淀粉纯度的重要指标之一,它体现了淀粉与碘的结合能力。通常线性聚合度越高,蓝值越高。理论上直链淀粉蓝值在0.8~1.2之间,本研究中,不同方法提取的直链淀粉蓝值在0.78~1.11间,LRP法的蓝值为0.78,HRP的蓝值为0.84,DD的蓝值为0.83,DMD的蓝值为1.11,DMS的蓝值为0.91,均低于对照马铃薯直链淀粉1.19的蓝值。其中以DMSO分散法提取的直链淀粉蓝值与马铃薯标准直链淀粉的蓝值最相近,表明此法获得的直链淀粉纯度较高,以高转速凝沉法和DMSO盐析法提取的直链淀粉蓝值次之,分别达到0.94和0.91。低转速凝沉法的蓝值最低为0.78,表明此法获得的直链淀粉纯度低于其他方法。

图1 不同方法提取直链淀粉的蓝值
2.3 不同提取方法对直链淀粉吸收光谱的影响
利用直链淀粉和支链淀粉与碘形成的复合物在紫外分光光度计扫描下形成的最大吸收波长差异也可进行直链淀粉纯度判定。研究表明,直链淀粉-碘复合物吸收峰通常在600~680 nm之间,而直链淀粉的最大吸收波长为630 nm[12-14]。图2展示了5种方法提取玉米直链淀粉及对照马铃薯直链淀粉的全波长扫描光谱图。其中对照马铃薯直链淀粉的吸收波长峰值为628 nm,最接近630 nm的标准值;其次为高转速凝沉法和DMSO分散法提取直链淀粉的吸收波长峰值,约为623 nm,表明这2种方法提取的直链淀粉纯度较高;其余3种方法获得的直链淀粉吸收波长峰值在600 nm左右,这可能是由于这3种方法提取的直链淀粉中掺杂有支链淀粉、蛋白等杂质。

注:1低转速凝沉法,2 高转速凝沉法,3 蒸馏分散法,4 DMSO分散法,5 DMSO盐析法。
图2 不同方法提取直链淀粉的吸收光谱
2.4 不同提取方法对直链淀粉晶体特性的影响
X射线衍射(XRD)是分析晶体结构的有效方法之一。淀粉颗粒的X晶体衍射图谱上在多处衍射角存在吸收峰,代表了淀粉的结晶区域,根据2θ角衍射峰的分布可将原淀粉的晶体结构划分为A、B和C型。当淀粉经过变性处理时,原有晶体结构被破坏并发生重结晶,晶体结构会变为V型[15]。图3的检测结果表明,提取方法及材料来源对淀粉粒的晶体类型存在显著影响,自提直链淀粉与对照马铃薯直链淀粉结晶构型均不同于原淀粉普通淀粉的A构型和高直链淀粉的B构型,属于重结晶的V构型,它们均在21°、23°、27°左右出现明显的衍射峰,而2种沉降法、蒸馏分散法和DMSO分散法4种方法提取的直链淀粉还在7°、13°附近出现明显的衍射峰,这与Bail等[16]报道的热熔淀粉的重结晶构型一致,属于Vh型晶体。
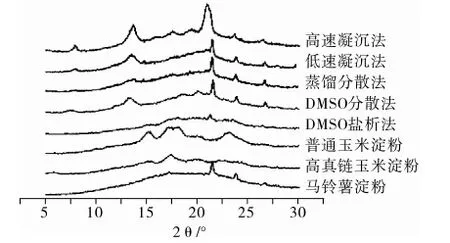
图3 5种方法提取直链淀粉的X射线衍射图谱
只有DMSO盐析法得到的淀粉构型与对照马铃薯直链淀粉的构型最接近,没有7°、13°附近的衍射峰,这说明对照马铃薯淀粉可能也是通过相同方法提取。X射线衍射图谱中衍射峰峰下区域的面积代表了晶体内非结晶区部分的比例,而峰面积代表了结晶区,因此晶体的结晶度随衍射峰的数量、宽度和高度的增高而增高[17]。根据表2的统计数据可以看出,在原淀粉中高直链淀粉的结晶度为15.48%明显低于普通淀粉的18.6%,这说明直链淀粉含量的增加和支链淀粉的减少改变了淀粉粒的构架组成,使淀粉的结晶度降低,这一结果与前人报道一致[16-17]。自提直链淀粉中以DMS法的结晶度最低仅为1.88%,也低于对照马铃薯淀粉2.34%的结晶度,其他4种方法提取的直链淀粉结晶度在18.60%~22.66%之间。
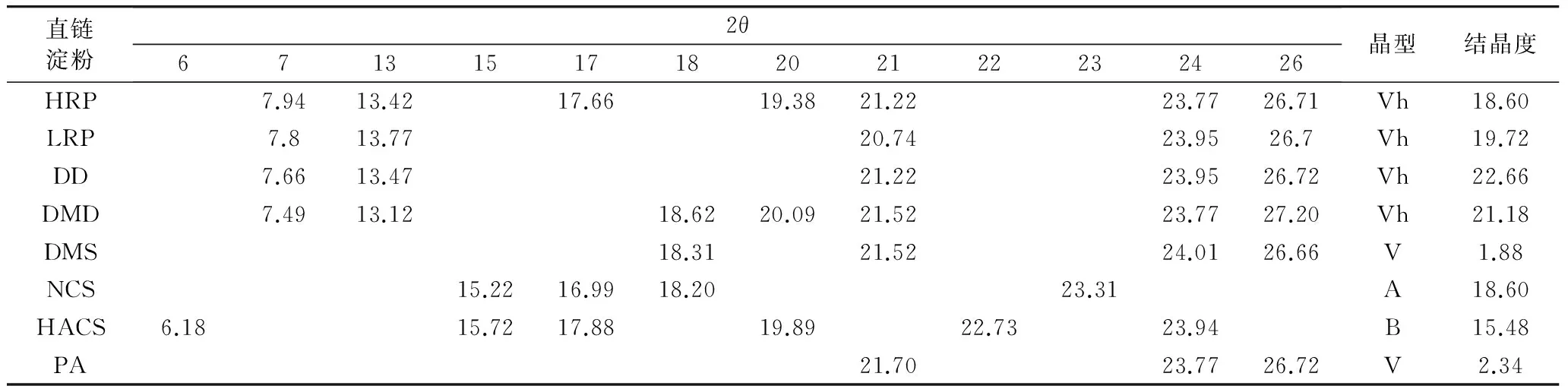
表2 不同方法提取直链淀粉的X晶体衍射参数
注:NCS 普通玉米淀粉;HACS 高直链玉米淀粉;PA 马铃薯直链淀粉。
2.5 不同来源直链淀粉SEM表观特征分析
SEM图是表征颗粒表面形貌的有效手段,以扫描电镜观察原淀粉及提取直链淀粉颗粒的表面形貌如图4所示,原淀粉和提取直链淀粉颗粒的表面形貌存在很大差异,普通玉米原淀粉多呈球状(B型颗粒直径<10 μm)或多面体状(A型颗粒直径>10 μm),饱满,表面有蜡质光泽(图4a)。高直链原淀粉颗粒则扭曲呈不规则形状,存在一定程度的皱缩,且在A型颗粒上发生的皱缩和扭曲程度似乎高于B型颗粒,淀粉粒表面也存在蜡质光泽(图4b),这与前人的研究结果一致[18-19]。理论上直链淀粉以线性大分子形式沉积于支链淀粉形成的骨架之间,当直链淀粉被析出或分散到提取体系中后,原有的淀粉颗粒结构被完全破坏,这些直链淀粉在正丁醇等凝沉剂的作用下,相互缠绕沉积成无固定形状的沉积物,经过脱水干燥等处理后,外观呈现白色的片层状颗粒,其SEM图片如图4c~图4g所示,颗粒呈现不规则形状,有明显的层状沉积痕迹,不同提取方法来源的直链淀粉颗粒仍然呈现一定程度的蜡质质感,不同提取方法间无可见差异。其结构特征均与对照马铃薯直链淀粉相似(图4h)。

图4 提取直链淀粉SEM图
3 讨论
目前实验室中常用的直链淀粉的提取方法主要有凝沉法、分散法和盐析法,提取过程中的离心时间和速度对直链淀粉的提取质量均有较大影响。李德海等[20]以玉米淀粉为材料,用凝沉法提取直链淀粉时发现: 8 000~8 500 r/min是提取直链淀粉的最适转速,在4 000 r/min条件下得到的直链淀粉的蓝值仅为0.8,远低于8 000 r/min的蓝值,这与本研究结果一致。蒸馏、DMSO试剂都可以使淀粉分散。蒸馏法多适用与马铃薯直链淀粉提取,曾凡逵等[21]就以马铃薯为材料,使用蒸馏分散法得到吸收光谱峰值为630 nm的标准直链淀粉。杨泽敏等[8]曾用DMSO分散法提取水稻直链淀粉,却少见于玉米直链淀粉的提取。试验证明,DMSO分散法适用于提取玉米直链淀粉,对蓝值、吸收光谱以及结晶度等的分析表明该方法得到的玉米直链淀粉具有很高纯度。
XRD衍射法是检测颗粒晶体类型的常规方法,根据前人的研究原淀粉的晶体类型可分为A、B、C 3种,影响淀粉晶体结构的因素很多,如来源、淀粉组成、加工方式等。禾谷类作物淀粉通常为A型,马铃薯等块根类淀粉多为B型晶体,而豌豆、荸荠等淀粉为C型晶体;直链淀粉含量也影响淀粉的晶体结构,Norman等[14]研究了不同直链淀粉含量的玉米淀粉的X射线晶体衍射图谱,结果表明:随着直链淀粉含量的增加,玉米淀粉的晶体结构表现为一个由A型经C型转变为B型晶体的过程,当直链淀粉质量分数低于40%时,玉米淀粉为典型的A型晶体,直链淀粉质量分数超过50%,淀粉的晶体结构为典型的B型。当直链淀粉被析出凝沉时,会发生重结晶,重结晶后的直链淀粉晶体结构完全不同于原淀粉的晶体结构。熊善柏等[25]测量了水稻直链淀粉的晶体特征,发现水稻直链淀粉在2θ角13°和20°左右存在明显衍射峰,结晶度在24.99%~23.10%之间,而支链淀粉只在20°处有明显吸收峰。这与研究结果存在一定差异,除13°和20°外,在7°和23°亦出现了吸收峰。但杜先锋等[26]的研究中,葛根的直链淀粉在7°和23°也存在吸收峰,说明直链淀粉来源对晶体特征也存在影响。
4 结论
不同直链淀粉含量的淀粉原料不影响直链淀粉的提取率。在5种提取方法中,高转速凝沉分离法和二甲基亚砜(DMSO)分散法虽然提取率略低,但在蓝值、吸收波峰、电镜图像、结晶度等参数上优于其他3种方法。
[1]Park O J, Kang N E, Chang M J. Resistant starch supplementation influences blood lipid concentrations and glucose control in overweight subjects[J]. J Nutr Sci vitaminol(Tokyo), 2004, 50(2): 93-9
[2]王晓睿. 非淀粉多糖和抗性淀粉在断奶仔猪日粮中的应用研究[D]. 保定:河北农业大学,2004
Wang Xiaorui. Studies on Application of Non-starch Polysaccharides and resistant Starch in the Diets of Young Weaned Piglets[D].Baoding: Agricultural University of Hebei,2004
[3]吴建平. 抗消化淀粉的研究进展及其应用前景[J]. 食品与发酵工业, 1999, 25 (2): 66-70
Wu Jianping. Advances in the Research of Resist Starch and Its Prospective Uses[J]. Food and Fermentation Industries, 1999, 25(2): 66-70
[4]王中荣, 刘雄. 高直链淀粉性质及其应用研究[J]. 粮食与油脂, 2005(11) : 10-13
Wang Zhongrong, Liu Xiong. Study On Properties and Application of High Amylose Starch.Cereals and Oils,2005(11):10-13
[5]王振斌. 高直链淀粉玉米的应用前景及展望[J]. 科技致富向导, 2013, 11(16) : 103
Wang Zhenbin. Advances and Prospects of High Amylose Corn Starch[J]. Guide of Sci-tech Magazine, 2013, 11(16) : 103
[6]洪雁, 顾正彪,刘晓欣. 直链淀粉和支链淀粉纯品的提取及其鉴定[J]. 食品工业科技, 2004(4): 86-88
Hong Yan, Gu Zhengbiao, Liu Xiaoxin. Extraction and evaluation of amylose and amylopectin[J]. Science and Technology of Food Industry, 2004(4): 86-88
[7]Liu Q, Donner E, Tarn R, et al. Advanced analytical techniques to evaluate the quality of potato and potato starch[J]. Advances in potato chemistry and technology, 2009(8):221-248
[8]杨泽敏, 王维金, 蓝盛银, 等. 稻米三种淀粉成分的分离及其蒸煮前后的结构差异[J]. 电子显微学报, 2003, 22(4): 286-292
Yang Zemin, Wang Weijin, Lan Shengyin, et al. Separation of three types of starch fractions in rice and the microstructures of endosperms before and after gelatinization[J]. Journal of Chinese Electron Microscopy Society, 2003, 22(4): 286-292
[9]Schoch T J. Methods in carbohydrate chemistry IV starch New York and London[J]. Academic Process, 1964: 157-160
[10]Hizukuri S J. Recent advances in molecular structures of starch[J]. Jpn starch Sci, 1988, 35(3): 185-198
[11]Hizukuri S. Polymodal distribution of the chain lengths of amylopectins and its significance[J]. Carbohydrate Research, 1986, 147: 342-347
[12]Krishnaswamy K G, Sreenivasan A. Separation and determinination of the amylose and amylopetin fractions of starch [J]. Amylose and Amylopectin Starch Fractions, 1948, 176: 1253-1261
[13]谢涛, 陈建华, 谢碧霞. 橡实直链淀粉与支链淀粉的分离纯化[J]. 中南林学院学报, 2002, 22(2): 30-35
Xie Tao, Chen Jianhua, Xie Bixia. The separation and purification of amylose and amylopectin from acorn starch[J]. Journal of Central South Forestry University, 2002, 22(2): 30-35
[14]张娟, 唐文凭, 王正武, 等. 芭蕉芋淀粉和直链淀粉提取、分离、鉴定及含量测定[J]. 食品科学, 2008, 9: 303
Zhang Juan, Tang Wenping, Wang Zhengwu, et al. Extraction, purification, characterization and content determination of starch and amyloe from canna edulis ker, growing in China[J]. Food Science, 2008, 9: 303
[15]Cheetham Norman W H, Tao L P. Variation in crystalline type with amylose content in maize starch granules: an X-ray powder diffraction study[J]. Carbohydrate Polymers, 1998, 36: 277-284
[16]Bail Le P, Bizot H, Ollivon M, et al. Monitoring the crystallization of amylose-lipid complexes during maize starch melting by synchrotron X-ray diffraction[J]. Biopolymers, 1999, 50: 99-110
[17]满建民, 蔡金文, 徐斌, 等. 作物淀粉晶体结构的波谱分析[J]. 作物学报, 2012, 38(4): 691-698
Man Jianmin, Cai Jinwen, Xu Bin, et al. Spectrum analysis of crystalline structure of crop starches[J]. Acta Agronomica Sinica, 2012, 38(4): 691-698
[18]李志伟, 钟雨越, 吴权明, 等. 高直链淀粉玉米淀粉的理化特性研究[J]. 西北农林科技大学学报, 2014, 7(6): 39-43
Li Zhiwei, Zhong Yuyue, Wu Quanming, et al. Physicochemical properties of high-amylose maize strach[J]. Journal of Northwest A&F University, 2014, 7(6): 39-43
[19]陈培荣, 朱苏文, 杜先锋, 等. 高直链玉米淀粉颗粒的形貌与结构[J]. 高分子材料科学与工程, 2009, 25(12): 100-102
Chen Peirong, Zhu Suwen, Du Xianfeng, et al. The granule morphology and structure of high amylose maize starch[J]. Polymer Materials Science & Engineering, 2009, 25(12): 100-102
[20]李德海, 马莺. 玉米淀粉组分的分离及特性[J]. 食品工业科技, 2011, 5: 122
Li Dehai, Ma Ying. Separation and characteristic of the component of corn starch[J]. Science and Technology of Food Industry, 2011, 5: 122
[21]曾凡逵, 赵鑫, 周添红, 等. 马铃薯直链/支链淀粉的分离[J]. 现代食品科技, 2011, 27: 12
Zeng Fankui, Zhao Xin, Zhou Tianhong, et al. Separation of potato Amylose and Amylopectin[J]. Modern Food Science & Technology, 2011, 27: 12
[22]高炜丽, 赵燕, 李建科. 丁醇沉淀法分离粗直链淀粉的研究[J]. 食品科学, 2007, 9: 271
Gao Weili, Zhao Yan, Li Jianke. Study on separating coarse amylose by butanol precipitation[J]. Food Science, 2007, 9: 271
[23]夏慧玲, 王水兴, 潘阳. 红薯直链淀粉的分离纯化和检测[J]. 食品研究与开发, 2006,27(11): 47-49
Xia Huiling, Wang Shuixing, Pan Yang. The Separation and purification of amylose from potato starch[J]. Food Research and Development, 2006,27(11): 47-49
[24]张娟, 唐文凭, 王正武, 等. 芭蕉芋淀粉和直链淀粉提取、分离、鉴定及含量测定[J].食品科学, 2008, 9:303-30
Zhang Juan, Tang Wenping, Wang Zhengwu, et al. Extraction, purification, characterization and cogent determination of starch and amylose from canna edulis ker. growing in China[J]. Food Science, 2008, 9: 303-30
[25]熊善柏, 赵思明, 张声华. 稻米淀粉的理化特性研究Ⅱ稻米直链淀粉和支链淀粉的理化特性[J]. 中国粮油学报, 2003, l8(2): 5-8
Xiong Shanbo, Zhao Siming, Zhang Shenghua. Study on the physicochemical properties of rice amylose and amylopectin[J]. Journal of the Chinese Cereals and Oils Association, 2003, l8(2): 5-8
[26]杜先锋, 许时婴, 王璋. 葛根直链淀粉和支链淀粉分离纯化的研究[J]. 食品与发酵工艺, 1998, 424: 18-21
Du Xianfeng, Xu Shiyin, Wang Zhang. Separation and purification of amylose and amylopectin from pueraria lobata ohwi starch[J]. Food and Fermentation Industries, 1998, 424: 18-21.
The Isolation and Identification of Maize Amylose
Zhong Yuyue Zhang Xudong Shi Hanyu Liu Linsan Wu Quanming Zhang Renhe Xu Shutu Xue Jiquan Guo Dongwei
(The Key Laboratory of Biology and Genetic Improvement of Maize in Arid Area of Northwest Region, Ministry of Agriculture,College of Agronomy, Northwest A&F University, Yangling 712100)
In this paper, five methods including precipitation separation, etc. were employed to isolate amylose from maize high-amylose starch and normal starch. Differences in extraction efficiency and quality were compared. The results showed that there is no obvious difference in the average extraction rate of five extraction methods between maize high-amylose starch and normal starch. Distillation dispersion method and DMSO salting out method had the highest extraction rate (33.22% and 34.67%), while high-rpm precipitation seperation method had the lowest extraction rate of 16.36%. In addition, there were obvious differences in five Purity parameters: blue value, absorption spectrum, SEM and XRD of amylose derived from different isolation method. In conclusion, despite of low extraction rates by precipitation separation method and DMSO dispersion method, the purity of amylose extracted by them is higher than the purity by using remaining three methods.
high-amylose maize starch,amylose,isolation,purity,identification
TS201
A
1003-0174(2016)10-0039-06
时间:2016-09-30 10:48:27
网络出版地址:http://www.cnki.net/kcms/detail/11.2864.TS.20160930.1048.002.html
杨凌示范区科技计划(2014NY-01),陕西省现代农业专项(K33202135),陕西省科技统筹专项(2015KT ZDNY01-01-01)
2015-06-30
钟雨越,男,1993年出生,硕士,作物遗传育种
郭东伟,男,1973年出生,副教授,高直链淀粉玉米育种

