玉米淀粉和黄浆发酵罗耳阿太菌双响应值优化
张桂弘 李鸿梅 魏 明 闵伟红
(吉林农业大学食品科学与工程学院,长春 130118)
玉米淀粉和黄浆发酵罗耳阿太菌双响应值优化
张桂弘 李鸿梅 魏 明 闵伟红
(吉林农业大学食品科学与工程学院,长春 130118)
为获得罗耳阿太菌β-1,3葡聚糖酶和胞外多糖同时高产的发酵条件,以玉米淀粉和玉米黄浆作为发酵培养基的重要组分,以罗耳阿太菌β-1,3葡聚糖酶产量和胞外多糖产量为指标,选择培养温度、培养时间、摇床转速为优化因素,在单因素试验的基础上,通过响应面试验进行双响应值优化,对所得结果的三维图和等高线叠加图进行分析,获得了双指标同时达到最优的发酵条件。结果表明:接种量5%、培养温度28.5 ℃、培养时间7.5 d、摇床转速180 r/min时,粗酶产量39.96 U/mL,多糖产量18.11 g/L,分别达到了预测值的98.96%和99.27%。
玉米淀粉 玉米黄浆 罗耳阿太菌多糖 β-1,3葡聚糖酶 双响应值 发酵条件优化
吉林省是我国玉米生产大省,玉米深加工技术在延长产业链、优化产业结构、增加产品附加值方面发挥着重要作用,是解决三农问题的一个重要措施。玉米淀粉的生产是玉米深加工的一个重要方面,其生产过程中所产生的玉米黄浆也含有多种可溶性蛋白、生长素和一些前体物质。本课题组筛得一株能够在以玉米淀粉、玉米黄浆为碳、氮源的培养基上繁殖并产β-1,3葡聚糖酶和多糖的罗耳阿太菌(AtheliarolfsiiAY6657741)[1]。
罗耳阿太菌多糖(Atheliarolfsiiexopolysaccharides)是由罗耳阿太菌(Atheliarolfsii)发酵产生的一种胞外多糖[2],多糖的主链由D-吡喃葡萄糖以β-1,3糖苷键连接而成,因其具有免疫调节[3]、降低胆固醇[4]、降血糖[5]等生理活性,受到了科研工作者的广泛关注。β-1,3葡聚糖酶广泛存在于动物、植物、微生物中,能够特异性地作用于以β-1,3糖苷键连接的多糖聚合体[6],这一特性赋予该酶水解真菌细胞壁的能力[7],使它不但在啤酒生产、果酒酿造以及食品保鲜等行业中具有重要应用[8-9],而且在粮食作物病虫害防治领域发挥重要作用[10]。
本课题组在以玉米淀粉和玉米黄浆培养罗耳阿太菌发酵产多糖的过程中发现该菌株同时分泌β-1,3葡聚糖酶,因此本试验试图实现一次发酵获得2种产品双赢,不仅节约能源,更可提高淀粉产品的附加值,以期在玉米加工工业发挥作用,深化且优化粮食产业深加工技术。
1 材料与方法
1.1 原料、试剂和设备
1.1.1 原料
罗耳阿太菌(AtheliarolfsiiAY6657741)由吉林农业大学发酵工程实验室分离纯化并石蜡封存。
玉米淀粉:市售;玉米黄浆:黄龙食品有限公司,pH 4.16,蛋白含量4.2 g/L。
1.1.2 试验试剂
PDA培养基(g/L):马铃薯 200,葡萄糖 20,琼脂 15~20,自然pH。罗耳阿太菌发酵培养基(g/L):玉米黄浆 5%(V/V),玉米淀粉 30,K2HPO41.0,MgSO4·7H2O 0.5,KCl 0.5,NaNO33.0,柠檬酸 0.5,pH为4.5。SDS-PAGE试剂盒。Tris-Gly电极缓冲液(g/L):Tris 14.4,甘氨酸3(变性另加SDS 1)。考马斯亮蓝染色液:50%(V/V)甲醇,0.2%(m/V)考马斯亮蓝R-250,10%(V/V)乙酸,40%(V/V)H2O。考马斯亮蓝脱色液:20%(V/V)甲醇,20%(V/V)乙酸,60%(V/V)H2O。孵育液:100 mL醋酸钾(50 mmol/L,pH 5.5)溶液中含 0.1 g昆布多糖。显色液:200 mL NaOH(1.0 mol/L)中含0.3 g 2,3,5-氯化三苯基四氮唑(TTC)。DNS:称取6.5 g 3,5-二硝基水杨酸溶于少量水中,移入1 000 mL容量瓶,加入325 mL 2 mol/L NaOH溶液,再加入45 g丙三醇,摇匀,冷却后定容至1 000 mL。海带多糖、罗耳阿太菌多糖及透析袋(截留相对分子质量为6 000~8 000):美国Sigma公司;其他试剂均为国产分析纯。
1.1.3 主要仪器设备
Z36HK赫莫氏低温冷冻高速离心机:德国Hermle公司;DCY-0506低温恒温槽:上海舜宇恒平科学仪器有限公司;FD-1B-50冻干机:北京博医康仪器有限公司;Nicolet 6700傅里叶变换红外光谱仪:美国Perkin Elmer公司;V-GES垂直电泳槽、ELITE 300 Plus电泳仪:美国Wealtec公司。
1.2 试验方法
1.2.1 工艺流程
取最优条件下发酵的发酵液,加入1/3体积pH 5.0 50 mmol/L Tris-HCl,30 ℃振荡20 min,4 ℃ 8 000 r/min离心30 min,上清液调节pH为3.5,4 ℃ 10 000 r/min离心30 min。离心后上清液加1.7倍体积无水乙醇5 ℃醇沉17 h[11], 取沉淀4 ℃透析过夜,袋内物冻干称重,傅里叶红外光谱扫描;下层沉淀用高纯水复溶,凝胶电泳。
1.2.2 酶及多糖的测定
酶活的测定:以海带多糖为底物,30 ℃、pH 5.5的条件下用DNS法测定还原糖的变化以确定酶活[12]。葡萄糖标准曲线为:y=0.462 7x-0.001 9(R2=0.999 6;y为吸光度;x为还原糖含量/mg/mL。
多糖产量(g/L):单位体积发酵液中粗多糖质量。
1.2.3 罗耳阿太菌发酵培养的单因素试验
单因素试验在250 mL三角瓶中进行,接种量5%,选择培养温度、培养时间、摇床转速、装液量作为考察的4个因素。培养温度设定为20、25、30、35、40 ℃,培养时间设定为5、6、7、8、9 d,摇床转速设定为125、150、175、200、225 r/min,装液量设定为80、90、100、110、120 mL。每个水平重复3次,取其平均值进行计算分析。试验过程中的不变水平为:培养温度30 ℃、摇床转速175 r/min、装液量100 mL、培养7 d提取多糖,培养8 d提取酶。
1.2.4 响应面法双指标优化发酵条件
根据单因素试验结果设计响应面试验,选取培养温度、培养时间、摇床转速为3个因素,以粗酶产量和多糖产量为响应值,按照表1进行试验。

表1 响应面分析因素水平表
1.2.5 粗酶液的非变性凝胶电泳及活性染色
分离胶浓度为10%,浓缩胶浓度为5%。电泳后,切取2个泳道的凝胶做常规考马斯亮兰 R-250 染色。切另外2个泳道的凝胶用重蒸水冲洗3次,放入 50 mmol/L的醋酸钾中缓慢振荡孵育5 min。再将凝胶移入75 mL 50 mmol/L醋酸钾(含 0.1 g海带多糖)溶液中30 ℃孵育30 min,用重蒸水冲洗3次,放入200 mL 1 mol/L的NaOH溶液(含 0.3 g TTC)中,加热至出现红色条带为止。
SDS-PAGE采用相同配比的分离胶和浓缩胶。电泳后用考马斯亮蓝R-250染色,在40 ℃下染色过夜,在80 ℃下脱色1 h,得到条带清晰的凝胶。对比活性染色和变性染色结果,得出目标酶的条带位置。
1.2.6 多糖的结构预测
取罗耳阿太菌胞外多糖1 mg与5 mg KBr混合放入干燥的研钵中,在红外灯照射下研磨至颗粒大小2.5 μm以下,将样品粉末放入压片模具中制得透明的样品片。利用傅里叶红外光谱进行结构分析,在3 500~600 cm-1条件下扫描获得光谱图。
2 结果与讨论
2.1 发酵培养的单因素试验结果
发酵培养罗耳阿太菌生产多糖和酶的单因素试验结果如图1所示。
由图1a可知,随着培养温度的升高,多糖和酶产量都有所提高,当温度达到30 ℃时,二者产量几乎同时达到最大值。随着温度继续上升,二者产量反而下降,这可能是由于温度过高不利于罗耳阿太菌的生长,影响了酶和多糖的合成。
由图1b可知,在发酵7 d时,多糖的产量最高,继续延长发酵时间,多糖产量下降,这可能是由于在发酵中后期,培养液中的碳源几乎耗尽,由β-1,3葡聚糖酶作用的可逆反应开始向逆反应方向进行,酶催化多糖的水解致使多糖产量下降。也正是如此,这一作用开始促进微生物对酶的积累,在发酵进行的第8天,酶的产量达到一个高峰,但后期营养物质缺乏,菌体生长进入衰亡期,使代谢产物酶的产量急剧下降。
由图1c可知,在摇床转速为175 r/min时,多糖和酶产量均达到峰值。这是由于适当的振荡会增加菌体与发酵液中营养物质的接触面积,有助于菌株的生长,因此随着摇床转速的提高,2个指标都呈现上升的趋势,当转速高于175 r/min后,继续提高转速反而会导致指标产量下降,这可能是由于过高的转速导致剪切力变大,从而影响多糖和酶稳定结构的形成,致使二者产量下降。
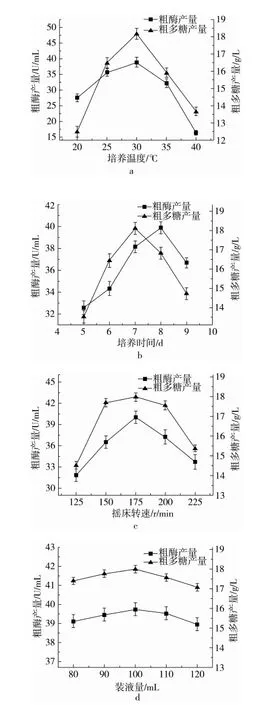
图1 培养温度、培养时间、摇床转速、装液量对粗酶和多糖产量的影响
由图1d可知,装液量不同时,2个指标的产量虽有轻微波动,但都趋于平稳,这可能是由于溶氧率对该菌种的生长无显著影响,因此,不选择装液量作为响应面的分析因素。
2.2 响应面法双指标优化最佳发酵工艺条件
2.2.1 Box-Behnken试验设计与结果分析
根据单因素试验结果,选择培养温度、培养时间、摇床转速作为Box-Behnken中心组合试验设计的3个因素开展试验,双指标优化最佳发酵条件的响应面试验设计及结果见表2。
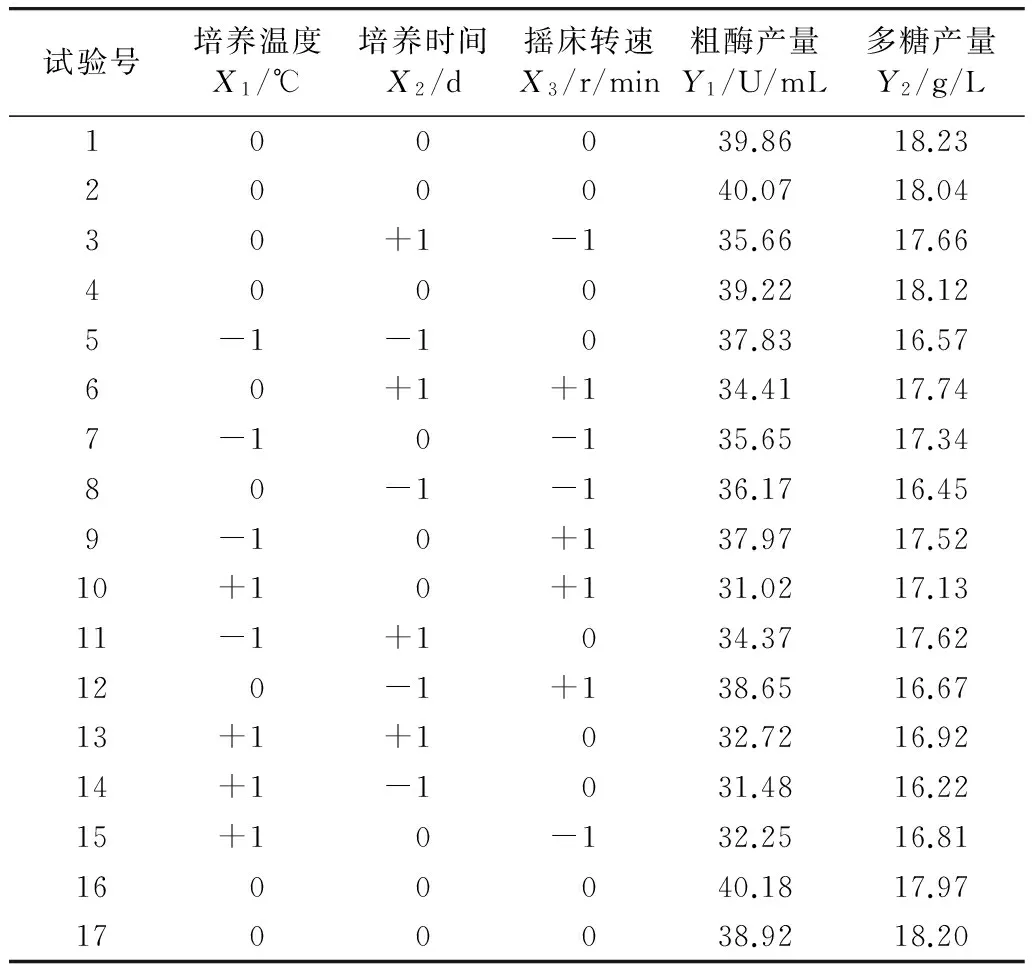
表2 Box-Behnken试验设计及结果
双指标响应值所得回归模型函数表达式:
粗酶产量=-305.22+7.96X1+27.01X2+1.45X3+0.24X1X2-7.10E-003X1X3-0.04X2X3-0.15X12-1.76X22-2.64E-003X32(R2=0.982 7)
多糖产量=-58.45+1.48X1+10.72X2+0.18X3-0.02X1X2+2.8E-004X1X3-1.4E-003X2X3-0.02X12-0.67X22-4.92E-004X32(R2=0.987 2)
以上2个方程的R2值都接近于1,说明通过二次回归得到的多糖及粗酶产量的模型与试验拟合较好,可靠性高。
2.2.2 响应面立体图及方差分析
响应值Y1(粗酶产量)和Y2(多糖产量)拟合模型的方差分析见表3。从表3中可以判断,培养温度和培养时间对粗酶产量影响极显著,培养温度和培养时间交互作用极显著,培养温度和摇床转速与培养时间和摇床转速交互作用影响显著,3个因素的平方均影响极显著。从响应面立体图(图2)可知,3个因素交互作用的立体图上都存在极值,培养温度和培养时间的侧剖面图弧度比摇床转速的侧剖面弧度更大,说明培养温度和培养时间对模型的影响比摇床转速大;从投影的等高线图观察,培养温度和培养时间的等高线图更接近于椭圆,说明二者的交互作用更加显著,因此,选择培养温度和培养时间交互作用的等高线图展开接下来的分析更有意义。
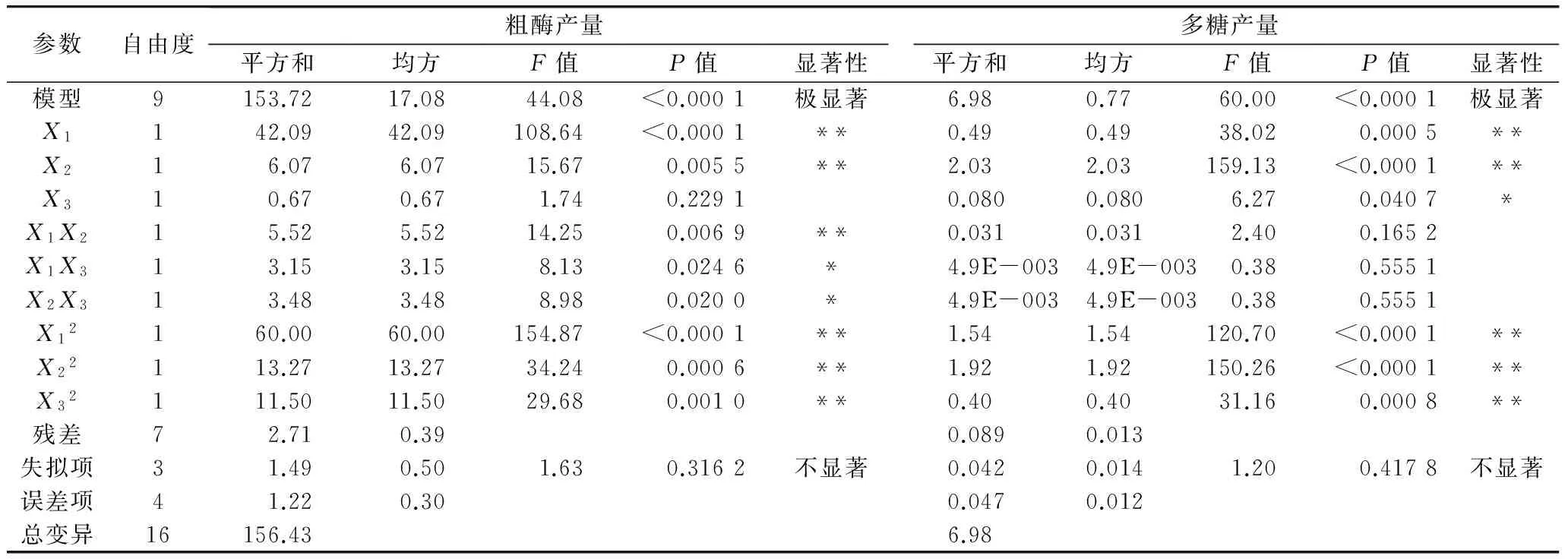
表3 回归方程的方差分析
注:**极显著水平(P<0.01),*显著(P<0.05)。
由表3还可以看出,培养温度、培养时间对多糖产量影响极显著,3个因素的平方对模型的影响均为极显著。从响应面立体图(图3)得知,3个图像中都存在响应值的最大值,所选择的试验范围属于极值附近的小范围,符合响应面适用条件,3个立体图侧剖面的弧度显示培养温度和培养时间的弧度较大,说明培养温度和培养时间对模型的影响比摇床转速显著,立体图的等高线图显示,培养温度和培养时间交互时,等高线图为椭圆形,说明二者的交互作用对模型影响大,其余2个交互作用的等高线图趋近圆形,说明对模型的影响不大,因此,选择培养温度和培养时间交互作用的等高线图绘制等高线叠加图(图4)。
2.2.3 双指标最优发酵条件的确定及验证
从模型的方差分析显示,2个响应面都存在对模型影响较显著的2个因素X1和X2,并且它们的交互作用也存在显著或极显著的影响,从图2和图3可以看出,每个响应面都存在响应值较高的因素范围,将其叠加(图4),进一步缩小最优区域的范围。通过SAS软件优化程序[13],确定出各响应值的X1、X2的最优范围。Y1的培养温度为26.4~29.7 ℃,培养时间为7.0~8.6 d,Y2的培养温度为26.1~30.9 ℃,培养时间为7.2~8.1 d。将二者交互作用的等高线图叠加,可以直观地看出2个指标同时达到较高水平的区域,结合SAS分析结果和响应面的优化条件,可以确定出双指标的最优发酵条件为:培养温度27.92~28.86 ℃,培养时间7.38~7.53 d,摇床转速178.17~183.29 r/min,此时罗耳阿太菌多糖产量的理论预测值为18.24 g/L,粗酶产量的理论预测值为40.38 U。依据最优工艺范围,为方便操作,选择培养温度28.5 ℃,培养时间7.5 d,摇床转速180 r/min进行验证试验,结果表明,此条件下粗多糖产量为18.11 g/L,粗酶产量为39.96 U/mL,分别达到了预测值的99.27%和98.96%。试验值与预测值接近,误差较小,说明二次多项式的拟合模型与等高线叠加所得到的优化区域符合试验目标。
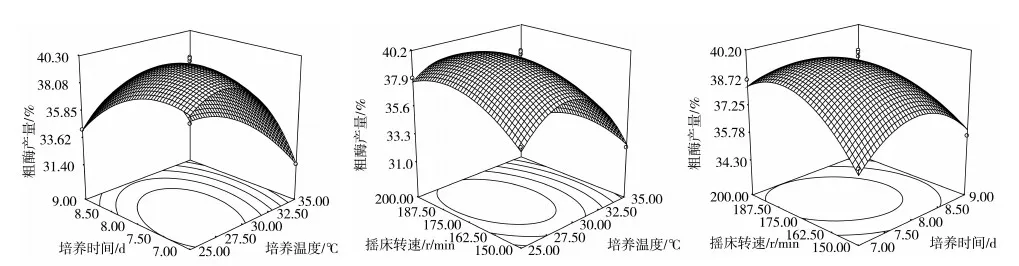
图2 发酵条件交互作用对粗酶产量影响的立体分析图
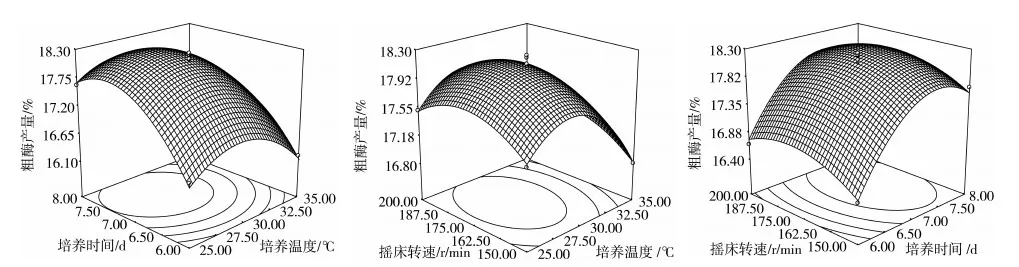
图3 发酵条件交互作用对粗多糖产量影响的立体分析图
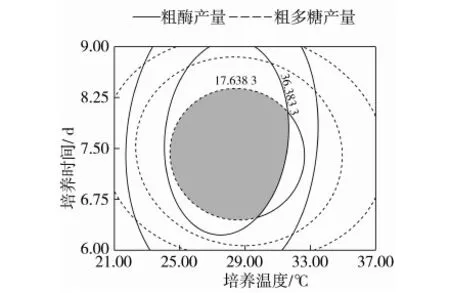
图4 罗耳阿太菌发酵培养条件优化的等高线叠加图
目前,工艺优化大多采用均匀设计或正交试验设计,通常为固定其他因素,单一考虑一个因素为变量的单因素考察法,无法考察多个因素之间的相互作用,更无法得到适用多个响应值的最优工艺条件。响应面分析法可以利用二次回归方程,拟合多个试验因素与响应值之间的函数关系,通过对回归方程分析,得到最佳工艺参数。本试验即采用这一方法实现了多产物的共赢。
2.3 活性染色确定目的蛋白
同时对粗酶液进行非变性凝胶电泳的活性染色及SDS-PAGE的考马斯亮蓝R-250染色。所得结果如图5所示,左侧为考马斯亮蓝R-250染色的蛋白图谱,右侧为活性染色的对照图,从图5可以看出,活性染色图谱上存在一条颜色较深的条带,这表明粗酶液中存在具有β-1,3葡聚糖酶活性的蛋白将孵育液中的海带多糖水解为还原糖。
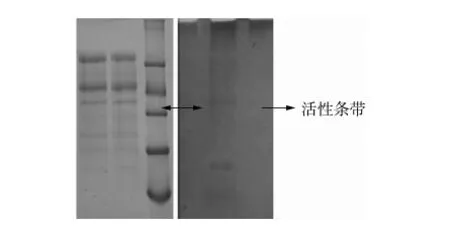
图5 考马斯亮蓝R-250染色与活性染色图谱
β-1,3葡聚糖酶作为罗耳阿太菌胞外多糖合成的关键酶,影响着多糖的合成同时促进多糖的分解,该酶有可能决定着罗耳阿太菌多糖的产量、结构以及性质[14],通过蛋白质组学以及基因工程学手段对该酶进行探究以提高罗耳阿太菌胞外多糖产量和活性是未来研究的方向,本试验也将为这一方面的研究奠定基础。
2.4 罗耳阿太菌胞外多糖的红外光谱
罗耳阿太菌胞外多糖的红外光谱图见图6。
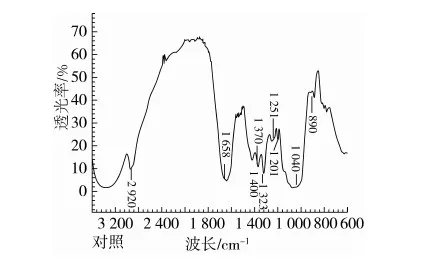
图6 多糖的红外光谱图
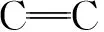
罗耳阿太菌胞外多糖在食品工业、石油工业以及制药工业等方面都有重要应用,其免疫活性和抗病毒活性吸引了众多科研工作者的研究兴趣。寻找其结构中的功能位点,利用生物工程手段,生产出更多具有活性、有益人类的多糖是我们未来研究的目标。
依据Sutherland[16]提出的胞外多糖合成的一般途径(Ⅰ底物的吸收;Ⅱ细胞内形成多糖;Ⅲ多糖从细胞排除)推测:葡萄糖首先在己糖激酶(HK)的作用下进入细胞,六磷酸葡萄糖在焦磷酸化酶(UGP)的作用下生成尿苷二磷酸葡萄糖(UDP-G),与脂质作用生成脂质焦磷酸葡萄糖,链式聚合释放焦磷酸脂后形成多糖,与此同时β-1,3葡聚糖酶合成并发挥作用,催化主链D-吡喃葡萄糖以β-1,3糖苷键连接形成罗耳阿太菌多糖。发酵后期其他碳源耗尽,激发β-1,3葡聚糖酶活性增强,促进多糖降解为葡萄糖小分子,为微生物提供ATP、形成还原型辅酶或为生物合成提供中间物质。目前,关于罗耳阿太菌β-1,3葡聚糖酶和胞外多糖在生物体中合成规律的研究依然鲜见。Rapp[17]探究罗耳阿太菌β-1,3葡聚糖酶活性过程中,仅指出发酵后期碳源耗尽时,生物体可利用自身分泌的胞外多糖提供碳源。因此,有关罗耳阿太菌胞外多糖和β-1,3葡聚糖酶更深入的代谢关系以及多糖合成与其他糖代谢酶的相关性还有待进一步研究。
3 结论
利用玉米淀粉和玉米黄浆为培养基,成功培养出产罗耳阿太菌胞外多糖和β-1,3葡聚糖酶的罗耳阿太菌,最优发酵条件为:培养温度28.5 ℃,培养时间7.5 d,摇床转速180 r/min,多糖产量18.11 g/L,粗酶产量9.96 U/mL。
[1]苗琇岩,李鸿梅,魏明,等. 基于玉米黄浆及淀粉培养的罗耳阿太菌发酵多糖工艺研究[J]. 食品科学,2014,35(19):194-201
Miao Xiuyan,Li Hongmei,Wei Ming,et al. Optimization of culture conditions for the production of polysaccharides byAtheliarolfsiiin a medium consisting of corn steep liquor and starch [J].Food Science,2014,35(19):194-201
[2]魏明,李鸿梅,马艳秋,等. 响应面优化罗耳阿太菌胞外多糖提取工艺及其保湿、黏度特性分析[J]. 食品科学,2015,36(8):67-73
Wei Ming, Li Hongmei, Ma Yanqiu,et al. Extraction and viscosity stability of exopolysaccharides with moisture-retention capacity fromAtheliarolfsii[J].Food Science,2015,36(8):67-73
[3]Pretus H,Ensley H,Mcnamee R,et al. Isolation physicochemical characterization and preclinical efficacy evaluation of soluble scleroglucan[J]. Journal of Pharmacology and Experimental Therapeutics,1991,257(1):500-510
[4]Mastromarino P,Petruzziello R,Macchia S,et al. Antiviral activity of natural and semisynthetic polysaccharides on the early steps of rubella virus infection[J]. Journal of Antimicrobial chemotherapy,1997,39(3):339-345
[5]Easson D D,Jamas S,Ostroff G R. Use of aqueous soluble glucan preparations to stimulate platelet production[M]. Google Patents,1996:234-243
[6]Aires R S,Steindorff A S,Ramada M H S, et al. Biochemical characterization of a 27 kDa β-1,3-D-glucanase fromtrichodermaasperelluminduced by cell wall of rhizoctonia solani[J]. Carbohydrate Polymers,2012,87(2):1219-1223
[7]余贤,郑服丛,艾呈祥,等. β-1,3葡聚糖酶在植物抗真菌病基因工程中的研究进展[J]. 生命科学研究,2004,8(4):53-57
Yu Xian,Zheng Fucong,Ai Chengxiang,et al.The development of the utilization of β-1,3-glucanase in transgection plant resistant to fungal pathogens[J].Life Science Research,2004,8(4):53-57
[8]Blattel V,Larisika M,Pfeiffer P,et al. β-1,3-glucanase fromdelftiatsuruhatensisstrain MV01 and its potential application in vinification[J]. Applied and Environmental Microbiology,2011,77(3):983-990
[9]Wang Kun,Luo Huiying,Shi Pengjun,et al. A highly-active endo-1,3-1,4-β-glucanase fromthermophilictalaromycesemersoniiCBS394.64 with application potential in the brewing and feed industries[J]. Process Biochemistry,2014,49(9):1448-1456
[10]左豫虎,康振生,杨传平,等. β-1,3-葡聚糖酶和几丁质酶活性与大豆对疫霉根腐病抗性的关系[J]. 植物病理学报,2009,39(6):601-606
Zuo Yuhu,Kang Zhensheng,Yang Chuanping,et al.Relationship between Activities of β-1,3-glucanase and Chitinase and Resistant to Phytophthora Root Rot in Soybean[J],Acta Phytopathologica Sinica,2009,39(6):601-606
[11]吴东儒. 糖类的生物化学[M]. 北京:高等教育出版社,1988
Wu Dongru. Carbohydrate biochemistry[M].Beijing: Higher Education Publication,1988
[12]Ueda M,Koh Y,Goto T,et al. Purification and characterization of β-1,3-d-glucanase from eisenia foetida[J]. Carbohydrate Polymers,2011(86): 271-276
[13]王明艳,张小杰,王涛,等. 响应面法优化香椿叶多糖的提取条件[J]. 食品科学,2010,31(4):106-110
Wang Mingyan,Zhang Xiaojie,Wang Tao,et al. Response surface methodology for optimizing extraction of polysaccharides from toona sinensis (A.Juss.) roem leaves[J].Food Science,2010,31(4):106-110
[14]Jia Huiyong,Li Yinan,Liu Yuchun,et al. Engineering a thermostable β-1,3-1,4-glucanase frompaecilomycesthermophilato improve catalytic efficiency at acidic pH[J]. Journal of Biotechnology,2012,159(1-2):50-55
[15]陆婉珍. 现代近红外光谱分析技术 [M]. 第二版. 北京:中国石化出版社,2007
Lu Wanzhen. Modern near infrared spectroscopy analytical technology[M].Second Edition. Beijing: China Petrochemical Publication,2007
[16]Sutherland I W. Biosynthesis of extracellular polysaccharides[M].Salt lake city: American Academic Press,1993:69-85
[17]Rapp P. 1,3-β-glucanase,1,6-β-glucanase and β-glycosidase activities ofsclerotiumglucanicumsynthesis and properties[J]. Journal of General Microbiology,1989,135:2847-2858.
Optimization of Corn Starch and Corn Soak Solution FermentingAtheliarolfsiiby Double Response Values
Zhang Guihong Li Hongmei Wei Ming Min Weihong
(College of Food Science and Engineering Jilin Agricultural University, Changchun 130118)
This paper was to obtain the high yield of Athelia rolfsii β-1,3-glucanase and exopolysaccharides at the same time, using corn starch and corn soak solution as important components of culture medium,Atheliarolfsiiβ-1,3-glucanase and exopolysaccharides as indicators, fermentation temperature, fermentation time and stirrer speed as optimizing factors, the double response values of Athelia rolfsii β-1,3-glucanase and exopolysaccharides were optimized by response surface test based on single factor test. The results of response surface stereogram and overlay contour analysis showed that the optimal fermentation conditions were as follows: 5% inoculum size, 28.5 ℃, 7.5 d, 180 r/min. The primary enzyme production was 39.96 U/mL, theAtheliarolfsiiexopolysaccharides production was 18.11 g/L at the same time, reaching 98.96% of predicted primary enzyme production and 99.27% of predicted exopolysaccharides production.
corn starch, corn soak solution,Atheliarolfsiiexopolysaccharide, β-1,3-glucanase, double response values, optimal culture conditions
TQ920.6
A
1003-0174(2016)12-0118-07
吉林省科技发展计划(20126037)
2015-04-10
张桂弘,女,1990年出生,硕士,发酵工程
李鸿梅,女,1971年出生,教授,制糖工程

