不同剂量富氢气生理盐水对实验性自身免疫性脑脊髓炎的治疗作用观察
谢建平 王赵伟 吴承龙
不同剂量富氢气生理盐水对实验性自身免疫性脑脊髓炎的治疗作用观察
谢建平 王赵伟 吴承龙
目的 探讨富氢气生理盐水对实验性自身免疫性脑脊髓炎(EAE)大鼠的治疗作用及最佳剂量范围。方法用豚鼠脊髓匀浆与完全弗氏佐剂免疫SD大鼠制作EAE模型;造模成功后第1~20天大鼠腹腔注射不同剂量(0、3、6ml/kg)富氢气生理盐水,观察并记录大鼠体重、行为学评分;第21天处死大鼠取脑、脊髓作HE染色,检测脊髓IL-17、INF-γ表达水平以及血清超氧化物歧化酶(SOD)活性。结果6ml/kg富氢气生理盐水剂量组临床发病率较低,仅为30.0%;且发病后能抑制体重下降,最高临床评分与累积临床评分均最低,中枢组织炎症细胞浸润最少。3、6ml/kg剂量的富氢气生理盐水均能抑制EAE大鼠IL-17、INF-γ的释放,提高SOD活性;但6 ml/kg剂量效果更佳。结论6ml/kg剂量的富氢气生理盐水可能对降低EAE大鼠临床发病率有积极作用,且能抑制发病大鼠体重下降,降低神经缺损行为学评分,并能促进SOD活性,从而抑制EAE。
氢气 实验性自身免疫性脑脊髓炎 SOD IL-17 INF-γ
氢元素在地球丰度颇高,且具有较强的还原性,因此广泛应用于新能源电池开发。现代医学研究发现,氢气可在人体肠道内由细菌代谢产生,并广泛存在于内环境中,可选择性清除羟自由基和过氧亚硝基阴离子而具有抗氧化应激与抗细胞凋亡的作用[1]。此外,富氢气生理盐水可以抑制脑、心、肝、肾、肺等脏器的缺血再灌注损伤[2-3],对神经系统退行性疾病也有一定的治疗作用[4]。多发性硬化是一种慢性炎症性脱髓鞘性自身免疫性中枢神经系统疾病,可导致进行性神经损害与残疾[5],发病机制可能与遗传、易感人群及受到环境因素影响而导致免疫耐受平衡紊乱有关。实验性自身免疫性脑脊髓炎(EAE)动物模型是人类多发性硬化的理想动物模型,它们有相似的临床表现、免疫特性及组织病理学特征[6]。神经源性抗原免疫诱导EAE后,可观察到中枢神经系统出现炎症细胞浸润与髓鞘脱失;还会出现中枢神经系统内抗原特异性Th1、Th17淋巴细胞增殖、局限性的炎症反应、髓鞘脱失和神经坏死等[7]。在脱髓鞘疾病免疫攻击阶段,大量免疫细胞被活化并释放炎症介质,存在着氧化应激、释放氧自由基过程,而氢气能否抑制这一过程尚未明确。本研究通过制作EAE大鼠模型并在其腹腔内注射不同剂量富氢气生理盐水,观察大鼠的体重与行为学改变,脊髓组织病理变化,IL-17、INF-γ表达及血清超氧化物歧化酶(SOD)活性改变,以探讨富氢气生理盐水对EAE是否有治疗作用及最佳治疗剂量范围。
1 材料与方法
1.1 试剂与仪器 富氢气生理盐水(上海第二军医大学潜水医学教研室),IL-17与INF-γ酶联免疫吸附法试剂盒(MIF00、M1700,美国安迪生物科技有限公司),完全弗氏佐剂(F5881-10X10ML,美国Sigma-Aldrich公司),百日咳毒素与卡介苗(中国食品药品检定研究院),总蛋白定量测定试剂盒与超氧化物歧化酶检测试剂盒(A045-3-96T,南京建成生物工程研究所);酶标仪(684,美国BIO-RAD公司),可见分光光度计(722,上海精密科学仪器有限公司)。
1.2 实验动物与EAE模型制作 180~200g白色豚鼠17只,用于制作脊髓匀浆;8周龄220~250g且造模成功的SD大鼠(清洁级)35只,由上海斯莱克实验动物有限公司提供。EAE模型制作参照以往操作流程[8],主要步骤包括:用注射器来回抽打豚鼠脊髓匀浆和完全弗氏佐剂(CFA,1∶1体积)成油包水乳剂,皮下注射于大鼠四肢足垫(0.4ml/只);注射当天与之后48h,腹腔注射百日咳毒素1ml(1×109菌体)。CFA组用生理盐水代替豚鼠脊髓匀浆,再与CFA等体积混匀为乳剂后注射于大鼠四肢足垫,百日咳毒素处理与EAE组一致。大鼠尾部或肢体出现无力表示造模成功,成模率为76.7%。
1.3 模型分组及对照治疗 将造模成功的35只大鼠随机分为4组:CFA对照组5只,仅于大鼠足底皮下注射CFA;EAE对照组10只,造模成功后第1~20天每日腹腔注射生理盐水;3ml/kg富氢气生理盐水治疗组10只,造模成功后第1~20天每日腹腔注射3ml/kg富氢气生理盐水;6ml/kg富氢气生理盐水治疗组10只,造模成功后第1~20天每日腹腔注射6ml/kg富氢气生理盐水。
1.4 行为学评价 行为学评价指标有临床发病率、最高临床评分和累积临床评分。临床评分依据Kono等[9]报道的行为学标准:无明显异常为0分,尾巴无力为1分,轻微后肢无力为2分,严重后肢麻痹为3分,四肢麻痹为4分,濒死或死亡为5分。
1.5 大鼠标本处理 造模成功后第20天将4组大鼠用10%水合氯醛麻醉后统一处死;取其脑和脊髓在4%多聚甲醛中固定24h。常规脱水、透明、浸蜡制成蜡块,切片后用HE染色,在光学显微镜下观察组织病理变化。部分脊髓组织立即冻存于液氮,并转移至-70℃冰箱保存,用于炎症介质检测。处死前,尾静脉抽取血液标本,经离心(500g)获得血浆,冻存于-70℃冰箱,用于SOD检测。
1.6 血浆SOD检测 冰冻血浆经融化达到室温后,采用黄嘌呤氧化酶法进行SOD活性检测:在测定管分别加入试剂一1ml、血浆0.1ml、试剂二0.1ml、试剂三0.1ml、试剂四0.1ml;在对照管分别加入试剂一1ml、双蒸水0.1ml、试剂二0.1ml、试剂三0.1ml、试剂四0.1ml;经旋窝混匀器混匀后于37℃恒温水浴40min,加入显色剂2ml,室温静置10min,选择550nm波长、1cm光径比色杯,经蒸馏水调零后,上机检测吸光度值;根据吸光度值换算获得SOD活性值。
1.7 脊髓IL-17与INF-γ表达水平检测 (1)脊髓匀浆上清液总蛋白浓度测定:保存于-70℃冰箱的脊髓组织经室温解冻后,立刻在细胞裂解液中匀浆;取标准品与组织上清液稀释、加样,37℃温浴30min,加终止液混匀5min;选择562nm波长上机检测各管吸光度值,根据吸光度拟核标准曲线,并计算各样品总蛋白浓度。(2)ELISA法检测IL-17与INF-γ浓度:试剂盒及脊髓匀浆液标本静置达室温后,用移液器添加50μl稀释液到酶标板各孔内,分别添加标准品、对照液、血浆样品50μl到相应各孔内,酶标板覆盖塑料盖板后室温孵育2 h,甩干各孔并洗涤5次,加入100μl偶联化合物至各孔,室温孵育2 h,甩干各孔并洗涤5次,加入100μl底物液后室温避光孵育30min,加入100μl终止液;选择450nm波长(以540nm为对照波长)在30min内完成上机检测,根据吸光度拟核标准曲线,并计算各样品IL-17与INF-γ浓度;(3)通过IL-17或INF-γ浓度/总蛋白浓度进行标准化,以表示脊髓IL-17或INF-γ表达水平。
1.8 统计学处理 应用SPSS 16.0统计软件,计量资料用表示,神经缺损行为学评分、体重等多样本均数比较采用方差分析,其余均数比较采用t检验。
2 结果
2.1 大鼠体重变化 造模成功后第9天,除CFA组体重增加外,其余3组均出现体重下降;第11~20天,CFA组大鼠体重与其余3组比较,差异均有统计学意义(均P<0.05);第18~20天,EAE组大鼠体重均明显低于6 ml/kg组(均P<0.05),而与3ml/kg组比较差异均无统计学意义(均P>0.05),见图1。

图1 各组大鼠日均体重变化
2.2 大鼠行为学评分变化 EAE组大鼠临床发病率最高(80.0%),3ml/kg组次之(50.0%),6ml/kg组较低(30.0%)。3ml/kg组、6ml/kg组最高临床评分均低于EAE组(均P<0.05);而3ml/kg组与6 ml/kg组比较,差异无统计学意义(P>0.05)。造模成功后第1~20天累积临床评分比较,3ml/kg组、6ml/kg组均低于EAE组(均P<0.05);3ml/kg组高于6ml/kg组(P<0.05),见表1。

表1 各组大鼠临床发病率及行为学评分
2.3 脊髓组织病理检查结果 CFA组大鼠脊髓病理切片中未见明显炎症反应,偶见少量单核细胞;EAE组可见典型的淋巴袖套形成,数量较多,脊膜下可见明显的炎症细胞浸润;3ml/kg组可见少量典型的淋巴袖套,炎症细胞集中在脊髓膜下;6ml/kg组可见散在的淋巴细胞浸润,分布稀疏,极少见到典型的淋巴袖套,见图2。
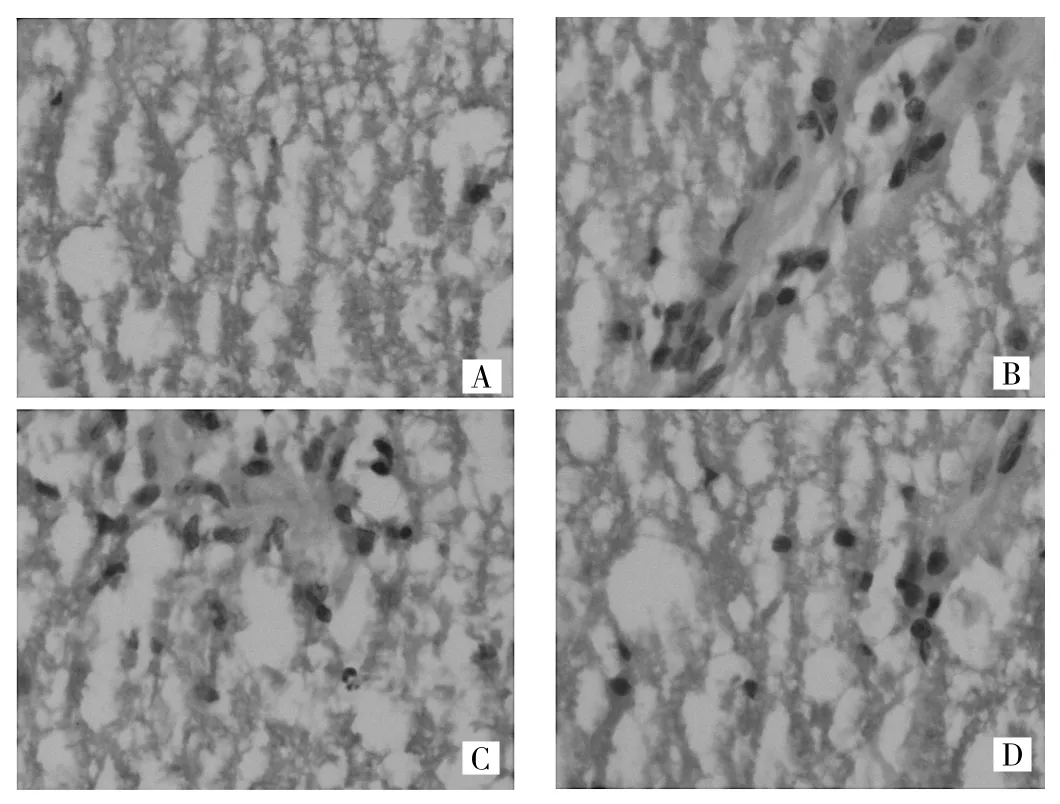
图2 脊髓组织病理检查结果(A:CFA组腰髓,正常脊髓;B:EAE组腰髓,大量淋巴细胞浸润;C:3ml/kg组腰髓,可见炎症细胞浸润;D:6ml/kg组腰髓,可见少量炎症细胞浸润;HE染色,×400)
2.4 造模后各组大鼠血清SOD活性变化 除CFA组外,其余3组大鼠SOD活性在造模后第9、14、19天均明显下降。与CFA组比较,EAE组大鼠SOD活性在以上3个时间点均明显下降(均P<0.01);与EAE组比较,3ml/kg组、6ml/kg组SOD活性在以上3个时间点明显升高(均P<0.01)。6ml/kg组与3ml/kg组大鼠SOD活性比较,第19天6ml/kg组较高(P<0.05),其余2d差异均无统计学意义(均P>0.05),见表2。

表2 造模后各组大鼠血清SOD活性变化(U/ml)
2.5各组大鼠脊髓IL-17与INF-γ表达水平变化 EAE组炎症介质IL-17与INF-γ表达水平均高于CFA组(均P<0.01);与EAE组比较,6ml/kg组、3ml/kg组大鼠脊髓IL-17、INF-γ表达水平均明显下降(均P<0.05);6ml/kg组与3ml/kg组的IL-17、INF-γ表达水平比较,差异均无统计学意义(均P>0.05),见表3。

表3 各组大鼠脊髓IL-17与INF-γ表达水平
3 讨论
多发性硬化是以中枢神经系统白质脱髓鞘,炎症细胞浸润并伴有轴突损伤为特点的神经系统自身免疫性疾病。EAE模型多发性硬化的经典动物模型,具有相似的免疫学机制[9]。通过神经源性抗原免疫诱导EAE后,可观察到中枢神经系统出现炎症细胞浸润与髓鞘的脱失。诱导EAE后还会出现中枢神经系统内抗原特异性Th1、Th17淋巴细胞增殖、局限性的炎症反应、髓鞘脱失和神经坏死等。Th1、Th2、Th17和Treg淋巴细胞则与EAE疾病的发生、发展密切相关。
Treg淋巴细胞占人类外周血单个核淋巴细胞的1%~2%,占CD4+T细胞的5%~10%。骨髓制造的幼稚T淋巴细胞可在胸腺发育成熟;Treg淋巴细胞也能被TGF-β、致耐受性树突状细胞或特异性抗原持续刺激所诱导成熟。Treg细胞在抑制针对自身抗原的病理性免疫反应、感染恢复与维持免疫稳态等方面具有重要作用。Th1、Th17参与促进炎症过程,并释放IL-17、INFγ;炎症细胞在IL-17、INFγ等介导下最终导致呼吸暴发,产生大量氧自由基,导致氧化应激,加重中枢炎症损伤[10]。SOD是生物体内最重要的抗自由基活性酶类,其活性很大程度上决定个体的抗氧化应激能力,即体现EAE发病的抵抗能力。
目前认为氢气对抗氧化应激作用显著,具有广泛的应用前景[11]。本实验通过制作EAE模型并腹腔注射富氢气生理盐水,从EAE动物体重变化、神经缺损行为学评分、组织学检测结果、致病性炎症介质等方面评价富氢气生理盐水对EAE的抑制作用,发现6ml/kg剂量效果最佳。但本研究未使用更高剂量,建议进一步研究更大剂量富氢气生理盐水是否能达到更好的治疗效果或可能出现的不良反应。此外,本研究发现全程使用富氢生理盐水可能对降低大鼠EAE临床发病率有积极作用;但本研究样本量不足,故未见统计学差异,建议今后扩大样本量作进一步研究。我们还发现富氢气生理盐水治疗组大鼠发病过程中血清SOD活性水平明显升高,其抗氧化应激储备能力明显增强,可能与氢气直接中和强自由基和过氧亚硝基阴离子,从而减少了SOD损耗有关[12]。对于氢气是否能直接调节SOD活性或促进SOD酶蛋白表达,需进一步研究。IL-17、INF-γ是EAE的致病炎症介质之一[13],本研究发现氢气可以抑制IL-17表达,且可能参与调节IL-17表达或Th17细胞活化增殖的信号通路。
本研究初步认为氢气可以抵抗EAE大鼠中枢炎症,6 ml/kg剂量的富氢生理盐水疗效较好;氢气对EAE治疗作用可能与升高SOD水平、抑制IL-17有关。氢气抑制IL-17表达的具体信号通路、促进SOD活性的具体机制等有待深入研究。
[1] Hong Y,Guo S,Chen S,et al.Beneficial effect of hydrogen-rich saline on cerebral vasospasm after experimental subarachnoid hemorrhage in rats[J].Journal of neuroscience research,2012,90 (8):1670-1680.
[2] Kawamura T,Huang C S,Tochigi N,et al.Inhaled hydrogen gas therapy for prevention of lung transplant-induced ischemia/reperfusion injury in rats[J].Transplantation,2010,90(12):1344-1351.
[3] Zhang Y,Sun Q,He B,et al.Anti-inflammatory effect of hydrogen-rich saline in a rat model of regional myocardial ischemia and reperfusion[J].International journal of cardiology,2011,148(1): 91-95.
[4] Xue X,Bian J S.Neuroprotective effects of hydrogen sulfide in Parkinson's disease animal models:methods and protocols[J].Methods in enzymology,2015,554:169-186.
[5] McWilliams I L,Rajbhandari R,Nozell S,et al.STAT4 controls GM-CSF production by both Th1 and Th17 cells during EAE[J].Journal of neuroinflammation,2015,12:128.
[6] 王沛,郑荣远,林福虹,等.实验性自身免疫性脑脊髓炎小鼠脑组织和脊髓中脑型肌酸激酶、钙泵和钙中性蛋白酶的变化[J].中国临床神经科学,2011,19(1):9-15.
[7] Kurschus F C.T cell mediated pathogenesis in EAE:Molecular mechanisms[J].Biomedical journal,2015,38:183-193.
[8] 王赵伟,郑荣远,林福虹,等.左旋咪唑通过促进抗原呈递细胞MHC-Ⅱ表达而加重实验性自身免疫性脑脊髓炎[J].中国临床神经科学, 2011,19(1):1-4.
[9] Kono D H,Urban J L,Horvath S J,et al.Two minor determinants of myelin basic protein induce experimental allergic encephalomyelitis in SJL/J mice[J].The Journal of experimental medicine, 1988,168(1):213-227.
[10] Okuda Y,Sakoda S,Fujimura H,et al.IL-6 plays a crucial role in the induction phase of myelin oligodendrocyte glucoprotein 35-55 induced experimental autoimmune encephalomyelitis[J].J Neuroimmunol,1999,101(2):188-196.
[11] Chang W J,Toledo-Pereyra L H.The potential benefits of hydrogen-rich saline in ischemia and reperfusion injury[J].The Journal of surgical research,2013,180:248-249.
[12] Nakao A,Kaczorowski D J,Wang Y,et al.Amelioration of rat cardiac cold ischemia/reperfusion injury with inhaled hydrogen or carbon monoxide,or both[J].The Journal of Heart and Lung Transplantation,2010,29(5):544-553.
[13] Zielinski C E,Mele F,Aschenbrenner D,et al.Pathogen-induced human TH17 cells produce IFN-γ or IL-10 and are regulated by IL-1β[J].Nature,2012,484(7395):514-518.
Effects of hydrogen-rich saline against experimental autoimmune encephalomyelitis in SD rats
XIE Jianping. WANG Zhaowei. WU Chenglong. Department of Neurology. Shaoxing People's Hospital. Shaoxing 312000. China
Objective To investigate the effect of hydrogen-rich saline on experimental autoimmune encephalomyelitis (EAE).MethodsEAE was induced by injection of spinal cord homogenate of guinea pig with complete Freund's adjuvant(CFA) in SD rats.From the 1st day to the 20th day after EAE induced,the rats received peritoneal injection of hydrogen-rich saline(0,3, 6ml/kg).On the 21th day,all rats were sacrificed;paraffin sections of spine cord were prepared and stained with hematoxylin-eosin to detect inflammatory cell infiltration.The expression of IL-17 and INF-γin the spinal cord was determined by ELISA and serum SOD activity was determined on the 10th,15th and 20th after EAE induced.ResultsThe incidence of EAE in hydrogen-rich saline 6ml/kg group was lowest(30.0%)among 3 groups.Hydrogen-rich saline 6ml/kg inhibited the weight reduction and reduced the neurobehavioral deficits scores.It also reduced the inflammatory cell infiltration in the spinal cord of EAE rats and the expression of IL-17 and INF-γ,while increased the level of SOD.The degree of weight reduction was not reduced by given 3ml/kg hydrogen-rich saline,while it reduced the neurobehavioral deficits scores and the inflammatory cell infiltration in spinal cord and the expression of IL-17 and INF-γand up-regulated the SOD level.ConclusionHydrogen-rich saline can reduce the severity of EAE,which may be associated with its antioxidant effect and the up-regulation of serum SOD.
Hydrogen Experimental autoimmune encephalomyelitis SOD IL-17 INF-γ
2015-11-30)
(本文编辑:陈丹)
浙江省医药卫生科技项目(2015ZHB014)
312000 绍兴市人民医院神经内科
吴承龙,E-mail:wuchlo7666@126.com

