核糖核苷酸还原酶小亚基M2在宫颈鳞癌组织中的表达及临床意义
金闺秀 杨海涛 林毅 钟惠珍
核糖核苷酸还原酶小亚基M2在宫颈鳞癌组织中的表达及临床意义
金闺秀 杨海涛 林毅 钟惠珍
目的 探讨核糖核苷酸还原酶小亚基M2(RRM2)在宫颈鳞癌中的表达。方法采用免疫组化法检测20例宫颈上皮内瘤变2~3级组织、68例宫颈鳞癌组织和18例正常宫颈组织中RRM2蛋白表达,并分析与临床病理参数及肿瘤标志物之间的关系。结果RRM2在宫颈鳞癌组织中蛋白阳性表达率为82.35%,明显高于宫颈上皮内瘤变组织(55.00%)和正常宫颈组织(11.11%),3组间差异有统计学意义(P<0.05)。不同组织分化程度、血清鳞状细胞癌抗原(SCC)阳性与否的宫颈鳞癌患者RRM2蛋白阳性表达率差异均有统计学意义(均P<0.01),即高分化组低于中、低分化组,SCC阳性组高于SCC阴性组。结论RRM2在宫颈鳞癌组织中高表达,且组织分化低、血清SCC阳性者的RRM2蛋白阳性表达率偏高。
宫颈鳞癌 核糖核苷酸还原酶M2 免疫组化 鳞癌相关抗原
核糖核苷酸还原酶(RR)是生物体细胞内唯一能够催化核糖核苷酸转化为脱氧核糖核苷酸的酶,是DNA通路中合成与修复的限速酶。人RR全酶由大亚基RRM1与小亚基RRM2或RRM2B组成,形成两种不同形式RR酶,即RRM1/RRM2和RRM1/RRM2B;全酶的活性由RRM2蛋白的表达水平决定[1]。国内外研究发现RRM2在胃癌、肝癌、卵巢癌等肿瘤中过表达[2-4],与肿瘤发生发展、细胞迁移及侵袭能力、耐药的产生、预后等相关;但是关于RRM2在宫颈癌中表达的研究较少。因此,笔者采用免疫组化技术检测68例原发性宫颈鳞癌组织、20例宫颈上皮内瘤变组织和18例正常宫颈组织中RRM2蛋白表达情况,以探讨RRM2表达在宫颈鳞癌发生、发展中的作用。
1 对象和方法
1.1 研究对象 收集宁波市妇女儿童医院2010年2月至2012年9月手术切除的宫颈上皮内瘤变2~3级标本20例、宫颈鳞癌病理标本68例为研究对象,均经病理学确诊。标本采集前所有患者无放化疗史和免疫治疗史。宫颈上皮内瘤变患者年龄29~63岁,中位年龄44岁;宫颈鳞癌患者年龄31~67岁,中位年龄46岁。根据病理结果判定宫颈鳞癌组织分化程度,高分化19例,中分化42例,低分化7例;根据国际妇产科联盟2000年修订的标准划分临床分期,Ⅰ期48例,Ⅱ期20例;淋巴转移者9例,无淋巴转移者59例。选择同期因良性病变行子宫全切除术的正常宫颈组织18例为对照组,术后病理检查示宫颈组织无病变,年龄36~58岁,中位年龄47岁。以上所有标本经4%多聚甲醛固定,石蜡包埋,4μm厚连续切片,用于HE染色和免疫组化检测,且经高年资病理医师再次阅片重新核对与明确诊断。
1.2 主要试剂 羊抗人RRM2抗原特异性单克隆抗体购自美国Santa Cruz公司;链霉菌抗生物蛋白-过氧化物酶(S-P)免疫组化试剂盒及DAB显色试剂盒等购自福州迈新生物技术开发公司。
1.3 方法 采用S-P免疫组化法检测RRM2蛋白表达,一抗(1∶200稀释)4℃湿盒过夜,加热抗原修复法修复抗原,DAB显色,其余步骤严格按照试剂盒说明书操作。以PBS代替一抗作为阴性对照,RRM2已知阳性切片作为阳性对照。免疫组化结果判定标准:参照相关文献标准[2],由2名高年资病理医师判定结果。RRM2主要表达于细胞质中,每张切片随机观察10个高倍视野,每个视野计数100个细胞。RRM2细胞质中出现棕黄色颗粒为阳性细胞,阳性细胞占总细胞数的百分比≥10%为RRM2阳性,<10%为RRM2阴性。68例宫颈鳞癌中血清鳞状细胞癌抗原(SCC)和癌胚抗原(CEA)相关数据为宫颈癌患者入院常规抽血检测所得。SCC≥1.5ng/ml为阳性,CEA≥5.0ng/ml为阳性。
1.4 统计学处理 使用SPSS13.0统计软件。计数资料用率表示,组间比较采用χ2检验或Fisher’s确切概率法,检验标准α取0.05;两两比较采用χ2分割法,检验标准α取0.0167。
2 结果
2.1 RRM2在不同宫颈组织中的蛋白表达 免疫组化检测结果显示RRM2蛋白主要定位于细胞质,表现为棕黄色颗粒,见图1。RRM2蛋白在正常宫颈组织、宫颈上皮内瘤变2~3级组织和宫颈鳞癌组织中阳性表达率分别为11.11%(2/18)、55.00%(11/20)和82.35%(56/ 68),3组差异有统计学意义(χ2=32.90,P<0.05);两两比较发现,宫颈鳞癌组织RRM2蛋白表达阳性率高于正常宫颈组织和宫颈上皮内瘤变组织(均P<0.0167),宫颈上皮内瘤变组织RRM2蛋白表达阳性率高于正常宫颈组织(P<0.0167)。

图1 RRM2在不同宫颈组织中的蛋白表达(A:RRM2在正常宫颈组织中呈阴性表达;B:RRM2在宫颈上皮内瘤变组织中的表达;C:RRM2在宫颈鳞癌组织中的表达;免疫组化染色,×400)
2.2 宫颈鳞癌中RRM2蛋白表达与临床病理参数及肿瘤标志物的关系 不同年龄、临床分期、有无淋巴结转移、肿瘤标志物CEA阳性与否等宫颈鳞癌患者的RRM2蛋白阳性表达率差异均无统计学意义(均P>0.05);但在宫颈鳞癌组织分化程度、血清SCC方面差异均有统计学意义(均P<0.01),即RRM2蛋白阳性表达率高分化组低于中、低分化组,SCC阳性组高于SCC阴性组,见表1。
3 讨论
RR是DNA通路中合成与修复的关键酶,对细胞增殖、生长和分化具有重要作用。快速增殖是肿瘤细胞的重要特征之一,它可以调控RR酶活性和表达,提供比正常细胞更多的脱氧核糖核苷酸进行DNA合成。大亚基RRM1在增殖细胞的整个细胞周期中表达水平相对恒定;小亚基RRM2的表达则有细胞周期依赖性,它在G1晚期开始合成,在S期达到高峰[5]。
有研究显示RRM2在很多肿瘤中过表达,从而促进肿瘤浸润和细胞转化,对肿瘤转移、预后和耐药均产生影响[6]。有文献报道采用基因表达谱芯片技术,发现妊娠滋养细胞疾病葡萄胎组织、绒毛癌细胞中RRM2表达水平分别高于正常胎盘组织、绒毛细胞[7]。Wang等[4]通过免疫组化法和RT-PCR法证实RRM2蛋白、MicroRNA在上皮性卵巢癌组织中表达上调,RRM2表达水平与卵巢癌临床分期、预后相关,随访结果显示卵巢癌RRM2低表达患者5年生存率高于RRM2高表达者。Aird等[8]亦证实RRM2在上皮性卵巢癌细胞中表达高于正常卵巢上皮细胞、输卵管细胞,RRM2表达水平与肿瘤分期、分级相关,RRM2高表达者预示着更低的生存率,下调RRM2表达可促进肿瘤细胞死亡。Morikawa等[2]研究发现RRM2蛋白在胃癌组织中高表达,与胃癌分期、EB病毒感染、分子标记物如Survivin、DNMT1等相关;RRM2与胃癌的进展相关;同时发现通过RNA干扰技术下调RRM2表达,可抑制胃癌细胞增殖。其他肿瘤包括肝癌、结直肠癌、乳腺癌和胰腺癌等也存在RRM2高表达[3,6,9-10]。基础研究发现,RRM2与一系列癌基因如v-fms、v-src、A-raf、v-fes和c-myc等协同促进细胞转化和肿瘤形成等[11]。此外,RRM2过表达会增强肿瘤细胞的侵袭力,其机制主要是通过激活NF-κB,从而促进基质金属蛋白酶9表达增多[12];而基质金属蛋白酶9在促进肿瘤侵袭和转移中具有重要作用[13]。
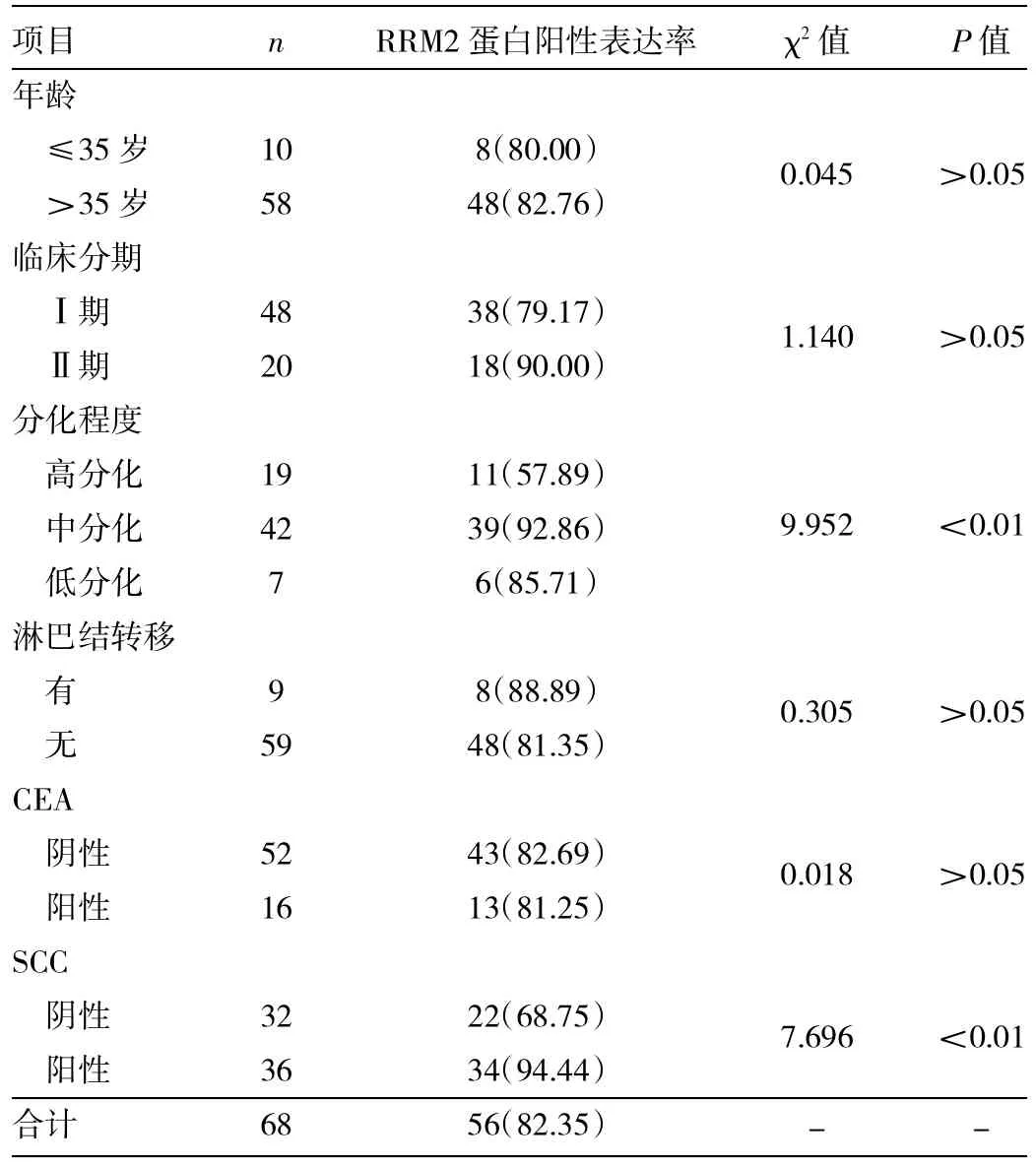
表1 宫颈鳞癌组织中RRM2表达与临床病理参数及肿瘤标志物的关系[例(%)]
Kunos等[14]采用免疫组化法检测18对宫颈良性组织和Ib2期宫颈癌组织中RR各亚基表达情况,结果显示RRM2在宫颈良性组织中低表达(0~1+),而在宫颈癌组织中有16例呈强阳性表达(3+)。我们之前研究采用qPCR法定量检测45例宫颈癌组织及相应癌旁组织中RRM2 MicroRNA表达情况,结果显示宫颈癌组织中RRM2 MicroRNA表达水平明显高于癌旁组织,差异有统计学意义[15]。RR表达水平的变化可显著影响细胞生物学特性,与肿瘤发生、发展密切相关。本研究采用免疫组化法检测不同宫颈组织中RRM2蛋白表达情况,并分析宫颈鳞癌中RRM2蛋白阳性表达率与临床病理特征、血清肿瘤标志物的关系。结果表明RRM2蛋白在宫颈鳞癌组织中的阳性表达率明显高于正常宫颈组织和宫颈上皮内瘤变2~3级组织,提示宫颈细胞增殖能力较强。此外,高分化组中RRM2蛋白阳性表达率明显低于中、低分化组,提示RRM2表达增多可能对宫颈鳞癌进展起着一定作用,RRM2可能与宫颈鳞癌细胞的侵袭性有关。由此可见,RRM2的高表达可能与宫颈鳞癌发生、发展有关。
目前宫颈癌的血清肿瘤标志物包括SCC、CEA、细胞角蛋白19片段抗原、血清中可溶性CD44等,其中SCC特异性较高,对宫颈鳞癌辅助诊断、疗效评价和预后监测具有重要临床意义[16]。相关研究表明,血清SCC水平与宫颈鳞癌的临床分期、肿瘤大小、组织分化程度、肌层浸润深度、淋巴结转移相关[17]。SCC高水平意味着宫颈癌患者对化疗的灵敏度差,易复发等[18]。但是,宫颈癌早期SCC阳性率较低,不宜作为早期筛查的指标。本研究结果显示宫颈鳞癌组织中RRM2蛋白表达水平与血清SCC有关,但有待进一步研究验证。
综上所述,RRM2在宫颈鳞癌组织中高表达,且组织分化低、血清SCC阳性者的RRM2蛋白阳性表达率偏高。但是,RRM2在宫颈鳞癌发生、发展中的作用机制以及联合RRM2与SCC的诊断价值尚待进一步研究。
[1] Shao J,Zhou B,Chu B,et al.Ribonucleotide reductase inhibitors and future drug design[J].Current cancer drug targets,2006,6 (5):409-431.
[2] Morikawa T,Hino R,Uozaki H,et al.Expression of ribonucleotide reductase M2 subunit in gastric cancer and effects of RRM2 inhibition in vitro[J].Hum Pathol,2010,41(12):1742-1748.
[3] Lee B,Ha S Y,Song D H,et al.High expression of ribonucleotide reductase subunit M2 correlates with poor prognosis of hepatocellular carcinoma[J].Gut Live,2014,8(6):662-668.
[4] Wang L M,Lu F F,Zhang S Y,et al.Overexpression of catalytic subunit M2 in patients with ovarian cancer[J].Chin Med J(Engl), 2012,125:2151-2156.
[5] Hakansson P,Hofer A,Thelander L.Regulation of mammalian ribonucleotide reduction and dNTP pools after DNA damage and in resting cells[J].J Biol Chem,2006,281(12):7834-7841.[6] LuAG,FengH,WangPX,etal.Emergingrolesoftheribonucleotide reductase M2 in colorectal cancer and ultraviolet-in duced DNA damage repair[J].World JGastroenterol,2012,18(34):4704-4713.
[7] Cui J Q,Shi Y F,Zhou H J,et al.The changes of gene expression profiles in hydatidiform mole and choriocarcinoma with hyperplasia of trophoblasts[J].Int J Gynecol Cancer,2004,14(5):984-997.
[8] Aird K M,Li H,Xin F,et al.Identification of ribonucleotide reductase M2 as a potential target for pro-senescence therapy in epithelial ovarian cancer[J].Cell Cycle,2014,13(2):199-207.
[9] Zhang H,Liu X,Warden C D,et al.Prognostic and therapeutic significance of ribonucleotide reductase small subunit M2 in estrogen-negative breast cancers[J].BMC Cancer,2014,14:664.
[10] Xie H,Lin J,Thomas D G,et al.Ribonucleotide reductase M2 does not predict survival in patients with resectable pancreatic adenocarcinoma[J].Int J Clin Exp Pathol,2012,5(4):347-355.
[11] Fan H V C,Huang A,Wright J A,et al.The mammalian ribonucleotide reductase R2 component cooperates with a variety of oncogenes in mechanisms of cellular transformation[J].Cancer Res,1998,58(8):1650-1653.
[12] Duxbury M S,Whang E E.RRM2 induces NF-kappaB-dependent MMP-9 activation and enhances cellular invasiveness[J].Biochem Biophys Res Commun,2007,354(1):190-196.
[13] Gialeli C,Theocharis A D,Karamanos N K.Roles of matrix metalloproteinases in cancer progression and their pharmacological targeting[J].FEBS J,2011,278(1):16-27.
[14] Kunos C A,Radivoyevitch T,Kresak A,et al.Elevated ribonucleotide reductaselevelsassociate withsuppressed radiochemotherapy response in human cervical cancers[J].Int J Gynecol Cancer,2012,22:1463-1469.
[15] Jin G X,Zhao J,Qi H Y,et al.Gemcitabine and carboplatin demonstrate synergistic cytotoxicity in cervical cancer cells by inhibiting DNA synthesis and increasing cell apoptosis[J].Oncotargets&Therapyr,2013,6:1707-1717.
[16] Dasari S,Wudayagiri R,Valluru L.Cervical cancer:Biomarkers for diagnosis and treatment[J].Clin Chim Acta,2015,445:7-11.
[17] Jeong B K,Choi D H,Huh S J,et al.The role of squamous cell carcinoma antigen as a prognostic and predictive factor in carcinoma of uterine cervix[J].Radiat Oncol J,2011,29(3):191-198.
[18] Yin M,Hou Y,Zhang T,et al.Evaluation of chemotherapy response with serum squamous cell carcinoma antigen level in cervicalcancerpatients:aprospectivecohortstudy[J].PLoSOne, 2013,8(1):e54969.
Expression of ribonucleotide reductase subunit M2 in cervical squamous-cell carcinoma tissues
JIN Guixiu. YANG Haitao. LIN Yi. et al. Department of Obstetrics and Gymecology. Taizhou First People's Hospital. Taizhou 318020. China
ObjectiveTo investigate protein expression of ribonucleotide reductase subunit M2(RRM2)in cervical squamous-cell carcinoma.MethodsThe expression of RRM2 was detected by immunohistochemistry staining in 68 specimens of cervical squamous-cell carcinoma,20 specimens of cervical intraepithelial neoplasm(CIN)and 18 specimens of normal cervical tissue.The relationship of RRM2 expression with clinicopathology features and tumor biomarkers was analyzed.ResultsThe positive RRM2 expression rate in cervical squamous-cell carcinoma tissue(82.35%)was significantly higher than that in CIN (55.00%)and normal cervical tissue(11.11%)(P<0.05).The positive expression rate of RRM2 in well-differentiated carcinoma was lower than that in moderately-and poorly-differentiated carcinoma.The expression of RRM2 in serum squamous cell carcinoma antigen(SCCA)positive group was higher than that in SCCA negative group(P<0.01).ConclusionThe overexpression of RRM2 is found in cervical squamous-cell carcinoma,in particular,in those with lower differentiation degree and with positive serum SCCA.
Cervical squamous neoplasm RRM2 Immunohistochemistry Squamous cell carcinoma-related antigen
2015-10-14)
(本文编辑:陈丹)
浙江省医药卫生一般研究计划(2014KYB241)
318020 台州市第一人民医院妇产科(金闺秀);宁波市临床病理诊断中心(杨海涛);宁波市妇女儿童医院妇产科(林毅、钟惠珍)
钟惠珍,E-mail:nbfeyyzhz@163.com

