3-甲基腺嘌呤对EPCs超微结构和LC3-Ⅱ蛋白表达的影响研究
朱人大 李晓强
3-甲基腺嘌呤对EPCs超微结构和LC3-Ⅱ蛋白表达的影响研究
朱人大 李晓强
目的 探索3-甲基腺嘌呤(3-MA)对大鼠骨髓源性内皮祖细胞(EPCs)超微结构和自噬体膜型(LC3-II)蛋白表达的影响。方法采用密度梯度法取大鼠骨髓EPCs,体外诱导分化并鉴定;分成对照组和4个3-MA浓度组(分别加入1.25、2.5、5、10mmol/L 3-MA)。采用单丹(磺)酰戊二胺(MDC)荧光染色和透射电镜观察3-MA给药后EPCs自噬的发生。Western blot检测3-MA给药后EPCs内LC3-II蛋白表达的变化。结果MDC荧光染色和透射电镜均观察到5、10 mmol/L组EPCs超微结构明显区别于正常及死亡细胞,是典型的凋亡形态图。Western blot检测3-MA给药24h后EPCs LC3-II蛋白表达降低;与对照组比较,5、10 mmol/L组LC3-II蛋白表达明显降低(P<0.05)。结论5、10mmol/L的3-MA对EPCs超微结构和LC3-II蛋白表达均有影响,推测浓度≥5mmol/L的3-MA能抑制EPCs的自噬。
内皮祖细胞 单丹(磺)酰戊二胺 3-甲基腺嘌呤
Asahara等[1]于1997年首次详细描述了内皮祖细胞(EPCs)在缺血组织新生血管形成中的作用,近年来EPCs已成为研究热点[2-4]。深静脉血栓形成(DVT)是一种临床常见病、多发病,据统计,美国每年至少有500万人患DVT,我国每年DVT新发病例超过25万,目前主要有保守治疗和手术取栓两种治疗方法,对于7d内急性期血栓效果尚可,对于慢性期血栓的效果欠佳。选择更为有效的治疗方法来提高DVT治愈率、降低后遗症发生率以及促进血栓再通是当前的研究热点。我们前期研究发现EPCs能改变血栓的微环境,而血栓机化、再通均与微环境密切相关,将经鉴定的EPCs移植到慢性血栓中,能有效促进血栓机化与再通[5]。3-甲基腺嘌呤(3-MA)是当前公认的自噬抑制剂,前期实验证实一定浓度的3-MA可促进EPCs增殖,本研究进一步检测各种浓度3-MA对EPCs自噬的抑制作用,以探讨其对细胞超微结构和自噬体膜型(LC3-Ⅱ)蛋白表达的影响。
1 材料和方法
1.1 材料、试剂及检测仪器 3周龄的Wistar大鼠20只,体重50~80g,雌雄不限,由中国生命科学院上海实验动物中心提供;EGM-2MV EPCs培养基,美国Chemicon公司生产;3-MA、单丹(磺)酰戊二胺(MDC)、βactin(A5441)抗体、FITC-二抗,均由美国Sigma公司生产;BCA蛋白定量试剂盒,美国Pierce公司生产;LC3抗体,美国Santa Cruz公司生产;TMB显色液(TMB Stabilized Substrate for HRP),Promega公司生产。倒置显微镜(Olympus)、倒置荧光显微镜(eclipse TE2000-U型),由苏州大学血液研究所提供,日本Nikon公司生产;切片机(LKB-1型)、透射电镜(CM-120型)均由上海复旦大学医学院电镜室提供,荷兰Philips公司生产。
1.2 方法
1.2.1 EPCs培养、鉴定 无菌条件下分离出大鼠股骨,冲出骨髓,制成单细胞悬液备用。加入EPCs培养基(EGM-2MV),青、链霉素以(0.8~1.0)×106/cm2密度接种于培养瓶,5%CO2、37℃环境下培养。培养至第12天,PBS洗涤,贴壁细胞备用。用免疫组化和免疫荧光鉴定EPCs特异性标志VEGFR-2、CD34和CD133的表达。
1.2.2 实验分组 细胞培养12d,胰蛋白酶消化、重悬呈单细胞悬液,分为5个实验组,即对照组(仅加入EGM-2MV)、3-MA组(分别加入1.25、2.5、5、10mmol/L 3-MA),并于24h后收集细胞,计算每组细胞数量并作及时调整,使各组细胞数量基本相等。
1.2.3 MDC荧光染色检测 (1)MDC染色液配制:取MDC粉末溶于二甲基亚砜中,终浓度为0.1mol/L,分装后-20℃保存;临用前用EGM-2MV培养基稀释为50μmol/L。(2)MDC荧光染色:取对数生长期EPCs,调整细胞浓度后接种于24孔板,次日给予含各浓度3-MA的EGM-2MV,对照组仅加入培养基;给药24h后改用含MDC的新鲜培养基孵育10min;PBS洗涤细胞2次;用紫外线激发,在倒置荧光显微镜下观察、摄片。
1.2.4 透射电镜观察3-MA对EPCs超微结构的影响(1)取对数生长期EPCs,在对照组和3-MA(5、10mmol/ L)的EGM-2MV培养基给药24h后收集细胞,PBS离心洗涤,将细胞收集于离心管中;(2)固定;(3)脱水;(4)浸透;(5)固化;(6)LKB-1型超薄切片机切片(50~60nm);(7)3%醋酸铀-枸橼酸铅双染色;(8)Philips CM-120透射电镜下观察、摄片。
1.2.5 Western blot检测观察3-MA对EPCs LC3蛋白表达的影响 (1)样品制备:对照组与不同浓度3-MA组,24h后收集细胞,PBS洗涤,用细胞刮刀刮下细胞,细胞悬液充分离心,往沉淀中加入适量含PMSF的细胞裂解液(PMSF:裂解液=1∶50),吹匀,置冰上30min以充分裂解细胞;加入5×样品缓冲液,100℃煮沸8min,离心10min,取上清液,样品即可使用,也可-20℃冻存备用。(2)聚丙烯酰胺凝胶电泳(SDS-PAGE)。(3)Western blot检测蛋白转膜。(4)蛋白质免疫检测:封闭、一抗、洗膜、二抗、洗膜、TMB显色。(5)图像分析:用Image J软件得出图片中目的条带灰度值,并除以内参GAPDF灰度值,得出该样品目的蛋白相对含量;每组数据重复测量3次。
1.3 统计学处理 使用SPSS13.0统计软件,计量资料满足方差齐性,用表示,多组间比较采用单因素方差分析,两组间比较采用配对t检验。
2 结果
2.1 MDC荧光染色检测3-MA对EPCs的自噬作用给药24h后,对照组、1.25mmol/L组和2.5mmol/L组均有点状荧光颗粒散布于EPCs细胞质内,而5、10mmol/L组的EPCs细胞质内无荧光颗粒出现,见图1。

图1 对照组与不同浓度3-MA给药24h后EPCs倒置荧光显微镜下所见(MDC荧光染色,×400)
2.2 透射电镜观察3-MA对EPCs超微结构的影响 细胞培养12d后电镜下观察,对照组细胞质内线粒体、溶酶体等细胞器,细胞核及核内染色体形态与分布均正常,见图2A;细胞质内有少量明显的独立双层膜结构自噬囊泡出现,见图2B。5、10mmol/L组给药24h后,可以观察到细胞质发生固缩,染色质浓缩、边集,呈境界分明的半月状或块状附于核膜,可见到细胞核发生固缩、断裂,这种超微结构明显区别于正常及死亡细胞,是典型的凋亡形态图,见图2C、2D。对照组细胞质中出现独立双层膜结构自噬囊泡,加药组中没有出现独立双层膜结构自噬囊泡和自噬溶酶体。加药组细胞质内部分线粒体发生肿胀、变圆,个别细胞空泡化,基质变浅,嵴变少,出现纵向嵴和同心圆嵴,可见到空泡状的粗面内质网。在整个观察中,未见细胞肿胀等坏死形态特征出现,见图2。
2.3 不同浓度3-MA给药24h后EPCs LC3-Ⅱ蛋白表达 给药24h后,与对照组 (0.9936±0.052)比较,1.25mmol/L组(0.9654±0.039)、2.5mmol/L组(0.9513±0.036)LC3-Ⅱ蛋白表达变化不明显(均P>0.05),而5mmol/L组(0.7604±0.051)、10mmol/L组(0.7007±0.020)LC3-Ⅱ蛋白表达明显降低(均P<0.05)。
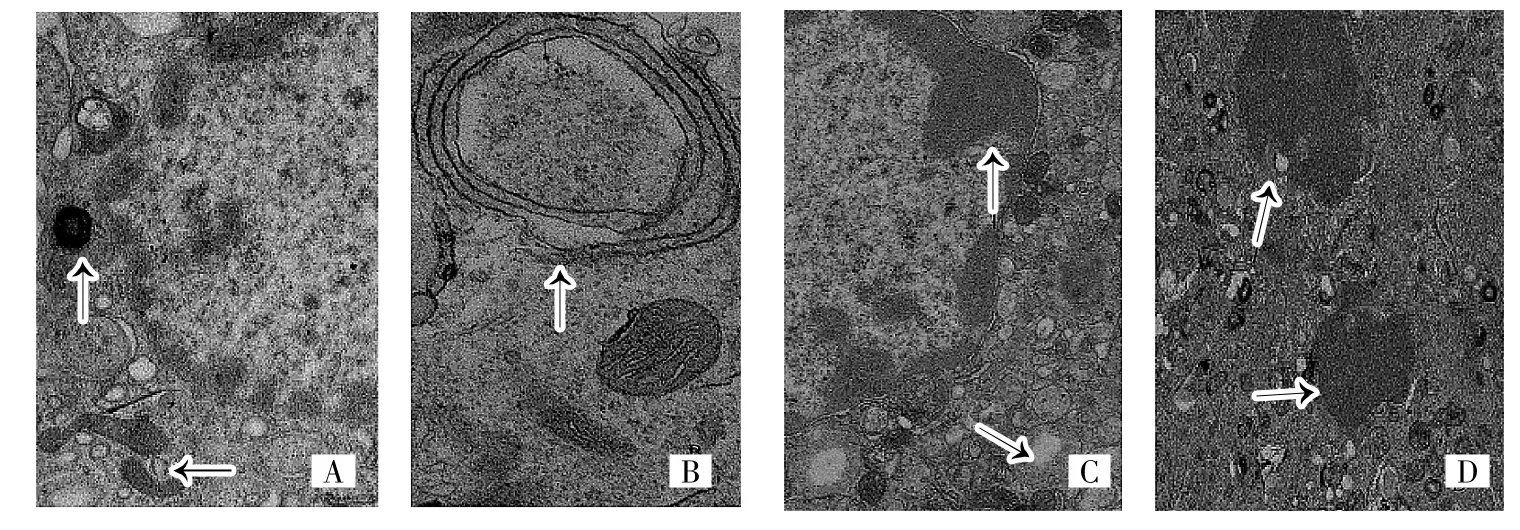
图2 透射电镜下EPCs超微结构(A:对照组细胞核内常染色质较多,细胞质内线粒体等细胞器形态、分布均正常;B:对照组细胞质内可见自噬双层膜结构;C:5mmol/L组给药24h后可见核内染色质边集,异染色质增多,细胞质内线粒体发生肿胀、变圆,未见到明显的自噬双层膜结构;D:10mmol/L组给药24h后可见核固缩、断裂,细胞质内线粒体发生肿胀,嵴变少、变圆,未见到明显的自噬囊泡和自噬溶酶体)
3 讨论
自噬是真核细胞中广泛存在的生命现象,是生物发育、老化过程中净化自身多余或受损细胞器的共同机制。由于细胞自噬的发生与Ⅲ型磷脂酰肌醇3-磷酸激酶(PI3K)关系密切,PI3K的抑制剂可以干扰或阻断自噬体形成,而特异性自噬抑制剂3-MA通过这种方式发挥作用[6]。
本研究观察3-MA对EPCs超微结构和LC3-Ⅱ蛋白表达的影响,受当前检测方法的限制,全面深入研究自噬仍是一大难题。MDC是一种特异性自噬标记物,可被细胞吸收并选择性地聚集于自噬囊泡中,在荧光显微镜下可观察到染上MDC荧光的自噬囊泡呈点状结构,散布于细胞质和细胞核周围;因此可根据细胞内荧光颗粒变化来推断自噬的活化[7]。透射电镜可形象观察到独立双层膜、自噬体等自噬过程中各形态变化,是可靠的自噬检测手段[8]。实验结果显示给药24h后,对照组、1.25mmol/L组和2.5mmol/L组细胞质中有点状荧光颗粒散布于EPCs细胞质内,而5、10mmol/L组均无荧光颗粒出现;以上提示5、10mmol/L的3-MA给药24h后自噬囊泡和荧光颗粒明显减少,提示已抑制EPCs自噬的发生;1.25、2.5mmol/L组细胞质中可见明显的荧光颗粒,说明低浓度3-MA尚不能完全抑制EPCs自噬的发生。细胞培养12d后电镜下观察,对照组细胞质内线粒体、溶酶体等细胞器,细胞核及核内染色体的形态与分布均正常,细胞质内出现少量明显的独立双层膜结构自噬囊泡;而5、10mmol/L组给药24h后,可以观察到细胞质发生固缩,染色质浓缩、边集,呈境界分明的半月状或块状附于核膜,可见到细胞核发生固缩、断裂,这种超微结构明显区别于正常及死亡细胞,为典型的凋亡形态图。对照组细胞质中出现独立双层膜结构自噬囊泡,而加药组无明显的独立双层膜结构自噬囊泡和自噬溶酶体出现。此外,加药组细胞质内部分线粒体发生肿胀、变圆,个别细胞空泡化,基质变浅,嵴变少,出现纵向嵴和同心圆嵴,可见到空泡状的粗面内质网。在整个观察中,未见细胞肿胀等坏死形态特征的出现。
自噬相关蛋白Atg8是含117个氨基酸的蛋白,早期的独立膜、自噬体及自噬小体表面均有此蛋白。LC3是Atg8的哺乳动物类似物,能靶向定位于自噬体膜,并始终保留在膜上,与磷脂酰乙醇胺的泛素样结合,自噬诱导发生后,在Atg3的催化下,磷脂酰乙醇胺结合至LC3-ⅠC端甘氨酸残基,生成脂溶性LC3-Ⅱ,是自噬过程中膜动力学很好的标志物,也是目前可靠的自噬体标志物[9-10]。LC3-Ⅱ含量多少与自噬囊泡多少成正比,LC3-Ⅱ被认为是自噬标志分子。通过检测细胞内LC3-Ⅱ含量可以判断自噬被诱导或抑制[10]。实验结果表明,与对照组比较,1.25、5mmol/L组EPCs LC3-Ⅱ蛋白表达变化不明显,5、10mmol/L组给药24h后LC3-Ⅱ蛋白表达明显降低,且有浓度依赖性。故推测浓度≥5mmol/L的3-MA能抑制EPCs的自噬。
本研究初步探讨了几种不同浓度的自噬抑制剂3-MA对EPCs自噬的影响,为抑制自噬来提高EPCs活力和数量、促进血栓机化再通提供依据。
[1] Asahara T,Murohara T,Sullivan A,et al.Isolation of putative pro-genitor endothelial cells for angiogenesis[J].Science,1997,275: 964-967.
[2] 杜利,刘亢丁.内皮祖细胞生物学特征及其临床应用[J].中国组织工程研究与临床康复,2011,40:7581-7584.
[3] Li X Q,Meng Q Y,Wu H R,et al.Effects of bone marrow-derived endothelial progenitor cell transplantation on vein microenvironmentinaratmodelofchronicthrombosis[J].ChineseMedicalJournal,2007,120(24):2245-2249.
[4] 李桂琼,陈庆伟.内皮祖细胞移植策略研究进展[J].心血管病进展, 2011,3:411-414.
[5] 朱人大,李晓强,孟庆友,等.3-MA对大鼠EPCs增殖、凋亡及细胞周期影响的实验研究[J].中华普通外科杂志,2011,26:562-565.
[6] 喻琴琴,杨俊,李馨.自噬及其抑制剂的研究进展[J].实用医学杂志, 2013,17:2908-2910.
[7] Daniela B M,Mar a I C.A novel assay to study autophagy:regulation of autophagosome vacuole size by amino acid deprivation [J].J Cell Sci,2001,114(20):3619-3629.
[8] Martinet W,De Meyer G R,Andries L,et al.In Situ Detection 0f Starvation-induced Autophagy[J].J Histochem Cytoehem,2005, 7:Epub ahead of print.
[9] 潘明娇,王小丹,喻陆.自噬途径常用分子生物学指标在反映自噬活性上的意义[J].医学综述杂志,2015,5:784-786.
[10] Tanida I,Ueno T,Kominami E.LC3 conjugation system in mammalian autophagy[J].Int J Biochem Cel Biol,2004,36(12): 2503-2518.
Effect of 3-methlyadenineon ultrastructure and LC3-II expression of rat endothelial progenitor cells
ZHU Renda. LI Xiaoqiang. Department of Vascular Surgery. the Second Affiliated Hospital of Soochow University. Suzhou 215004. China
Objective To investigate the effect of 3-methlyadenine(3-MA)on ultrastructure and LC3-II protein expression in rat bone marrow-derived endothelial progenitor cells(EPCs).MethodsMononuclear cells(MNCs)were isolated from rat bone marrow;the EPCs were induced from cultured MNCs and identified.The induced rat EPCs were treated with different concentrations of 3-MA(0,1.25,2.5,5,10mmol/L).Monodansylcadaverine staining and transmission electron microscopy(TEM) were used to examine cell autophagy induced by 3-MA in rat EPCs.Western blot analysis was used to detect the LC3-II protein expression.ResultsAutophagy inhibition was observed in EPCs by 3-MA at concentration of 5mmol/L and 10mmol/L by both MDC staining and TEM.LC3-II protein expression in EPCs was decreased aftertreatment of 5mmol/L and 10mmol/L 3-MA as detected by western blot(P<0.05).ConclusionHigh dose of 3-MA caninduce the ultrastructural changes and reduce LC3-II expression in rat bone marrow-derived epithelial progenitor cells.
Endothelial progenitor cellMonodansylcadaverine 3-methlyadenine
2015-04-28)
(本文编辑:陈丹)
国家自然科学基金资助项目(30972941)
215004 苏州大学附属第二医院血管外科(朱人大、李晓强,朱人大系全日制研究生,现在海宁市人民医院血管外科工作)
李晓强,E-mail:flytsg@126.com

