不同灭菌方法对烟草和拟南芥种子萌发及无菌苗生长的影响
张晶华,马亚丽,兰海燕
(1.新疆大学生命科学与技术学院/新疆生物资源基因工程重点实验室,乌鲁木齐 830046;2.新疆大学资源与环境科学学院,乌鲁木齐 830046;3.新疆教育学院,乌鲁木齐 830043)
不同灭菌方法对烟草和拟南芥种子萌发及无菌苗生长的影响
张晶华1,马亚丽2,3,兰海燕1
(1.新疆大学生命科学与技术学院/新疆生物资源基因工程重点实验室,乌鲁木齐 830046;2.新疆大学资源与环境科学学院,乌鲁木齐 830046;3.新疆教育学院,乌鲁木齐 830043)
【目的】在植物转基因研究中及时获得大量健壮的无菌苗是后续实验的基础。研究种子的灭菌处理方法对种子萌发及随后的幼苗生长的影响。【方法】以烟草和拟南芥种子为材料,通过比较次氯酸钠(NaClO)灭菌后用无水乙醇或/和灭菌水单独或交替处理的效果,研究其对拟南芥粘液质种子和烟草无粘液质种子的萌发和无菌幼苗生长的影响。【结果】无水乙醇对烟草种子萌发及幼苗生长有显著抑制作用,萌发率、幼苗根长和株高等均显著降低;无水乙醇短时间处理能促进拟南芥萌发、幼苗生长及叶片数的增多,而无水乙醇长时间处理只能促进拟南芥主根的伸长。结合种子萌发和幼苗的生长状况,10%NaClO处理4 min后用灭菌水润洗对烟草种子灭菌效果最好;10%NaClO处理4 min后,先无水乙醇润洗2次,再灭菌水润洗3次对拟南芥种子灭菌效果最好。【结论】烟草和拟南芥均属于小种子类型,但二者最佳灭菌方法显著不同,为两种转基因模式植物烟草和拟南芥种子的灭菌方法提供参考依据。
烟草;拟南芥;灭菌方法;种子萌发;幼苗生长
0 引 言
【研究意义】烟草(Nicotiana tabacum)和拟南芥(Arabidopsis thaliana)作为目前转基因研究的典型模式植物已被广泛应用[1]。在植物遗传转化过程中,获得长势良好的无菌苗是实验成功的前提[2-4]。烟草和拟南芥均属小种子类型,但前者无粘液质后者有粘液质[5],其种子灭菌方法有较大差异。在实验过程中常由于种子灭菌方法不当,造成灭菌不彻底、种子腐烂霉变或培养基污染,从而严重影响实验效果[6]。【前人研究进展】目前对烟草和拟南芥种子的灭菌主要采用 70%或75%乙醇、0.1%升汞、0.1%或 0.5%硫酸铜、5%或10%H2O2、0.1%氯化汞以及不同浓度的次氯酸钠等溶液漂 洗[1,2,7-11]。然而,烟 草 和 拟 南芥种子灭菌的最后润洗过程各有不同。烟草种子均采用灭菌水润洗;拟南芥种子有些采用灭菌水润洗,有些则用 0.02%的吐温或 75%乙醇润洗[12-20],润洗产生的结果各不相同,其中75%乙醇润洗种子萌发率可达 100%[18,19],显著高于其他方法。【本研究切入点】实验对烟草和拟南芥种子采用无水乙醇和10%NaClO灭菌,然后用无水乙醇或/和灭菌水单独或交替润洗[1]等各种不同处理,对烟草和拟南芥种子萌发(日萌发率、发芽势、发芽率和发芽指数)[11,21]及无菌苗生长状况(活力指数[11]、主根长[2]以及幼苗的株高和叶片数)进行观察。【拟解决的关键问题】研究不同灭菌后处理方法对烟草和拟南芥种子萌发及无菌苗生长的影响,寻求两种模式植物最佳的种子灭菌与后处理方法的组合,快速获得生长良好的无菌苗,为后续的高效遗传转化奠定基础。
1 材料与方法
1.1 材 料
供试烟草(W438)和拟南芥(Columbia-0)种子为实验室2014年繁殖并于 4℃保存。实验前已对两种种子进行预萌发以保证使用的种子均有活力,其萌发率分别为96.7%和93.3%。
1.2 方 法
1.2.1 灭菌和润洗处理
烟草和拟南芥种子先用无水乙醇处理 30 s,再用10%NaClO处理 4 min,然后用灭菌水分别润洗0次(CK)至5次(表示为:w+1、w+2、w+3、w+4、w+5),或用无水乙醇分别润洗 1次至5次(表示为 e+1、e+2、e+3、e+4、e+5)。随后设计不同润洗组合处理,具体如下:(1)w+5;(2)先e+1后w+4;(3)先e+2后w+3;(4)先e+3后w+2;(5)先 e+4后w+1;(6)e+5。之后将处理好的种子放在无菌操作台中晾干备用。
1.2.2 种子萌发实验及幼苗生长测定
将种子置于 12 h光照/12 h黑暗,光照强度3 000~5 000 lux,温度 25~27℃,湿度 40% ~60%的温室中培养。(1)将烟草和拟南芥种子点在MS培养基(大量元素、微量元素、有机元素、铁盐,3%蔗糖和 0.7%琼脂)的 9cm培养皿里,每皿分四个象限即四个重复,每重复 30粒,用保鲜膜封口,每天观察记录种子萌发情况。(2)将烟草和拟南芥种子点在 MS培养基(配方同上)的10cm方皿中垂直培养,每个方皿 13粒,每个处理3个重复,之后用保鲜膜封口,7 d后观察种子的生根情况并照相。(3)待种子萌发14 d后,将方皿中的幼苗移至含有 MS培养基的广口瓶中继续培养,30d后测株高,观察并记录叶片数,每个处理测定 10株幼苗。
1.2.3 种子发芽势、发芽率、发芽指数、活力指数的计算[11,21]
种子萌发以胚芽突破种皮露白长度为种子长度的一半时(如烟草)或胚根伸长至与种子等长(如拟南芥)为标准[2]。

1.2.4 幼苗主根长、株高的测量及叶片数的计算
主根长:随机选取长势相似的萌发14 d后的烟草和拟南芥幼苗,每处理 26株,测量主根长。株高和叶片数:随机选取长势相似的萌发30d后的烟草和拟南芥幼苗,每处理10株,测量株高,统计叶片数。
1.3 数据统计
对烟草和拟南芥的主根长和株高采用软件Image J 1.48V进行统计,所有数据采用软件Graphad Prism 5.0进行处理,用SPSS 19.0(美国SPSS公司)进行单因素方差分析(One-way ANOVA),并进行差异显著性检验。
2 结果与分析
2.1 不同灭菌润洗处理对烟草和拟南芥萌发指标的影响
2.1.1 萌发率变化
研究表明,灭菌后不润洗对烟草种子萌发无显著作用;而拟南芥种子萌发则受到显著抑制;灭菌水润洗两种种子萌发率均较高,随润洗次数增加烟草萌发率呈增加趋势,而拟南芥则呈降低趋势;无水乙醇润洗完全抑制无粘液质烟草种子的萌发,而粘液质拟南芥种子仍保持一定萌发率。无水乙醇对粘液质种子萌发的影响小于无粘液质种子。图1

图1 不同灭菌润洗处理下烟草(A)和拟南芥(B)发芽势变化Fig.1 Effects of different rinse treatments after sterilization on germination potential with N.tabacum(A)and A.thaliana(B)
通过水和无水乙醇不同润洗处理的组合实验,对日萌发情况统计结果显示:烟草对照组(w+5)从第2 d开始萌发,至第7 d基本稳定,萌发率达95.83%(图2A);而e+1,w+4处理的到第5 d初萌,第 7 d萌发率仅为5.83%;其余处理的萌发率几乎为0(图2A;图3)。由此显示,无水乙醇润洗极显著地抑制烟草种子萌发(P<0.001)。拟南芥在w+5或e+5处理的种子萌发情况类似均低且慢,到第7 d时萌发率为 38.33%或50.83%(图2B);而其他处理的萌发趋势一致,到第7 d时萌发率均超过94.0%(图2B;图4)。由此可见,无水乙醇和灭菌水结合润洗方法能极显著提高拟南芥的萌发率。图2,图3,图4

图2 不同灭菌润洗处理下烟草(A)和拟南芥(B)日萌发变化Fig.2 Effects of different combination of rinse treatments after sterilization on everyday germination with N.tabacum(A)and A.thaliana(B)

图3 不同灭菌润洗处理7 d后烟草萌发Fig.3 The effect of different rinse treatment after sterilization for 7 days on N.tabacum germination

图4 不同灭菌润洗处理7 d后拟南芥萌发Fig.4 Effect of different rinse treatment after sterilization for 7 days on A.thaliana germination
2.1.2 发芽指数和活力指数的变化
研究表明,烟草处理组(以 w+5为对照)的种子发芽势、发芽率、发芽指数和活力指数与对照组相比均有极显著差异(P<0.001),显示无水乙醇强烈抑制烟草萌发并降低种子活力。拟南芥种子在e+5处理下的发芽势、发芽指数和活力指数与对照相比无显著差异,而其他四种处理与对照差异极显著。拟南芥处理组种子发芽率除了 e+5,其余与对照组相比均有显著差异(P<0.01)。先e+2后 w+3的种子活力指数最高。说明无水乙醇短时间处理能够促进拟南芥种子萌发。表1
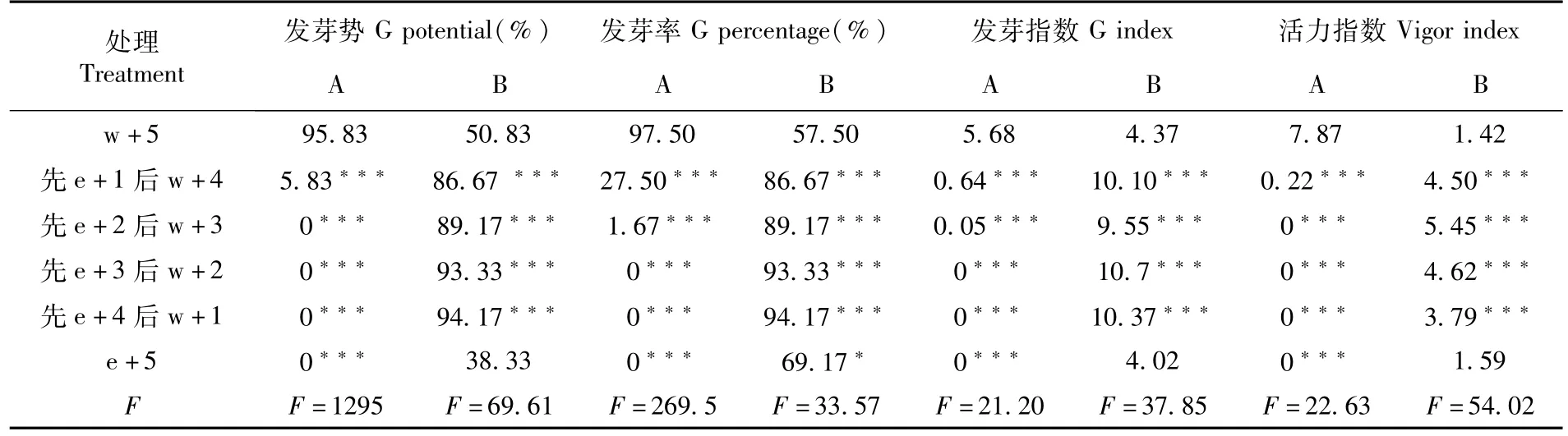
表1 不同灭菌润洗处理下烟草(A)和拟南芥(B)发芽势、发芽率、发芽指数及活力指数变化Table 1 Effects of different rinse treatment after sterilization on germination(G)potential,G percentage,G index and vigor index with N.tabacum(A)and A.thaliana(B)
2.2 不同灭菌润洗处理对烟草和拟南芥幼苗的影响
2.2.1 幼苗根长的变化
对烟草和拟南芥幼苗的主根长测量(以w+5作为对照)结果显示,烟草处理组的主根长极显著低于对照组(P<0.001),显示无水乙醇抑制烟草幼苗根的伸长(图5A);拟南芥处理组的主根长与对照无显著差异,但随着无水乙醇润洗时间延长,拟南芥主根长有增加趋势(图5B)。图5
2.2.2 幼苗株高和叶片数变化
对烟草和拟南芥幼苗的株高和叶片数测量(以w+5为对照),结果显示:烟草处理组除(先e+1后 w+4)的株高和叶片数显著低于对照组外,其他乙醇处理组种子均未萌发;拟南芥除 e+5外,其他处理的株高和叶片数均显著高于或不低于对照,先e+1后w+4处理的株高最高,而先e+2后w+3处理的叶片数最多。以上结果显示无水乙醇显著抑制烟草种子萌发及幼苗生长;而无水乙醇短时间处理能够促进拟南芥幼苗增高及叶片数增多。图6

图5 不同灭菌润洗处理下烟草(A)和拟南芥(B)主根长变化Fig.5 Effects of different rinse treatment after sterilization on main root length with N.tabacum(A)and A.thaliana(B)

图6 不同灭菌润洗处理下烟草和拟南芥株高及叶片数变化Fig.6 Effects of different rinse treatment after sterilization on plant height and leaf number with N.tabacum and A.thaliana

表2 不同灭菌润洗处理下烟草(A)和拟南芥(B)萌发率、活力指数及幼苗生长变化Table 2 Effects of different sterilization on germination(G)percentage,vigor index and seedling growth with N.tabacum(A)and A.thaliana(B)
对烟草和拟南芥的萌发率、活力指数、主根长和叶片数比较结果显示,无水乙醇强烈抑制烟草的萌发、主根伸长、降低种子活力、抑制幼苗株高增加及叶片数增多;无水乙醇短时间处理能够促进拟南芥萌发、主根伸长、增强种子活力、促进幼苗株高增加及叶片数增多。但无水乙醇长时间处理则对拟南芥幼苗的萌发、幼苗生长产生明显抑制作用(P<0.01)。表2
3 讨 论
植物遗传转化中无菌苗的准备是转基因成功的前提条件[2-4]。种子在无菌条件下萌发并成为健壮的无菌苗受多种因素影响,如种皮的限制、消毒剂类型、灭菌时间等均能导致种子萌发率降低或不能萌发[6,22],因此选择高效快速的灭菌方法对后续实验具有良好的促进作用。通常种子在灭菌处理后的润洗多采用灭菌水,但对于不同类型的种子如粘液质种子则通常采用乙醇润洗[1,19]。为了深入探索两种润洗方式的区别并为后续实验提供参考,研究中比较了具粘液质拟南芥种子和无粘液质烟草种子的润洗方法。结果显示,用无水乙醇和灭菌水交替润洗与无水乙醇或灭菌水单独润洗相比能够显著促进拟南芥种子的萌发,萌发率均达到90%以上;而乙醇的添加对无粘液质的烟草种子萌发具有强烈的抑制作用(终萌发率小于30%)。前人研究显示,粘液质对种子萌发及抵御不良环境具有重要生态学意义,当环境水分充足时,粘液层形成一个天然屏障阻隔有害物质入侵[23]。然而种子粘液层的形成在一定程度上也阻碍了胚根生长[23,24]。而乙醇润洗能够吸走水分使粘液层变薄从而减弱对胚根突破种皮的束缚作用,因此研究中拟南芥种子的胚根长度随无水乙醇润洗次数的增加而呈增加趋势(图5B)。而对烟草无粘液质种子而言,无水乙醇润洗带走了种子中的部分水分,从而使种子萌发受到强烈抑制。同为小种子,有无粘液质对灭菌方法的选择具有重要意义。
不同润洗方法还能导致后期幼苗生长状况的差异,从而使遗传转化效率及随后的转基因植物表型鉴定造成误差[25]。研究不同润洗方法结果显示,无水乙醇润洗显著抑制烟草幼苗生长;拟南芥幼苗的侧根数随无水乙醇与水交替组合不同而产生显著差异,且与主根长的结果相反。此外,拟南芥幼苗株高和叶片数随无水乙醇润洗次数增加呈先升高后降低的趋势,该结果与胡远等[26]结果相似,说明用无水乙醇短时间润洗抑制烟草但能促进拟南芥株高和叶片数的增加。
种子萌发和幼苗生长是一个复杂的生理过程,实验对具粘液质和无粘液质种子无菌培养灭菌后润洗方法进行了初步探索,获得的结果将为植物遗传转化及转基因株系的表型检测提供理论依据。
4 结 论
4.1 采用不同润洗方法对烟草和拟南芥种子进行处理,结果表明,无水乙醇对烟草种子的萌发具有强烈的抑制作用;无水乙醇短时间处理能够促进拟南芥种子的萌发。
4.2 无水乙醇对烟草幼苗的主根、株高和叶片数均有强烈抑制作用;无水乙醇短时间处理能够极显著促进拟南芥幼苗的株高增加和叶片数增多,而长时间处理则产生抑制效应。
4.3 研究采用无水乙醇 +10%NaClO+灭菌水润洗5次的组合方法对烟草种子灭菌效果最好;无水乙醇 +10%NaClO+[无水乙醇洗2次+灭菌水洗3次]的组合对拟南芥种子灭菌效果最好。
(
)
[1]鲁黎明,安影.不同消毒剂对烟草种子消毒效果及萌发的影响[J].种子,2012,31(4):93-95. LU Li-ming,AN Ying.(2012).Effects of different disinfectant on sterilization effect and germination of tobacco seeds[J]. Seed,31(4):93-95.(in Chinese)
[2]顾万荣,李召虎,翟志席,等.DCPTA和DTA-6对拟南芥种子萌发和根系生长发育的影响[J].中国农学通报,2008,4(6):37-43. GU Wan-rong,LI Zhao-hu,ZHAI Zhi-xi.et al.(2008). Effect of DCPTA and DTA-6 on the root growth and seed germination of Arabidopsis[J].Chinese Agricultural Science Bulletin,4(6):37-43.(in Chinese)
[3]郭瑾,薛永来,杜道林.植物激素调控拟南芥根系发育的研究进展[J].江苏农业科学,2014,42(5):7-10. GUO Jin,XUE Yong-lai,DU Dao-lin.(2014).Advances in the hormonal regulation of root development in Arabidops thaliana[J].Jiangsu Agricultural Sciences,42(5):7-10.(in Chinese)
[4]唐琳,刘建国,马欣荣.两种灭菌方法对番茄种子灭菌效果的评价[J].种子,2008,27(9):17-18. TANG Lin,LIU Jian-guo,MA Xin-rong.(2008).Evaluation the efficiency of sterilizing tomato seeds with two sterilants[J].Seed,27(9):17-18.(in Chinese)
[5]Francoz,E.,Ranocha,P.,Burlat,V.,& Dunand,C.(2015).Arabidopsis,seed mucilage secretory cells:regulation and dynamics.Trends in Plant Science,20(8):515-524.
[6]莫良玉,吴良欢,陶勤南.植物有机营养研究中供试种子组合灭菌方法比较[J].浙江大学学报,2000,26(6):643-646. MO Liang-yu,WU Liang-huan,TAO Qin-nan.(2000). Studies on combinative sterilization method to seed for plant organic nutrient experiments[J].Journal of Zhejiang University(Agric&Life Sci.),26(6):643-646.(in Chinese)
[7]赵华超.转 MiARF2基因对烟草和拟南芥不定根形成的影响[D].广州:中山大学硕士论文,2009. ZHAO Hua-chao.(2009).Effects of MiARF2 Overexpression on adventitious root formation of the transgenic tobacco and Arabidopsis[D].Master Dissertation.Zhongshan University,Guangzhou.(in Chinese)
[8]Frazier,T.P.,Burklew,C.E.,&Zhang,B.(2014).Titanium dioxide nanoparticles affect the growth and microrna expression of tobacco(nicotiana tabacum).Functional&Integrative Genomics,14(1):75-83.
[9]赵小英.蓝光抑制拟南芥下胚轴伸长和诱导种子萌发的生化分析[D].长沙:湖南大学硕士论文,2006. ZHAO Xiao-ying.(2006).A biochemical study on inhibition of hypocotyl elongation and induced the seed germination by blue light in Arabidops thaliana[D].Master Dissertation.Hunan U-niversity,Changsha.(in Chinese)
[10]陆玉建,高春明,郑香峰,等.盐胁迫对拟南芥种子萌发的影响[J].湖北农业科学,2012,51(22):5 099-5 104. LU Yu-jian,GAO Chun-ming,ZHENG Xiang-feng,et al.(2012).Effects of salt stress oil germination of Arabidopsis thaliana seeds[J].Hubei Agricultural Sciences,51(22):5,099-5,104.(in Chinese)
[11]王剑,王勇,刘东阳,等.低温和长期储藏对烟草种子萌发及幼苗生长的影响[J].上海农业学报,2014,30(4):85-88. WANG Jian,WANG Yong,LIU Dong-yang,et al.(2014). Effects of low temperature and long-term storage on seed germination and seedling growth of tobacco[J].Acta Agriculturae Shanghai,30(4):85-88.(in Chinese)
[12]栾博宇,王志锋,刘卓,等.不同处理方式对公农1号紫花苜蓿品种再生的影响[J].草叶与畜牧,2012,(3):14-17. LUAN Bo-yu,WANG Zhi-feng,LIU Zhuo,et al.(2012). The influence of regenerate by different treatment for Medicago sativa L.CV."Gongnong No.1"[J].Prataculture&Animal Husbandry,(3):14-17.(in Chinese)
[13]王春梅,张茜,张怀山,等.苜蓿组织培养中一种安全快捷的种子灭菌法[J].中国草食动物科学,2014,34(5):38-39. WANG Chun-mei,ZHANG Qian,ZHANG Huai-shan.(2014).A safe and fast sterilization for alfalfa seed in tissue culture[J].China Herbivores,34(5):38-39.(in Chinese)
[14]黄作喜,周钰,周玲玲,等.黄瓜无菌苗的培养技术[J].内江师范学院学报,2006,21(6):61-62. HUANG Zuo-xi,ZHOU Yu,ZHOU Ling-ling,et al.(2006).The culture technology for steriled seedlings of Cucumis sativus L.[J].Journal of Neijiang Normal University,21(6):61-62.(in Chinese)
[15]刘占彬,袁庆华.多花黑麦草种子外植体组织培养灭菌方法研究[J].草地学报,2009,17(4):474-479. LIU Zhan-bin,YUAN Qing-hua.(2009).Study oil the sterilization methods in tissue culture of Italian Ryegrass seed explant[J].Acta Agrestia Sinica,17(4):474-479.(in Chinese)
[16]刘峄,杨静慧,左凤月,等.低温层积和预处理对白刺种子萌发的影响[J].北方园艺,2013,(11):69-71. LIU Yi,YANG Jing-hui,ZUO Feng-yue,et al.(2013). Effect of low temperature layer deposition and pretreatment on seed germination of Nitraria L.[J].Northern Horticulture,(11):69-71.(in Chinese)
[17]Chen,G.Q.,Ren,L.,Zhang,J.,Reed,B.M.,Zhang,D.,&Shen,X.H.(2015).Cryopreservation affects ros-induced oxidative stress and antioxidant response in arabidopsis,seedlings.Cryobiology,70(1):38-47.
[18]泮玉竹.不同钼水平对拟南芥生理特性的影响[J].现代农业科技,2007,(15):13-14. PAN Yu-zu.(2007).Effects of different molybdenum levels on physiological property with Arabidopsis thaliana[J].Modern Agricultural Science and Technology,(15):13-14.(in Chinese)
[19]文国琴,刘志斌,李旭锋,等.AtVDAC2参与拟南芥盐胁迫信号应答过程[J].四川大学学报,2012,49(4):931-937. WEN Guo-qin,LIU Zhi-bin,LI Xu-feng,et al.(2012). AtVDAC2 participates in Arabidopsis thaliana NaCl stress response[J].Journal of Sichuan University,49(4):931-937.(in Chinese)
[20]陈长田.拟南芥PGABH介导了种子萌发和萌发后生长对ABA的敏感性[D].泰安:山东农业大学硕士论文,2012. CHEN Chang-tian.(2012).A novel protein PGABH mediates seed germination and post germination growth arrest by abscisic acid[D].Master Dissertation.Shandong Agricultural University,Taian.(in Chinese)
[21]梁文旭,靳志丽,陈和春,等.引发激活对烟草种子发芽特性和幼苗抗冷性的效应研究[J].河南农业科学,2012,41(8):62-65. LIANG Wen-xu,JIN Zhi-li,CHEN He-chun,et al.(2012).Research on effect of seed priming treatment on tobacco seed germination and seedling cold resistant capability[J].Journal of Henan Agricultural Sciences,41(8):62-65.(in Chinese)
[22]朱艳蕾,安登第,曾献春.银沙槐种子表而消毒技术及无菌萌发条件研究[J].新疆师范大学学报,2014,33(3):17-20. ZHU Yan-lei,AN Deng-di,ZENG Xian-chun.(2014). Study on seed surface sterilization technology and aseptic germination conditions of Ammodendron Argenteum(Pall)Kuntze[J]. Journal of Xinjiang Normal University,33(3):17-20.(in Chinese)
[23]刘晓风,谭敦炎.荒漠植物种子粘液的生态学意义[J].植物学通报,2007,24(3):414-424. LIU Xiao-feng,TAN Dun-yan.(2007).Ecological significance of seed mucilage in desert plants[J].Chinese Bulletin of Botany,24(3):414-424.(in Chinese)
[24]Haughn,G.,&Chaudhury,A.(2005).Genetic analysis of seed coat development in arabidopsis.Trends in Plant Science,10(10):472-477.
[25]张志元,官春云.油菜无菌苗培养前的种子消毒技术[J].中国油料作物学报,2005,27(1):88-91. ZHANG Zhi-yuan,GUAN Chun-yun.(2005).Method for the seeds sterilization before oil seed rape aseptic seedling culture[J].Chinese Journal of Oil Crop Sciences,27(1):88-91.(in Chinese)
[26]胡远,赵德刚.小油桐籽提取液对作物种子萌发及幼苗生长的影响[J].亚热带植物科学,2007,36(4):24-26. HU Yuan,ZHAO De-gang.(2007).Effects of extract solution from the seed of Jatropha curcas on seed germination and seedling growth of crops[J].Subtropical Plant Science,36(4):24-26.(in Chinese)
Effects of Different Rinse Treatments after Seed Sterilization on Germination and Seedling Growth in Nicotiana tabacum and Arabidopsis thaliana
ZHANG Jing-hua1,MA Ya-li2,3,LAN Hai-yan1
(1.Xinjiang Key Laboratory of Biological Resources and Genetic Engineering,College of Life Science and Technology,Xinjiang University,Urumqi 830046,China;2.College of Resource and Environment,Xinjiang University,Urumqi 830046,China;3.Xinjiang Education Institute,Urumqi 830043,China)
【Objective】To obtain abundant and healthy sterile seedlings efficiently is the basis for next step experiment in plant genetic transformation and methods of sterilization of seeds are of great significance to the seed germination and subsequent seedling growth and the oncoming experimental study.【Method】Effects of different post-treatment of seed sterilization on germination and seedling growth of Nicotiana tabacum and Arabidopsis thaliana were compared by rinsing seeds alternatively with sterilized water and absolute ethanol after NaClO sterilization,which was expected to reveal the best way of seed sterilization for N.tabacum seed without mucilage and A.thaliana seed with mucilage.【Result】Results showed that rinse of seeds with absolute ethanol had significantly negative effect on seed germination and seedling growth of N.tabacum and the germination percentage,root length and plant height were significantly decreased;whereas rinse of seeds of A.thaliana with absolute ethanol for a short time could promote seed germination,seedling growth,however,long time treatment with absolute ethanol exerted negative effect except for the main root elongation.Among various treatments,rinse of seeds with sterilized water and after 10%sodium hypochlorite for 4 minutes was the best to N.tabacum seeds;rinse of seeds with absolute ethanol for 2 times plus sterilized water for 3 times after 10%sodium hypochlorite for 4 minutes was the best to A.thaliana.【Conclusion】Although both seeds of N.tabacum and A.thaliana are small,there is significant difference between the two in post-treatment of sterilization method,which is meaningful for plant genetic transformation and phenotype analysis of the transgenic lines.
Nicotiana tabacum;Arabidopsis thaliana;sterilization;seed germination;seedling growth
S47
A
1001-4330(2016)09-1683-09
10.6048/j.issn.1001-4330.2016.09.016
2016-04-22
国家自然科学基金项目(31460043);自治区优秀青年科技人才培养项目(2013721013)
张晶华(1991-),女,河南人,硕士研究生,研究方向为植物抗逆分子生物学,(E-mail)zhangjinghua187@126.com
(Cotresponding author):兰海燕(1969-),女,新疆人,教授,博士,博士生导师,研究方向为植物抗逆分子生物学,(E-mail)lanhaiyan@xju.edu.cn
Fund project:NSFC(31460043)and outstanding youth science and technology personnel training project of Xinjiang Uygur Autonomous Region(2013721013).

