1株Pseudomonasfrederiksbergensis JW-SD2的解磷特性及解磷条件研究
曾庆伟, 温心怡, 吴小芹
(南京林业大学南方现代林业协同创新中心 南京林业大学 林学院,江苏 南京 210037)
1株PseudomonasfrederiksbergensisJW-SD2的解磷特性及解磷条件研究
曾庆伟, 温心怡, 吴小芹*
(南京林业大学南方现代林业协同创新中心 南京林业大学 林学院,江苏 南京 210037)
为探讨解磷细菌PseudomonasfrederiksbergensisJW-SD2的解磷特性及条件,检测了该菌株对不同矿质磷酸盐的溶解能力,并研究了不同碳源、氮源、温度、pH、装液量及盐离子等营养、环境因素对其解磷能力的影响。结果表明,该菌株对Ca3(PO4)2的溶解能力强于FePO4和AlPO4,解磷量达7.43 mmol/L。以葡萄糖作为碳源,硫酸铵作为氮源该菌株具有最大的解磷能力。同时还发现,该菌株能够在温度20~35 ℃,pH 4~9,装液量1/5~4/5,NaCl浓度0~3.0%保持3.0 mmol/L以上的解磷量,具有较强的环境适应能力。
解磷细菌;Pseudomonasfrederiksbergensis;环境因素
磷是植物生长发育所必须的矿质元素之一,是原生质的重要组份,也是植物体内核酸、酶类、ATP的组成成分。然而,磷元素在土壤中往往以不溶性无机磷或有机磷形式存在,即使在磷资源丰富的土壤中,可供植物吸收利用的有效磷含量不足0.1%[1]。土壤缺磷已经成为全球范围的农林业难题,严重影响了农林作物的生长[2]。现代农业通过施用可溶性磷酸盐肥料增加土壤中有效磷含量,而这些可溶性磷往往在被植物利用之前,就和土壤中的Al、Fe和Ca等金属离子螯合成不溶性磷酸盐,磷肥利用效率低[3]。过度重复的磷肥使用破坏了土壤微生物群落多样性,从而进一步造成了土壤肥力的下降[4]。研究发现,解磷细菌能够将土壤中的不溶性磷源溶解成为可溶性磷,并显著促进植物生长[5-7]。解磷细菌能够增加土壤有效磷含量,改善作物磷素营养,同时具有高效、环保等特点,因而解磷细菌的研究受到人们的重视。土壤不溶性无机磷是土壤磷源的重要组成成分,其中磷酸钙、磷酸铝、磷酸铁等沉淀型磷酸盐为主要的矿质磷酸盐[8]。解磷细菌能够溶解这一类矿质磷酸盐,然而解磷细菌对磷酸钙、磷酸铝、磷酸铁溶解能力存在差异[9-11]。研究还发现,解磷细菌的解磷能力受到营养、温度、酸碱度、溶氧及盐离子浓度等环境因素的显著影响,从而影响解磷细菌的植物促生能力[12-13]。因此,弄清楚解磷细菌对不同磷源的溶解能力,以及营养、环境条件对其解磷能力的影响,是对解磷细菌进一步深入研究和应用的基础。本实验室前期从杨树根际分离了1株解磷细菌PseudomonasfrederiksbergensisJW-SD2,初步研究表明该菌株具有良好解磷能力[14]。然而,该菌株对不同种类不溶性磷源的溶解能力,以及外界条件对其解磷能力的影响还不清楚。为此,本文以解磷菌株P.frederiksbergensisJW-SD2为研究对象,检测了该菌株对不同矿质磷酸盐的溶解能力,并研究了营养及环境条件对该菌株解磷能力的影响,以期为该菌株在生产实践中作为生物菌肥应用时适地施菌,发挥最佳解磷效力提供指导。
1 材料与方法
1.1 材料
1.1.1 菌株 解磷细菌PseudomonasfrederiksbergensisJW-SD2由南京林业大学森林保护研究所分离自山东沂水杨树根际土壤(棕壤土)[14]。目前该菌株已保藏于中国典型培养物保藏中心(CCTCC),保藏号:CCTCC M 2015350。
1.1.2 培养基 ①种子培养基:Luria Bertani(LB)培养基(胰蛋白胨10.0 g,酵母粉5.0 g,NaCl 5.0 g,蒸馏水1 000 mL, pH 7.0,固体培养基添加15 g/L的琼脂);②国际植物研究所磷酸盐生长培养基(NBRIP):葡萄糖10 g,Ca3(PO4)25 g,MgCl25 g,KCl 0.2 g,MgSO4·7H2O 0.25 g,(NH4)2SO40.1 g,蒸馏水1 000 mL,pH 7.0,固体培养基添加15 g/L的琼脂。
1.1.3 试剂 Ca3(PO4)2、FePO4、AlPO4均为分析纯,购于阿拉丁试剂(上海)有限公司;葡萄糖、果糖、可溶性淀粉、蔗糖、麦芽糖、硫酸铵、硝酸钾、NaOH、HCl、NaCl均为国产分析纯试剂;蛋白胨、酵母粉、牛肉膏均为国产生化试剂。
1.1.4 仪器 HVA-110高压灭菌锅,日本Hirayama;SW-CJ-1FD净化工作台,苏州净化工作台设备有限公司; HYG-Ⅱa迴转式恒温调速摇瓶柜,上海欣蕊自动化设备有限公司;5804R离心机,德国艾本德;PB-10标准型pH计,德国赛多利斯;Helios分光光度计,美国赛默飞。
1.2 方法
1.2.1 JW-SD2菌株对不同磷源的溶解能力 将-80 ℃保存的JW-SD2菌株活化2次后,接种于LB培养基,30 ℃、180 r/min培养20 h,菌体浓度为108cfu/mL。取1 mL菌液,7 000 r/min离心5 min收集菌体,无菌生理盐水洗涤3次,将菌体重新悬浮于1 mL灭菌生理盐水中,作为种子液。按照1%的接种比例,将种子液分别接入以Ca3(PO4)2、FePO4、AlPO4作为唯一不溶性磷源的NBRIP培养基。每种磷源处理均设立3组重复,以不接菌处理作为空白对照。30 ℃震荡培养72 h,采用比浊法测定菌体生物量,收集并测定发酵液pH及可溶性磷含量。
1.2.2 碳、氮源对JW-SD2菌株解磷的影响 保持NBRIP培养基其他成分不变,按10 g/L的加入比例,分别以葡萄糖、果糖、可溶性淀粉、蔗糖、麦芽糖作为唯一碳源;保持NBRIP培养基其他成分不变,按0.1 g/L的加入比例,分别以硫酸铵、硝酸钾、蛋白胨、酵母粉、牛肉膏作为唯一氮源。以1%接种量向装有50 mL培养基的100 mL三角瓶中接入JW-SD2种子液。每种碳源、氮源处理均设立3组重复,以不接菌处理作为空白对照。30 ℃震荡培养72 h,测定发酵液中可溶性磷含量。
1.2.3 温度对JW-SD2菌株解磷的影响 按1%接种量向装有50 mL NBRIP培养基的100 mL三角瓶中接入JW-SD2种子液,分别置于20、25、30、35、40 ℃五个不同温度下进行震荡培养。每种温度处理均设立3组重复,以不接菌处理作为空白对照。72 h后测定发酵液中可溶性磷含量。
1.2.4 初始pH对JW-SD2菌株解磷的影响 利用1 mmol/L HCl或NaOH溶液分别调节培养基pH至4、5、6、7、8、9和10,培养基其他成分保持不变。以1%接种量向装有50 mL培养基的100 mL三角瓶中接入JW-SD2种子液。每种温度处理均设立3组重复,以不接菌处理作为空白对照。30 ℃震荡培养72 h,测定发酵液中可溶性磷含量。
1.2.5 装液量对JW-SD2菌株解磷的影响 在100 mL三角瓶中分别装入20、40、50、60和80 mL NBRIP培养基,使得装液量与三角瓶体积比分别为1/5、2/5、1/2、3/5和4/5。按1%接种量分别接入JW-SD2种子液进行震荡培养。每种装液量处理均设立3组重复,以不接菌处理作为空白对照。30 ℃震荡培养,72 h后测定发酵液中可溶性磷含量。
1.2.6 NaCl浓度对JW-SD2菌株解磷的影响 向NBRIP培养基中分别按质量百分比浓度0%、1.0%、2.0%、3.0%、4.0%、5.0%、6.0%、7.0%和8.0%加入NaCl,保持培养基其他成分不变。以1%接种量向装有50 mL培养基的100 mL三角瓶中接入JW-SD2种子液。每种NaCl浓度处理均设立3组重复,以不接菌处理作为空白对照。30 ℃震荡培养72 h,测定发酵液中可溶性磷含量,研究盐离子浓度对菌株解磷能力的影响。
1.2.7 可溶性磷含量的测定 将发酵液4 ℃、10 000 r/min离心10 min,收集上清。上清通过MILLEX-GP 0.22 μm孔径滤膜(Millipore Express, 美国)过滤,收集滤液。采用钼锑抗比色法[13]测定滤液中可溶性磷含量。
2 结果与分析
2.1 解磷细菌JW-SD2对不同磷源的溶解能力
解磷菌株P.frederiksbergensisJW-SD2对Ca3(PO4)2、FePO4、AlPO4三种矿质磷酸盐的溶解能力如图1所示(空白对照组中可溶性磷含量均低于0.10 mmol/L,图中可溶性磷含量为菌株净解磷量)。该菌株对Ca3(PO4)2具有高效的溶解能力,显著(P<0.01)高于其他磷源,溶磷量高达7.43 mmol/L。该菌株对FePO4、AlPO4的溶解作用表现较弱,解磷量分别为0.53 mmol/L和0.78 mmol/L。然而,在不同磷源的溶解过程中,培养基pH都出现了下降,分别从初始pH 7.0下降至4.92、5.13和5.21,且不存在显著差异(P<0.05)。菌体生长结果显示,在FePO4溶磷培养基中,该菌株菌体浓度显著(P<0.05)低于Ca3(PO4)2,而其他两种磷源处理间无显著差异(P<0.05)。

图1 解磷菌株P. frederiksbergensis JW-SD2对不同磷源的溶解能力Fig.1 Solubilization of different mineral phosphates by P. frederiksbergensis JW-SD2
2.2 碳源对JW-SD2菌株解磷能力的影响
解磷菌株P.frederiksbergensisJW-SD2在不同碳源条件下,其解磷能力存在显著差异。从图2可以看出,解磷菌株JW-SD2对单糖、双糖以及多糖碳源都能够利用,并发挥解磷效力。当以葡萄糖、蔗糖为唯一碳源时,该菌株具有较高的解磷能力,极显著(P<0.01)高于其他碳源,解磷量分别为7.70和3.50 mmol/L。当以可溶性淀粉、麦芽糖、果糖为唯一碳源时,该菌株解磷量依次为0.73、0.69和0.12 mmol/L。结果表明,葡萄糖更加有利于解磷菌株JW-SD2对不溶性磷酸盐的溶解。

图2 碳源对P. frederiksbergensis JW-SD2菌株解磷能力的影响Fig.2 Effect of carbon sources on phosphate-solubilizing activity of P. frederiksbergensis JW-SD22
2.3 氮源对JW-SD2菌株解磷能力的影响
不同氮源对解磷菌株P.frederiksbergensisJW-SD2的解磷能力存在显著影响(图3)。JW-SD2菌株在无机氮源和有机氮源条件下均能够溶解不溶性矿质磷酸盐。以硫酸铵为唯一氮源时,该菌株具有最大的解磷量,7.89 mmol/L,极显著高(P<0.01)于其他氮源。在以蛋白胨、酵母粉、牛肉膏和硝酸钾为唯一氮源时,该菌株解磷量依次为4.04、3.98、3.66、2.10 mmol/L。由结果可以看出,硫酸铵所提供的氮源更有利于解磷菌株JW-SD2解磷能力的发挥。

图3 氮源对P. frederiksbergensis JW-SD2菌株解磷能力的影响Fig.3 Effect of nitrogen sources on phosphate-solubilizing activity of P. frederiksbergensis JW-SD2
2.4 温度对JW-SD2菌株解磷能力的影响
随着培养温度的上升,解磷菌株P.frederiksbergensisJW-SD2的解磷能力呈现先上升后下降的趋势(图4)。在20~35 ℃的温度变化范围内该菌株表现出了较高的解磷能力,当培养温度为30 ℃时,解磷菌株JW-SD2解磷能力极显著(P<0.01)高于其他温度处理,解磷量达7.79 mmol/L。当培养温度为20、25和35 ℃时,该菌株解磷量依次为5.30、6.74和6.95 mmol/L。当培养温度为40 ℃,则检测不到该菌株的解磷活性。从结果可以看出,解磷菌株能够适应较大幅度的温度变化,并发挥解磷效力。

图4 温度对P. frederiksbergensis JW-SD2菌株解磷能力的影响Fig.4 Effect of temperature on phosphate-solubilizing activity of P. frederiksbergensis JW-SD2
2.5 初始pH对JW-SD2菌株解磷能力的影响
pH是微生物生长的一项重要环境指标,对微生物的离子运输等活动有着明显的影响。从图5可以看出,随着初始pH的上升,解磷菌株P.frederiksbergensisJW-SD2的解磷能力表现出先下降后上升,后又下降的趋势,该菌株的解磷能力受到pH的显著影响。当初始pH值为7时,该菌株具有最大的解磷能力,解磷量达7.20 mmol/L,显著(P<0.01)高于其他处理。当初始pH值为4、5、6、8、9、10时,JW-SD2解磷量依次为6.51、5.06、6.32、6.10、5.56、0.28 mmol/L。以上结果表明,解磷菌株JW-SD2具有较强的酸碱度耐受性,能够在大幅度变化的pH环境中发挥解磷作用。

图5 初始pH对P. frederiksbergensis JW-SD2菌株解磷能力的影响Fig.5 Effect of initial-pH on phosphate-solubilizing activity of P. frederiksbergensis JW-SD2
2.6 装液量对JW-SD2菌株解磷能力的影响
解磷菌株P.frederiksbergensisJW-SD2在不同装液量条件下的解磷能力如图6所示。该菌株在装液量为1/5时具有最高的不溶性矿质磷酸盐溶解量,7.41 mmol/L,显著(P<0.01)高于其他装液量处理。在装液量分别为2/5、1/2、3/5、4/5时,该菌株仍具有较好解磷能力,解磷量分别为4.20、4.99、4.10、3.16 mmol/L。整体来看,随着装液量的增加该菌株的解磷能力出现下降的趋势,说明低装液量更有利于解磷菌株JW-SD2解磷能力的发挥。

图6 装液量对P. frederiksbergensis JW-SD2菌株解磷能力的影响Fig.6 Effect of culture volume on phosphate-solubilizing activity of P. frederiksbergensis JW-SD2
2.7 NaCl浓度对JW-SD2菌株解磷能力的影响
盐离子作为重要的环境因子,影响着微生物的生存及生物功能的发挥。通过设置NaCl浓度梯度研究了盐离子对解磷菌株P.frederiksbergensisJW-SD2解磷能力影响,结果如图7所示。随着NaCl浓度的增加,该菌株的解磷能力出现了先上升后下降的变化趋势。该菌株在NaCl浓度1.0%时具有最大的解磷量,7.25 mmol/L。在NaCl浓度为0~3.0%之间时,该菌株的解磷能力 保持在5.02 mmol/L以上。从上述结果可以看出,解磷菌株JW-SD2具有较好的NaCl耐受力,这对其在高盐土壤中发挥解磷作用具有重要意义。
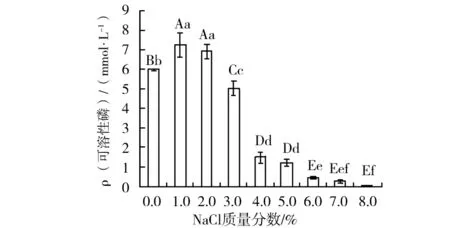
图7 NaCl浓度对P. frederiksbergensis JW-SD2菌株解磷能力的影响Fig.7 Effect of concentrations of NaCl on phosphate-solubilizing activity of P. frederiksbergensis JW-SD22
3 讨 论
由于土壤环境因素的差异,土壤中解磷微生物解磷特性存在很大的差异[16]。解磷菌株P.frederiksbergensisJW-SD2分离自山东沂水[14],而中国北方碱性土壤中多以Ca3(PO4)2为最主要的不可溶性磷源[17],长期的自然选择和环境适应,可能是解磷菌株JW-SD2对Ca3(PO4)2具有较强溶解能力(7.43 mmol/L)的主要原因。相比于其他解磷菌株,如P.fluorescens(5.64 mmol/L)、P.trivialis(5.91 mmol/L)[18]、Enterobacteraerogenes(4.62 mmol/L)、Burkholderiacaledonica(4.49 mmol/L)[19],解磷菌株JW-SD2对Ca3(PO4)2具有较强的溶解能力。
碳水化合物是所有异养微生物的能源物质,供给不同形态的碳水化合物,不仅影响到微生物的生长繁殖,而且还影响其生理代谢活动。Farhat等[20]研究发现,不同的碳源种类导致解磷细菌有机酸代谢发生变化,产生不同种类的有机酸,从而直接影响到解磷细菌的解磷特性,在一定范围内解磷细菌的解磷能力会随着葡萄糖浓度的升高而增强。解磷真菌Aspergillusaculeatus能利用11种不同的碳源,但以阿拉伯糖为碳源时解磷效率最高,其次为葡萄糖,而当蔗糖作为碳源解磷活性相对较低[21]。本研究发现以葡萄糖作为碳源解磷菌株JW-SD2具有最高的解磷能力。研究认为,解磷微生物主要通过分泌有机酸来溶解不溶性矿质磷酸盐,而这些有机酸来自于葡萄糖直接氧化代谢途径[22-24]。解磷菌株JW-SD2能够更好地吸收利用葡萄糖并进入氧化代谢途径,从而展现出更强的解磷活性。

除营养条件外,外部的环境条件也是影响解磷细菌解磷功能的重要因素。Illmer等[26]在对解磷细菌Pseudomonassp.培养条件研究中发现,除营养元素之外,温度、溶氧量也对解磷细菌的解磷能力有着较大影响。复合菌剂解磷作用的发挥也受到温度、pH等因素的显著影响[27]。本研究发现解磷菌株JW-SD2能够在较广的温度、pH、装液量及盐离子浓度变化范围内发挥较好的解磷作用。在转速固定的情况下,摇瓶的装液量决定了发酵液中溶氧浓度[28]。温度、酸碱度、溶氧、盐度都是重要的土壤理化指标。中国土壤环境复杂,具有较大的温度、酸碱度、氧气浓度,盐碱度变化[29-31]。解磷菌株JW-SD2能够在较为复杂的环境条件下发挥解磷能力,这也为其在土壤中发挥解磷效力,改善土壤肥力奠定了一定的优势。
本文对解磷细菌P.frederiksbergensisJW-SD2对不同磷源的溶解能力,以及营养环境条件对其解磷能力的影响进行了探究,为该菌株后期的菌剂开发奠定基础,也为该菌株在生产实践中,施用于更合适的农林业土壤,发挥更好的解磷效力提供参考。高效的解磷活性使得解磷菌株JW-SD2具有植物促生潜力,关于该菌株的植物促生能力还有待进一步研究。
[1] Stevenson F J, Cole M A. Cycles of soils: carbon, nitrogen, phosphorus, sulfur, micronutrients[M]. United States: John Wiley & Sons, 1999.
[2] Hinsinger P. Bioavailability of soil inorganic P in the rhizosphere as affected by root-induced chemical changes: a review[J]. Plant and soil, 2001, 237(2): 173-195.
[3] Goldstein A, Liu S. Molecular cloning and regulation of a mineral phosphate solubilizing gene fromErwiniaherbicola[J]. Nature biotechnology, 1987, 5(1): 72-74.
[4] Khan M S, Zaidi A, Wani P A. Role of phosphate-solubilizing microorganisms in sustainable agriculture-a review[J]. Agronomy for sustainable development, 2007, 27(1): 29-43.
[5] 金术超, 杜春梅, 平文祥, 等. 解磷微生物的研究进展[J]. 微生物学杂志, 2006, 26(2): 73-78.
[6] Selvakumar G, Mohan M, Kundu S, et al. Cold tolerance and plant growth promotion potential of Serratia marcescens strain SRM (MTCC 8708) isolated from flowers of summer squash (Cucurbita pepo)[J]. Letters in applied microbiology, 2008, 46(2): 171-175.
[7] Ahemad M, Khan M S. Effect of fungicides on plant growth promoting activities of phosphate solubilizingPseudomonasputidaisolated from mustard (Brassicacompestris) rhizosphere[J]. Chemosphere, 2012, 86(9): 945-950.
[8] 熊毅, 李庆逵. 中国土壤(第2版)[M]. 北京: 科学出版社, 1987.
[9] Park K H, Lee O M, Jung H I, et al. Rapid solubilization of insoluble phosphate by a novel environmental stress-tolerantBurkholderiavietnamiensisM6 isolated from ginseng rhizospheric soil[J]. Applied microbiology and biotechnology, 2010, 86(3): 947-955.
[10]钟传青, 黄为一. 不同种类解磷微生物的溶磷效果及其磷酸酶活性的变化[J]. 土壤学报, 2005, 42(2): 286-294.
[11]赵小蓉, 林启美, 李保国. 微生物溶解磷矿粉能力与pH及分泌有机酸的关系[J]. 微生物学杂志, 2003, 23(3): 5-7.
[12]Vassileva M, Serrano M, Bravo V, et al. Multifunctional properties of phosphate-solubilizing microorganisms grown on agro-industrial wastes in fermentation and soil conditions[J]. Applied microbiology and biotechnology, 2010, 85(5): 1287-1299.
[13]Scervino J M, Papinutti V L, Godoy M S, et al. Medium pH, carbon and nitrogen concentrations modulate the phosphate solubilization efficiency ofPenicilliumpurpurogenumthrough organic acid production[J]. Journal of applied microbiology, 2011, 110(5): 1215-1223.
[14]Liu H, Wu X Q, Ren J H, et al. Isolation and identification of phosphobacteria in poplar rhizosphere from different regions of China[J]. Pedosphere, 2011, 21(1): 90-97.
[15]鲁如坤. 土壤农业化学分析方法[M]. 北京: 中国农业科技出版社, 2000.
[16]向文良, 冯玮, 郭建华, 等. 一株解磷中度嗜盐菌的分离鉴定及解磷特性分析[J]. 微生物学通报, 2009, 36(3): 320-327.
[17]沈仁芳, 蒋柏藩. 石灰性土壤无机磷的形态分布及其有效性[J]. 土壤学报, 1992, 29(1): 80-86.
[18]Gulati A, Rahi P, Vyas P. Characterization of phosphate-solubilizingfluorescentpseudomonadsfrom the rhizosphere of seabuckthorn growing in the cold deserts of Himalayas[J]. Current microbiology, 2008, 56(1): 73-79.
[19]AerogenesCollavino M M, Sansberro P A, Mroginski L A, et al. Comparison of in vitro solubilization activity of diverse phosphate-solubilizing bacteria native to acid soil and their ability to promotePhaseolusvulgarisgrowth[J]. Biology and fertility of soils, 2010, 46(7): 727-738.
[20]Farhat M B, Farhat A, Bejar W, et al. Characterization of the mineral phosphate solubilizing activity ofSerratiamarcescensCTM 50650 isolated from the phosphate mine of Gafsa[J]. Archives of microbiology, 2009, 191(11): 815-824.
[21]Narsian V, Patel H.Aspergillusaculeatusas a rock phosphate solubilizer[J]. Soil biology and biochemistry, 2000, 32(4): 559-565.
[22]Duff R, Webley D. 2-Ketogluconic acid as a natural chelator produced by soil bacteria[J]. Chemistry and industry, 1959:1376-1377.
[23]Katznelson H, Bose B. Metabolic activity and phosphate-dissolving capability of bacterial isolates from wheat roots, rhizosphere, and non-rhizosphere soil[J]. Canadian journal of microbiology, 1959, 5(1): 79-85.
[24]Oubrie A, Rozeboom H J, Kalk K H, et al. Structure and mechanism of soluble quinoprotein glucose dehydrogenase[J]. The EMBO journal, 1999, 18(19): 5187-5194.
[25]Wenzel C, Ashford A, Summerell B. Phosphate-solubilizing bacteria associated with proteoid roots of seedlings of waratah (Telopeaspeciosissima(Sm.) R. Br)[J]. New phytologist, 1994, 128(3): 487-496.
[26]Illmer P, Schinner F. Solubilization of inorganic phosphates by microorganisms isolated from forest soils[J]. Soil biology and biochemistry, 1992, 24(4): 389-395.
[27]侯佳奇, 李鸣晓, 贾璇, 等. 复合菌剂解无机磷条件优化研究[J]. 农业环境科学学报, 2013, 32(2): 385-392.
[28]刘森, 杨涛, 崔薇薇. 尖孢镰刀菌发酵生产木糖醇的工艺研究[J]. 现代食品科技, 2008, 24(4): 247-248.
[29]于东升, 王洪杰, 赵永存, 等. 中国土壤温度的季节性变化及其区域分异研究[J]. 土壤学报, 2009, 46(2): 227-234.
[30]Yu H, Huang J-K, Rozelle S, et al. Soil fertility changes of cultivated land in Eastern China[J]. Geographical research, 2003, 22(3): 380-388.
[31]张建锋, 乔勇进. 盐碱地改良利用研究进展[J]. 山东林业科技, 1997, 3: 5-8.
Phosphate Solubilizing Traits and Conditions of a Pseudomonas frederiksbergensis Strain JW-SD2
ZENG Qing-wei, WEN Xin-yi, WU Xiao-qin
(Collaborat.Innovat'nCtr.ofSustain.Forest.inS.China,Coll.ofForest.,NanjingForest.Uni.,Nanjing, 210037)
In order to investigate traits and conditions of phosphate solubilizing of phosphate solubilizing bacteriumPseudomonasfrederiksbergensisJW-SD2, the capability the strain to solubilize different kinds of mineral phosphate was detected, and the effects of carbon sources, nitrogen sources, temperature, pH, liquid filling volume, salt ions, and other nutrition, environment factors on phosphate solubilizing ability were studied. The results showed that the strain had greater ability to solubilize Ca3(PO4)2than FePO4or AlPO4and the released amount of phosphate ion was up to 7.43 mmol/L. The strain presented the highest phosphate solubilizing ability using glucose as carbon source and using ammonium sulfate as nitrogen source. The strain also showed great adaptive capacity to environment. The phosphate solubilizing amount remained over 3.0 mmol/L at temperature range from 20 ℃ to 35 ℃, pH range from 4 to 9, filling volume range from 1/5 to 4/5, NaCl concentration range from 0 to 3.0%.
phosphate-solubilizing bacterium;Pseudomonasfrederiksbergensis; environmental factors
国家林业公益性行业科研专项(201004061);江苏高校优势学科建设工程资助项目(PAPD);2012年度江苏省普通
曾庆伟 男,博士研究生。主要从事森林资源微生物、植物促生细菌研究。Tel:025-85427427,E-mail:zqw_333@aliyun.com
* 通讯作者。女,教授,博士生导师。主要从事森林资源微生物、植物病理学研究。Tel:025-85427427,E-mail:xqwu@njfu.edu.cn
2015-04-03;
2015-06-13
Q939.96
A
1005-7021(2016)01-0011-06
10.3969/j.issn.1005-7021.2016.01.003
高校研究生科研创新计划项目(CXLX12_0544)

