稻瘟病拮抗菌的筛选及抑菌活性的研究
黄元慧, 谢鲲鹏, 王 朔, 吕雪鑫, 谢明杰
(辽宁师范大学 生命科学学院 辽宁省生物技术与分子药物研发重点实验室,辽宁 大连 116081)
稻瘟病拮抗菌的筛选及抑菌活性的研究
黄元慧, 谢鲲鹏, 王 朔, 吕雪鑫, 谢明杰*
(辽宁师范大学 生命科学学院 辽宁省生物技术与分子药物研发重点实验室,辽宁 大连 116081)
利用对峙法和牛津杯法从大连近海海域分离得到1株对稻瘟病菌有拮抗作用的菌株BCHN-15,经生理生化实验和16S rDNA方法鉴定,该菌株为解淀粉芽胞杆菌。实验结果显示,BCHN-15能显著抑制稻瘟病菌的生长,与稻瘟病菌作用48 h后,稻瘟病菌的菌丝干重与对照组相比减少了74.36%。该菌产生的抑菌成分可破坏稻瘟病菌的细胞膜,且对热稳定,其活性成分能被盐酸沉淀。结果表明,BCHN-15可通过破坏稻瘟病菌的细胞膜,引起菌丝畸形和断裂来发挥其抑菌作用。
稻瘟病菌; 拮抗菌; 抑菌作用
稻瘟病是一种真菌性水稻病害,全球每年因稻瘟病造成的水稻产量损失达11%~30%,严重时甚至可导致绝产[1-2]。长期以来,主要采用化学方法防治水稻稻瘟病病害[3]。但由于长期大量地使用化学农药,会导致病原菌产生耐药性,并对人畜健康和环境造成损害和污染,因此生物防治方法成为目前防治稻瘟病的主要方向[4]。其中由于海洋微生物的多样性和差异性,可以产生比陆生微生物结构更新、活性更高、功能更具独特的抗菌活性物质[5],因此本研究室拟从海洋中分离获得对稻瘟病菌有拮抗作用的微生物,并对其抑制稻瘟病菌的作用机制进行研究,旨在今后为其开发成高效的生物农药提供理论依据。
1 材料与方法
1.1 材料
1.1.1 稻瘟病菌 由沈阳农业大学惠赠。
1.1.2 样品采集 从大连开发区泊石湾近海海域取深度为10~20 cm处的海水和海泥,置于无菌袋中,4 ℃冰箱保存备用。
1.1.3 培养基 牛肉膏蛋白胨固体培养基;PDA培养基。
1.2 方法
1.2.1 稻瘟病菌拮抗菌的分离、初筛和复筛 称取2 g样品,加入18 mL生理盐水,采用10倍梯度稀释法进行分离,将分离到的单菌落用斜面保存备用。稻瘟病拮抗菌的初筛采用琼脂块对峙法[6]:钻取6 mm稻瘟病菌菌丝块接种于PDA培养基平板中心,用接种环挑取上述分离到的各拮抗菌,在距平板中心2.5 cm处十字交叉接种,28 ℃恒温培养箱内培养7 d。将对稻瘟病菌有抑制作用的拮抗菌用牛津杯法进行复筛[7]:用5 mL无菌水洗下PDA斜面培养5 d的稻瘟病菌丝,混匀,取1 mL倒入冷却至约45 ℃的PDA培养基中,混匀倒平板。待平板凝固后,在中央放入牛津杯,杯中加入200 μL初筛菌株的培养液,28 ℃下培养72 h,测量抑菌圈直径并记录结果,以无菌水为空白对照,实验重复3次。
1.2.2 稻瘟病拮抗菌的鉴定 采用生理生化法和16S rDNA法对分离的拮抗菌菌株进行鉴定[8-9]。
1.2.3 拮抗菌对稻瘟病菌生长量的影响 将活化好的稻瘟病菌的孢子,用无菌水制成107cfu/mL 的孢子悬液。取1 mL加入到20 mL PDA液体培养基中,再加入200 μL拮抗菌发酵液,振荡培养48 h后12 000 r/min离心5 min,弃上清,无菌水冲洗3次后,将沉淀放入干燥箱干燥48 h后称重,并计算菌丝重量的变化率。以加同样体积的无菌水作为空白对照。各组实验重复3次,取平均值。稻瘟病菌菌丝重量变化率计算公式如下:
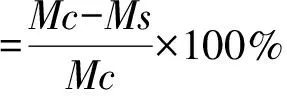
M:菌丝干重变化率/%,Mc:对照组菌丝重量/g,Ms:实验组菌丝重量/g。
1.2.4 拮抗菌对稻瘟病菌菌丝形态的影响 采用1.2.1的琼脂块对峙法进行测定。用接种针挑取有明显抑菌条带的边缘菌丝,制成装片,在显微镜下和扫描电镜下分别观察菌丝形态的变化,以对照边缘的菌丝为对照。
1.2.5 拮抗菌发酵液对稻瘟病菌细胞膜的影响[10]称取2 g培养至对数期的稻瘟病菌菌丝,用40 mL培养基悬浮,然后加入200 μL拮抗菌发酵液,于28 ℃、180 r/min的摇床中振荡培养,分别于0、2、4、6和8 h时取样,测定培养液中糖和蛋白质的含量。糖的测定采用蒽酮比色法,蛋白的测定采用考马斯亮蓝法,实验重复3次。以不加拮抗菌发酵液只加入等量培养基组为空白对照。
1.2.6 拮抗菌发酵液热稳定性测定 将拮抗菌发酵液分别置于60、80、100和120 ℃下处理20 min,按照1.2.3的方法进行抑菌实验,以未经处理的原发酵液为对照组,每组实验重复3次。
1.2.7 拮抗菌产生的抑菌活性物质分析[11]取25 mL拮抗菌发酵液,缓慢加入2 mol/L盐酸调pH值至2.0左右,4 ℃下静置过夜,于10 000 r/min离心30 min,分别测定上清液和沉淀部分(沉淀用少量无菌水溶解)对稻瘟病菌的抑菌作用,以不含拮抗菌的发酵液为对照组。
2 结果与分析
2.1 稻瘟病菌拮抗菌的筛选结果
本研究从大连开发区近海海域中,经平板稀释法分离共获得83株菌,经初筛和复筛,有4株细菌对稻瘟病菌有抑制作用,其中BCHN-15的抑菌活性最好,其抑菌圈直径达到41.4 mm(图1)。
2.2 BCHN-15菌株形态学和生理生化鉴定结果
BCHN-15菌落呈圆形,白色,表面有褶皱,边缘整齐,无光泽,湿润、不透明。显微镜下的个体形态为杆状,革兰染色阳性,能形成芽胞(图2)。生理生化鉴定结果与解淀粉芽胞杆菌的特征基本相同(表1),可初步鉴定BCHN-15菌株为解淀粉芽胞杆菌。
2.3 BCHN-15菌株16S rDNA鉴定结果
将BCHN-15菌株经PCR 扩增获得的产物进行序列测定,并提交到GenBank数据库,获得登录号KJ608175。通过Blast程序与GenBank核酸序列库中的序列进行比对,BCHN-15菌株的16SrDNA序列与解淀粉芽胞杆菌(登录号分别为HE774 679.1、FJ685 773.1、AB244 462.1、AB245 422.1、CP000 560.1)的同源性均为100%。用MEGA5.0软件构建系统发育树(图3),结果显示BCHN-15菌株与Bacillusamyloliquefaciens位于同一簇群,亲缘关系最近。根据BCHN-15菌株的形态特征、生理生化特征和16S rDNA序列的分析结果,BCHN-15被鉴定为解淀粉芽胞杆菌(Bacillusamyloliquefaciens)。
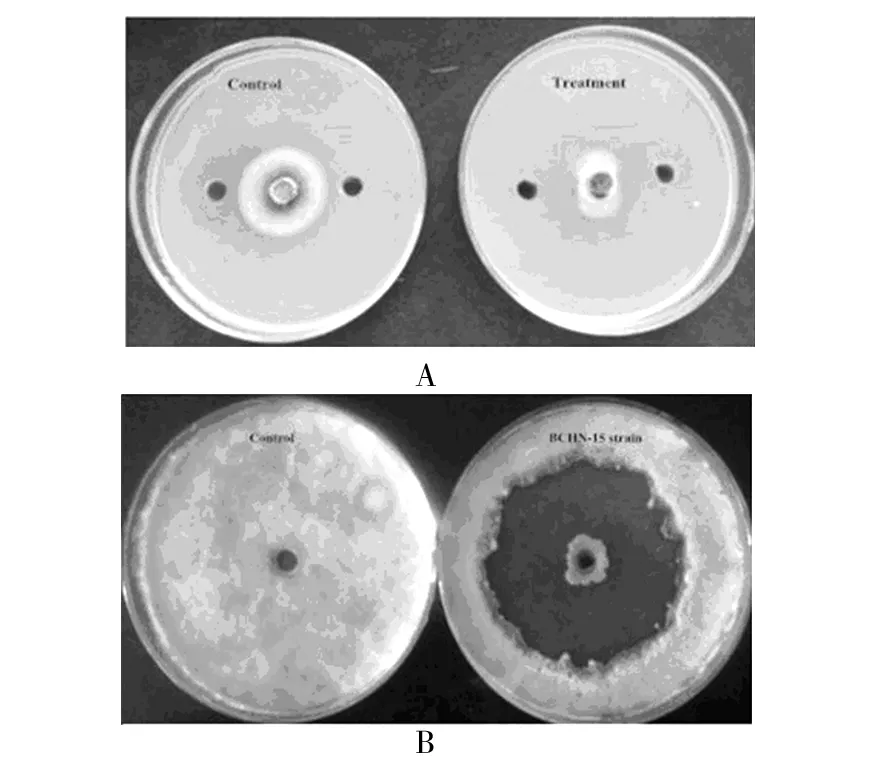
图1 BCHN-15对稻瘟病菌的抑制效果Fig.1 The inhibit effect of BCHN-15 against rice blast fungusA:琼脂块对峙法筛选稻瘟病拮抗菌;B:牛津杯法筛选稻瘟病拮抗菌A:The screening of antagonistic strain against rice blast by Flat-stand method;B:The screening of antagonistic strain against rice blast by Oxford plate method
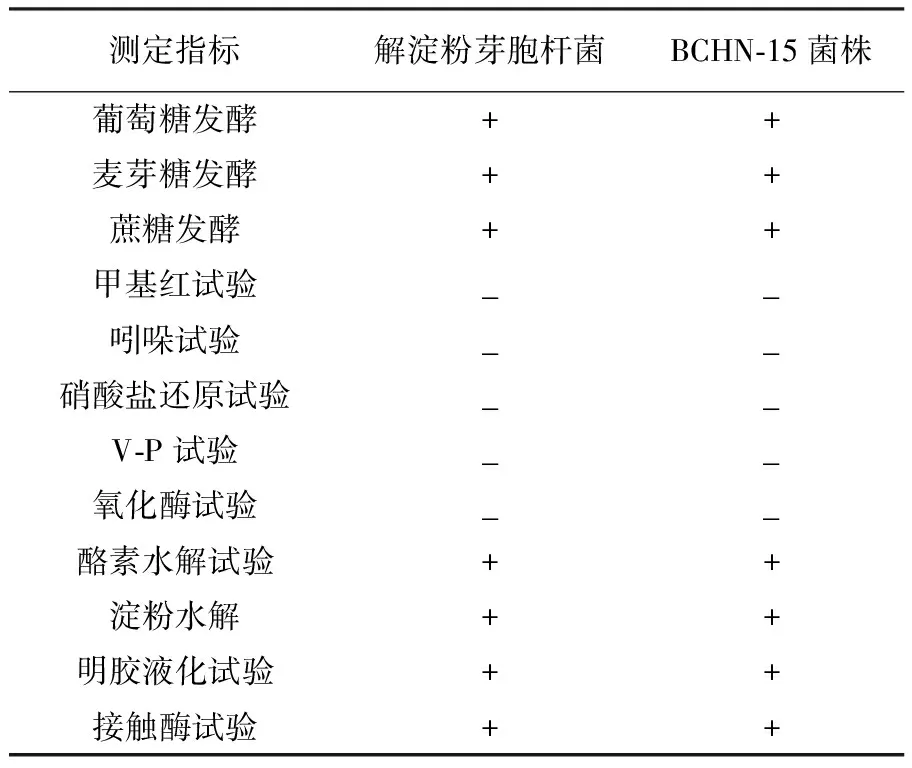
表1 BCHN-15菌株的生理生化特征
注:“+”:反应呈阳性;“-”: 反应呈阴性

图2 BCHN-15菌株的形态特征Fig.2 Morphological characteristics of BCHN-15 strainA: 菌落形态;B:芽胞染色;C:扫描电子显微镜A:Colony morphology; B:Spore staining;C:Scanning electron microscopy
2.4 BCHN-15发酵液对稻瘟病菌生长量的影响
BCHN-15菌株能显著抑制稻瘟病菌的生长,当该菌发酵液作用稻瘟病菌48 h后,与对照组相比,稻瘟病菌的菌丝干重减少了74.36%(P<0.01)。
2.5 BCHN-15发酵液对稻瘟病菌菌丝形态的影响
实验结果显示,BCHN-15菌株发酵液可明显影响稻瘟病菌的菌丝形态,与对照组相比,经BCHN-15菌株发酵液处理24 h后的稻瘟病菌,其菌丝顶端膨大,出现囊泡,菌丝扭曲,畸形和断裂等现象(图 4),该结果与电子扫描显微镜结果一致(图 5)。

图3 BCHN-15菌株的系统发育树Fig.3 Phylogenetic tree of BCHN-15 strain
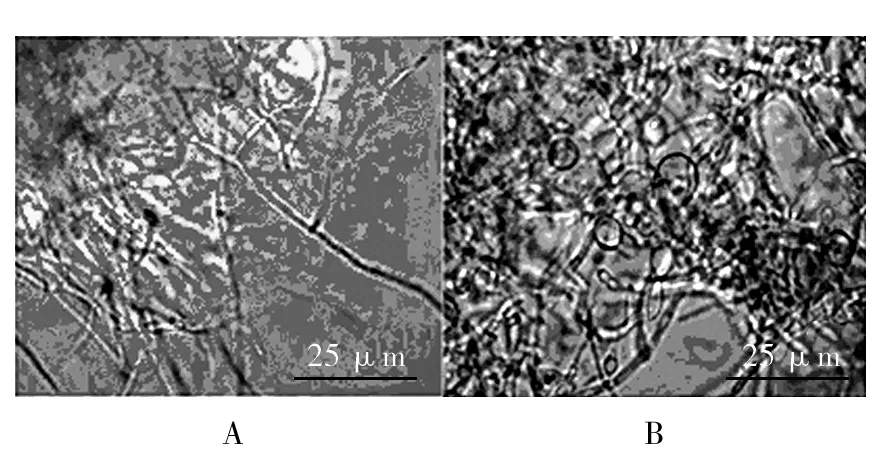
图4 稻瘟病菌菌丝的显微镜照片Fig.4 The microscope picture of rice blast fungus hyphaeA:对照组菌丝;B: BCHN-15作用48 h后的菌丝A:The control group of hyphae; B: Treat with BCHN-15 for 48 h
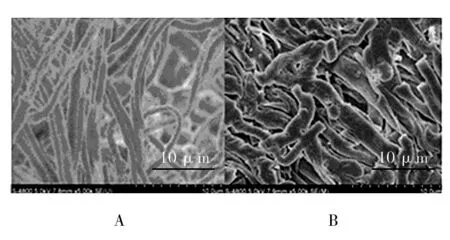
图5 稻瘟病菌菌丝的电子显微镜图Fig.5 The Electron microscope of rice blast fungus hyphaeA:对照组菌丝; B:BCHN-15作用48 h后的菌丝A:The control group of hyphae; B: Treat with BCHN-15 for 48 h
2.6 BCHN-15发酵液对稻瘟病菌细胞膜的影响
实验结果显示,随着BCHN-15菌株发酵液与稻瘟病菌作用时间的延长,培养液中糖和蛋白的浓度逐渐上升(图6),当二者作用10 h时,与对照组相比,糖和蛋白的含量分别增加了285%和108%(P<0.01),表明稻瘟病菌的细胞膜受到了破坏,胞内的大分子物质渗漏到了细胞外。
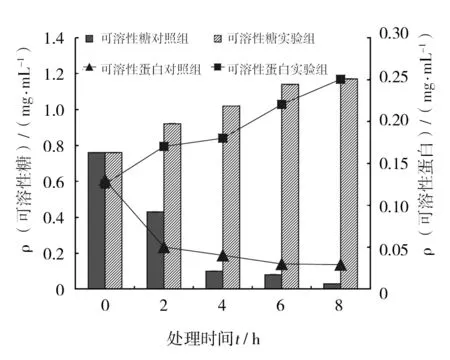
图6 BCHN-15发酵液对稻瘟病菌培养液中糖和蛋白的影响(n=3)Fig.6 he Effect of saccharide and protein by BCHN-15 which is in the culture of Magnaporthe oryzae(n=3)
2.7 BCHN-15发酵液热稳定性测定结果
实验结果显示,BCHN-15发酵液在低于100 ℃下处理时,发酵液的抑菌活性变化不大,表明BCHN-15菌株发酵液的活性成分热稳定性较好,但过高的温度(120 ℃)会破坏BCHN-15菌株抑菌活性成分(图7)。
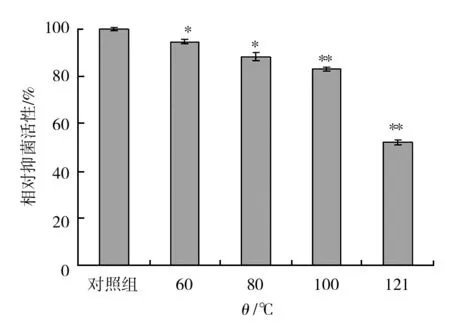
图7 温度对抑菌活性成分的影响Fig.7 The effect of temperature on antibacterialactive dingredients与对照组相比,*P<0.05,**P<0.01,n=3compare with the control group,*P<0.05,**P<0.01,n=3
2.8 BCHN-15发酵液活性成分分析
研究结果表明,不含BCHN-15菌株的发酵液经盐酸沉淀后,上清液和沉淀部分对稻瘟病菌均无明显抑制作用,而BCHN-15菌株发酵液经盐酸沉淀后,其沉淀部分和上清液对稻瘟病菌均有明显抑制作用,且沉淀部分的抑菌作用明显高于上清液,表明BCHN-15菌株的抗菌活性物质可以被酸沉淀(图8)。
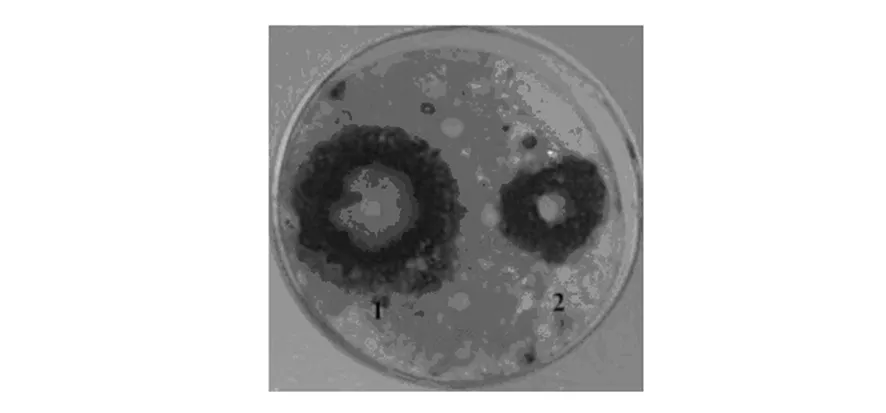
图8 发酵液活性成分的抗菌效果Fig.8 The antibacterial effect of BCHN-15 fermented liqui active dingredients1:沉淀 2:上清1: precipitation; 2:supernatant
3 讨 论
从海洋微生物中获得具有新颖结构的稻瘟病拮抗菌是目前防治水稻病害的有效方法之一[12]。Fudou等[13]从海洋中分离出多种对植物病原真菌具有抑菌作用的活性成分。本文从大连开发区近海海域分离到1株对稻瘟病菌有显著拮抗作用的BCHN-15菌株,经鉴定该菌株为解淀粉芽胞杆菌。已有的研究结果显示,解淀粉芽胞杆菌具有广谱的抑菌活性,对稻瘟病、炭疽病、灰霉病等多种真菌病害都有抑制作用[14]。本文的实验结果显示,BCHN-15菌株对稻瘟病菌也具有显著的抑制作用,该菌株发酵液作用稻瘟病菌48 h后,稻瘟病菌的菌丝重量明显减少,并可使病菌的菌丝发生扭曲、变形、畸形和断裂等现象,最终可能导致菌丝不能正常分化产生孢子,影响其繁殖。
细胞膜是保证细胞内环境稳定和细胞正常代谢的屏障结构,细胞膜的破坏,导致菌体的生命活动受到影响[15]。本实验结果显示,BCHN-15菌株发酵液可破坏稻瘟病菌的细胞膜,可使病菌细胞内的糖和蛋白发生泄漏,进而影响菌体的生物学功能或导致死亡。关于解淀粉芽胞杆菌的抑菌作用机制较为复杂,主要是因为不同来源的解淀粉芽胞杆菌其产生的抑菌活性成分不同。有报道显示,解淀粉芽胞杆菌产生的抑菌活性成分主要为抗生素和蛋白质多肽,且代谢产物的活性物质具有热稳定性、耐酸、耐碱等特性[16]。本实验分离得到的BCHN-15所产生的抑菌活性物质,热稳定性好,且能被酸沉淀,初步推测其抑菌物质可能为蛋白质类多肽,但其具体成分还有待于进一步研究。
[1] 温小红,谢明杰,姜健,等.水稻稻瘟病防治方法研究进展[J].中国农学通报,2013,29(3):190-195.
[2] 刘国权,孟昭河,任艳军,等.水稻抗稻瘟病研究进展与对策[J].中国农学通报,2004,20(1):211-214.
[3] 张传清,周明国,朱国念.稻瘟病化学防治药剂的历史沿革与研究现状[J].农药学学报,2009,11(1):72-80.
[4] 邵杰.生物农药研究进展[J].安徽科技学院学报,2008,22(5):10-14.
[5] 黄惠莉,肖易,殷果.一株具有拮抗作用的海洋放线菌筛选及其特性[J].食品与生物技术学报,2010,29(3):471-475.
[6] 薛东红,刘训理,陈凯,等.一株植物病原真菌拮抗细菌的分离与鉴定[J].山东农业大学学报(自然科学版),2006,37(l):1-5.
[7] 林敏,宁喜斌.具抑菌活性海洋微生物的筛选[J].微生物学杂志,2005,25(5):23-25.
[8] 李永刚,宋兴舜,马凤鸣,等.水稻稻瘟病拮抗菌L1鉴定及抑菌特性的初步研究[J].微生物学通报,2008,35(6):898-902.
[9] 胡苗清,姚明泽,张耀华,等.两株芽孢杆菌的鉴定及淀粉酶基因的克隆[J].华北农学报,2011,26(5):103-106.
[10]杨静,于新,杨鹏斌,等. 乳酸亚铁对两种致病菌的生长抑制及细胞膜通透性的影响[J].食品科学,2013,34(21):121-124.
[11]Kim PI,Bai H,Bai D,et al.Purification and characterization of a lipopeptide produced byBacillusthuringiensisCMB26[J].Journal of Applied Microbiology,2004,97(5):942-949.
[12]余琴.葡萄球菌LZ16的鉴定及其抗稻瘟病菌(Magnaporthecryzae)活性的研究[D].汕头:汕头大学,2013.
[13]Fudou R, Iizuka T, Yamanaka S.Haliangicin, a novel antifungal metabolite produced by a marine myxobacterium. 1. Fermentation and biological characteristics[J].The Journal of Antibiotics,2001,54(2):149-152.
[14]申应德.一株具有抑真菌作用的芽孢杆菌鉴定及其抑菌活性成分分析[D].天津:南开大学,2011.
[15]Cushnie TP,Lamb AJ,Biassoni D,et al. Inhibition of DNA restriction enzyme digestion by anthracyclines[J].Int antimicrob Agents,2005,26(5):343-356.
[16]Sun L J, Lu Z X, Bie X M, et al. Isolation and characterization of a co-producer of fengycins and surfactins,endophyticBacillusamyloliquefaciensES-2 ,from Scutel-laria baicalensis Georgi[J].World Journal of Microbiology and Biotechnology, 2006,22(12):1259-1266.
Identification and Characterization of an Antagonistic Strain against Rice Blast
HUANG Yuan-hui, XIE Kun-peng, WANG Shuo, Lü Xue-xin, XIE Ming-jie
(Schl.ofLifeSci.,LiaoningNormalUni.,KeyLab.ofBio-tech. &Molec.DrugDevel’tofLiaoningProv.Dalian116081)
An antagonistic bacterial strain BCHN-15 against rice blast pathogen was isolated from the offshore sea area at Dalian using confrontation and Oxford cup methods. Physiologic and biochemistry experiments and 16S rDNA methods identified BCHN-15 was aBacillusamylobacter. The results showed that BCHN-15 could significantly inhibit the growth of the rice blast and the dried weight of rice blast mycelium of was reduced by 74.36% as compared with control groups 48 h after affected with rice blast pathogen. The active ingredients produced by the strain could destroy the cell membrane of rice blast pathogen, and at the same time, they showed thermal stability and they could be precipitated by hydrochloric acid. The results showed that the antibacterial mechanism of BCHN-15 involved in the activity may include damaging plasma membrane, and causing malformation and rupture in hyphae.
rice blast pathogen; antagonistic bacteria; microbial inhibition
辽宁省教育厅科学研究一般项目(L2013412);大连市科技计划项目(2013E13SF108)
黄元慧 女,本科。研究方向为生物科学。E-mail:1127876921@qq.com
* 通讯作者。女,博士,教授,博士生导师。研究方向为微生物生化。E-mail:xmj1222@sina.com
2015-10-11;
2015-11-11
Q939.9
A
1005-7021(2016)01-0030-06
10.3969/j.issn.1005-7021.2016.01.006

