不同施肥处理对玉米-小麦轮作土壤微生物群落功能多样性的影响
邢鹏飞, 武晓森, 高圣超, 李洪杰, 赵同凯, 周晓琳, 沈德龙*, 孙军德
(1.沈阳农业大学 土地与环境学院,辽宁 沈阳 110866;2.中国农业科学院 农业资源与农业区划研究所,北京 100081;3.农业部微生物产品质量安全风险评估实验室,北京 100081;4.河北农业大学 生命科学学院,河北 保定 071000;5.德州市农业科学研究院,山东 德州 253015)
不同施肥处理对玉米-小麦轮作土壤微生物群落功能多样性的影响
邢鹏飞1,2,3, 武晓森2,3,4, 高圣超2,3, 李洪杰5, 赵同凯5, 周晓琳5, 沈德龙2,3*, 孙军德1*
(1.沈阳农业大学 土地与环境学院,辽宁 沈阳 110866;2.中国农业科学院 农业资源与农业区划研究所,北京 100081;3.农业部微生物产品质量安全风险评估实验室,北京 100081;4.河北农业大学 生命科学学院,河北 保定 071000;5.德州市农业科学研究院,山东 德州 253015)
土壤微生物多样性能反应土壤的肥力,不同的施肥措施对土壤微生物的种群和功能多样性也会产生重要的影响。以山东德州连续两年小麦季和玉米季收获后土壤为研究对象,利用Biolog技术研究了6种不同施肥处理对土壤微生物群落功能多样性的影响。结果表明:其中各个施肥处理的平均颜色变化率(average well color development,AWCD)差异显著,常规氮磷钾肥+全量秸秆还田+秸秆腐熟剂(FS)处理代谢活性最高;物种丰富度指数(H)和均匀度指数(E)也表明各施肥方式均能够维持微生物种群的多样性,其中FS和30%猪粪+70%常规氮磷钾肥(OF)处理物种丰富度指数(H)和均匀度指数(E)最高;PCA及RDA分析显示,OF和FS处理微生物功能多样性相似,且其微生物功能多样性与有机质(Soil organic matter,SOM)、全氮(Total N,TN)、速效磷(Available P,AP)和速效钾(Available K,AK)密切相关。猪粪堆肥有机无机复合肥3 600 kg/hm2(OI2)处理与猪粪堆肥有机无机复合肥1 800 kg/hm2(OI1)处理相似,其功能多样性比常规施肥(CF)处理稍高。综上所述,OF处理和FS处理的土壤微生物群落功能多样性程度高于其他处理,说明秸秆还田+秸秆腐熟剂和有机肥部分替代氮磷钾肥能够显著提高土壤微生物功能多样性,有利于保护土壤微生态。
不同施肥处理;土壤微生物;群落多样性;功能多样性;Biolog
土壤微生物是土壤的重要组成部分,更是土壤生态系统重要的组成部分[1]。土壤微生物是土壤生态系统养分循环和能量流动的主导者,对于维持土壤生态系统的稳定性和土壤的可持续利用具有重要作用[2]。土壤微生物可以调节土壤微生态,延长矿质元素的物质循环途径,促进营养元素的多元化,从而促进植物对营养元素的吸收,利于土壤肥力的保持[3-6]。与此同时,土壤中的一系列非生物的物化反应也对土壤微生物的种类及分布特征[7]产生深度的影响。施肥作为农业生产中的重要一环,对土壤和作物有重要的影响,采取不同的耕作制度或施用不同的肥料对土壤微生物数量、群落和功能也产生不同的影响[8]。施肥使农田微生物群落结构和功能发生了显著的变化,研究不同施肥方式对农田养分循环和施肥与环境间的关系有重要意义[9]。王锐等[10]认为,长期施用有机肥更有利于提高土壤肥力,促进土壤微生物生长繁育。王才斌等[11]研究表明,增施有机肥能有效增加土壤中细菌、放线菌和真菌数量,而在单施化肥的情况下,微生物数量不增加或者增加不明显。张瑞等[12]研究表明,单施有机肥的处理土壤微生物群落碳源利用能力明显高于其他处理。刘振香等[13]研究表明,施用有机肥可以显著提高土壤微生物数量、多样性及丰度,降低细菌群落优势度。还有研究表明,过多施用有机肥,并不能无限提高土壤微生物的数量[14],但是对微生物活性有明显的增强效果。秸秆还田等施肥措施可以增加土壤有机质的含量,进而为微生物提供了良好的物质基础,改变了土壤微生物的多样性[15]。Biolog微孔板技术是通过测定土壤微生物对31种不同单一碳源底物的代谢活性差异,来表征微生物种群多样性,并以此确定功能微生物种群变化的指标[16],这种方法可比单纯检测微生物总数能更好地反映出土壤微生物种群功能的多样性。本研究采用Biolog-Eco板,对黄淮海地区连续两年冬小麦-夏玉米轮作区土壤微生物群落功能多样性进行了研究,旨在深入研究增施不同量有机肥及秸秆还田对土壤微生物的影响,为进一步获得良好的肥料施用方式提供理论依据。
1 材料与方法
1.1 材料
1.1.1 试验田概况 该试验田地处山东德州市哨马营村,位于东经115°45′~117°24′、北纬36°24′~38°0′,属典型的温带大陆性季风气候,年均气温12.9 ℃,年均降水量547.5 mm。试验农田为黄河冲积平原,作物种植方式为典型的冬小麦-夏玉米轮作,小麦种植品种为济麦22,玉米为郑单958。试验前农田土壤养分含量:全氮1.2 g/kg,全磷0.83 g/kg,全钾20.8 g/kg,有效磷37.4 mg/kg,有机质含量20.3 g/kg,速效钾282 mg/kg,pH 8.3。所施无机肥种类:氮肥为尿素(含氮 46%),磷肥为过磷酸钙(含P2O516%),钾肥为硫酸钾(含K2O 50%)。复合肥含有机质20%,含氮 8%、磷 4%、钾 3%。试验设置6个处理:不施肥对照(CK),常规氮磷钾肥(CF),30%猪粪+70%常规氮磷钾肥(OF),全量秸秆还田+秸秆腐熟剂+常规氮磷钾肥(FS),猪粪堆肥有机无机复合肥1 800 kg/hm2(OI1),猪粪堆肥有机无机复合肥3 600 kg/hm2(OI2)(详见表1)。每个处理设置3次重复,共设18个小区,每个小区面积为50 m2(5 m×10 m)。小区间隔1 m,试验区外设置5 m保护行。不同施肥处理的小区随机排列。

表1 各小区施肥量(kg/小区)
1.1.2 样品采集 土壤样品分别于2012年和2013年小麦、玉米收获后进行取样,取0~20 cm土层土壤样品,分别于每个小区取9个点的土样,混匀后剔除石块和植物残根等杂物,于-70 ℃保藏,用于Biolog功能的检测。土壤微生物种群功能多样性,采用美国Matrix Technologies Corporation生产的Biolog-Eco板测定。
1.1.3 培养基 采用高氏 1 号琼脂培养基(倒平板前按 1 mL 培养基含 K2Cr2O775 μg的量加入无菌 K2Cr2O7溶液)分离放线菌,牛肉膏蛋白胨培养基分离细菌,马丁氏培养基分离真菌[17-18]。
1.2 方法
1.2.1 Biolog试验 ①制备土壤菌悬液:分别称取土壤样品20 g,置于装有100 mL生理盐水的无菌锥形瓶中,200 r/min震荡40 min,稀释100倍,制成初始土壤菌悬液[19],备用。②制备土壤接种液:将初始土壤菌悬液混匀并静置5 min,使土壤中颗粒较大的砂砾沉淀。校正浊度计后,把上述菌悬液逐滴向20 mL无菌生理盐水中缓慢滴加,调节土壤接种液浊度为63%。③接种:将土壤接种液倒入接种液槽,用8通道移液器吸取接种液,每个微孔注入150 μL,将微板编号,25 ℃培养[20-21]。④读数:每隔24 h读取各板孔在590 nm和750 nm处的吸光值(A),并保存结果文件(读取平台为美国Biolog公司的Biolog Reader)。
1.2.2 Biolog数据分析 利用Microlog4.2软件,将各数据转换成Excel格式,以便于进一步计算分析。①采用各Eco-MicroPlate吸光值数据,计算平均颜色变化率(average well color development,AWCD)。采用Classen等[22]的方法计算Biolog微孔板的颜色变化平均值,用每个对应孔590 nm的吸光值与750 nm的吸光值的差减去对照孔吸光值,结果即为反应单孔实际颜色变化的吸光值,其中数值小于0.06时按0处理。利用处理后得到的数据按照Garland等[23]的方法计算AWCD,公式如下:
(1)
式中:Ci为每个微板孔的吸光值,C0为对照孔吸光值,n为培养基种类数(ECO-MicroPlate为31种培养基)。
②土壤悬液微生物物种丰富度用Shannon-Weinner指数(H)表征,各供试土样微板数据的Shannon-Weinner指数(H)计算公式如下:
H=-∑(Pi×log Pi);
Pi=(Ci-C0)/∑(Ci-C0)
(2)
式中:Ci为每个微板孔的吸光值,C0为对照孔吸光值,Pi为含底物的微孔和对照孔吸光值的差值与整个微板总体差值的比值。
③土壤悬液微生物物种均匀度用Shannon-Weinner指数(E)表征,各供试土样微板数据的Shannon-Weinner均匀度指数(E)计算公式如下:
E=H/lnS
(3)
式中:H为Shannon-Weinner物种丰富度指数,S为有颜色变化的微孔数目。
由于Biolog试验数据量较大而且较为繁琐,因此很难直接比较各个处理间的差异,所以通常借助于主成分分析来比较不同样品微生物群落功能多样性。本研究取培养至72 h时的AWCD值,经过计算后,得到单孔相对光密度值进行主成分分析(PCA)[24-28]。
2 结果与分析
2.1 不同施肥处理的土壤微生物平均颜色变化率(AWCD)
2012年和2013年小麦季和玉米季不同施肥处理土壤的AWCD分析结果见图1。由图1可知,小麦季和玉米季不同施肥处理土壤微生物AWCD的总体变化趋势随着时间的延长而逐渐提高,在培养24~72 h期间,曲线斜率最大,AWCD增长率最大,表明此阶段土壤微生物碳源代谢活性最高;72 h后AWCD同样继续升高,但增长率逐渐下降,最后进入平稳期,说明微生物代谢活动趋于平缓。不同处理间相比,施肥处理AWCD值高于不施肥对照(CK);施肥处理中FS在整个培养阶段中高于其他处理,OF和CF次之,OI1和OI2略低。由此可以说明,不施肥对照土壤微生物的代谢活性低于其他施肥方式,秸秆还田和施用有机肥后土壤微生物代谢活性高于单施化肥,其中使用FS处理更能提高土壤微生物代谢活性。
2.2 不同施肥处理土壤微生物种群多样性指数的变化
为了研究采取不同施肥措施后土壤微生物种群的变化,计算了小麦季和玉米季Shannon-Weinner丰富度指数(H)和Shannon-Weinner均匀度指数(E),二者可以较好地反映土壤中微生物种群多样性[29],结果见表2。
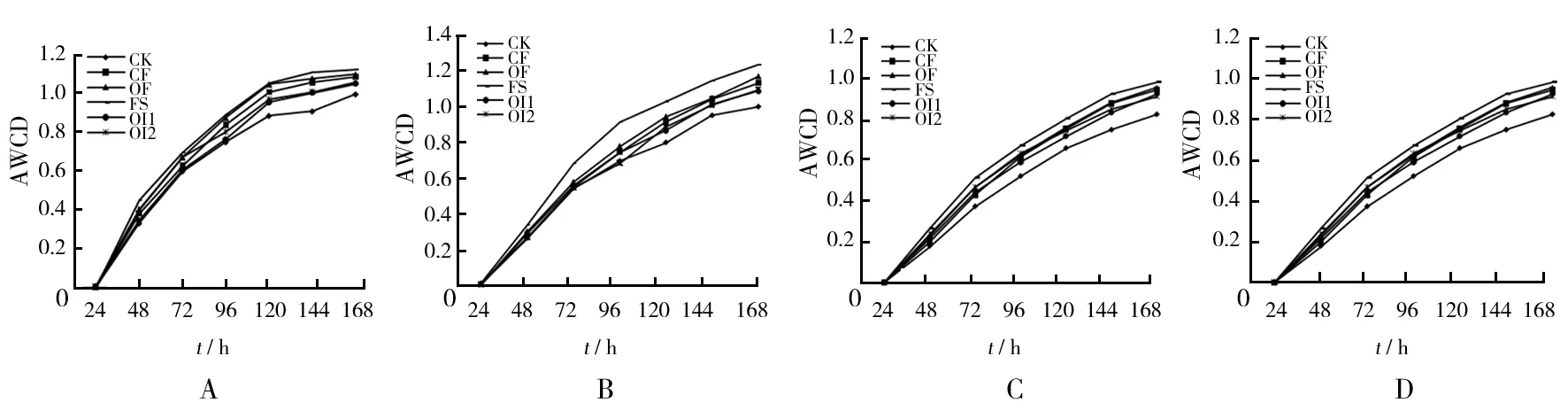
图1 2012、2013年小麦季和玉米季不同施肥处理土壤微生物的孔平均颜色变化率Fig.1 Different fertilization AWCD of wheat season and corn season in 2012 and 2013A:2012年小麦季;B:2012年玉米季;C:2013年小麦季;D:2013年玉米季,下图同A:2012 wheat season;B:2012 corn season; C:2013 wheat season;D:2013 corn season,the following figure with

2012年2013年处理物种丰富度指数(H)物种均匀度指数(E)物种丰富度指数(H)物种均匀度指数(E)小麦季玉米季小麦季玉米季小麦季玉米季小麦季玉米季CK1.37±0.01a1.38±0.02a0.42±0.01a0.43±0.01a1.32±0.01a1.24±0.01a0.41±0.00a0.38±0.00aCF1.39±0.01b1.39±0.05a0.42±0.01a0.43±0.01a1.36±0.06a1.24±0.01a0.42±0.02ab0.38±0.01aOF1.44±0.01c1.41±0.01ab0.45±0.01b0.44±0.00ab1.36±0.03ab1.26±0.04a0.42±0.01ab0.39±0.00aFS1.46±0.01d1.44±0.01b0.45±0.02b0.45±0.00b1.39±0.01b1.27±0.02a0.43±0.00b0.40±0.01aOI11.39±0.01b1.38±0.01a0.43±0.01ab0.44±0.01ab1.33±0.02a1.26±0.04a0.41±0.01a0.39±0.01aOI21.39±0.01b1.38±0.01a0.43±0.01ab0.44±0.01ab1.33±0.01a1.25±0.01a0.41±0.00a0.39±0.00a
注:表中AWCD为培养至72 h的结果;同一列中具有不同字母表示结果差异显著(P< 0.05)
从表2可以看出,总体趋势上,小麦季和玉米季不同施肥处理的微生物群落物种丰富度指数(H)和均匀度指数(E)中CK处理的最低,CF处理略高于CK处理,OI1、OI2处理均高于CK、CF, FS处理和OF处理均明显高于其他处理,FS处理丰富度和均匀度最高。结果说明:不施肥处理跟常规氮磷钾肥处理(CF)微生物群落功能多样性较低,增施有机肥后会增强土壤微生物群落功能多样性,其中有机肥替代部分化肥(OF)和秸秆还田(FS)效果明显。
2.3 土壤微生物碳源利用的主成分分析(PCA)
2.3.1 不同碳源在主成分上的荷载值 按照Eco板上31种不同碳源的化学基团性质的不同,将31种碳源分成糖类、氨基酸类、羧酸类、胺类、聚合物类和其他。通过不同碳源在第一主成分(PC1)、第二主成分(PC2)中的荷载因子大小的比较,可以得出分别与第一、第二主成分具有较高相关性的碳源种类与数量(见表3)。
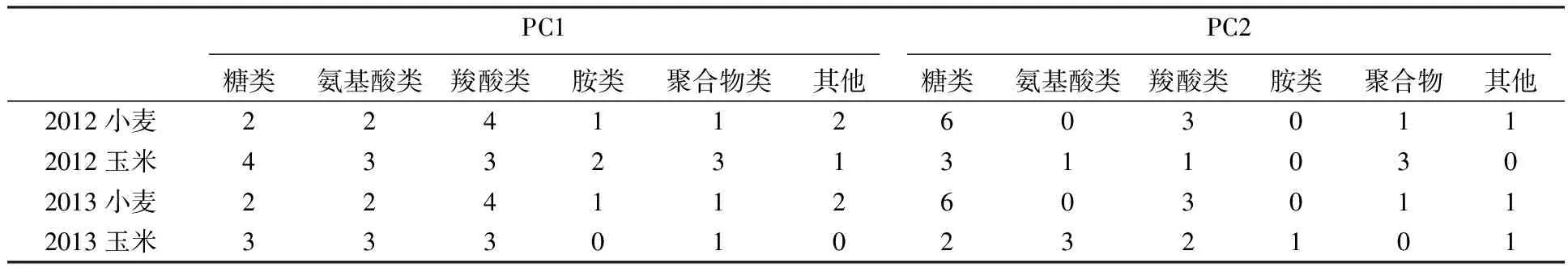
表3 主成分分析中高相关性碳源分布情况
由表3可知,在冬小麦-夏玉米轮作体系中,土壤微生物都不同程度地利用糖类、氨基酸类、羧酸类、胺类、聚合物类等碳源。其中,胺类和其他碳源利用程度最低,而糖类、羧酸类、聚合物类、氨基酸类是土壤微生物碳源的主要来源。
2.3.2 不同施肥处理的碳源利用主成分分析 为了防止出现Eco板中某碳源底物提前消耗完毕的可能,本研究采用72 h时测定的AWCD数据,应用SPSS软件进行标准化处理,对微生物种群的代谢特征进行了主成分分析(Principal Component Analysis,PCA)。各季中,除了第一主成分和第二主成分,后面的主成分贡献率均较小,所以选取上述数据中前两个主成分进行分析。以第一主成分为横轴,第二主成分为纵轴作图,得到不同施肥处理土壤微生物对31种碳源利用情况的主成分分析图(图2)。

图2 不同施肥处理土壤微生物碳源利用的主成分分析Fig.2 PCA for soil microorganism carbon source utilization
图2中4个主成分图上,6组处理根据离散程度大致分成3组。FS和OF处理位于PC1轴和PC2轴正端,而CK和CF轴位于PC1轴和PC2轴负端,OI1和OI2则位于PC1轴负端和PC2正端,各组内2处理分别存在一定的相似性。除2012年小麦季外,CK、CF处理与另3个季度其他处理相比差异都显著,结果表明,不同施肥处理在PC轴上出现了明显的差异,说明不同处理对土壤微生物的碳源利用类型有显著影响,使用不同肥料其微生物群落功能的多样性就有差异,并且差异显著。按小麦季和玉米季时间顺序来看,3组处理之间的差异越来越明显,说明随着施肥时间的延长,其对土壤微生物碳源代谢的影响越来越明显。
2.4 土壤微生物功能多样性与土壤化学性质的相关性分析
为探究土壤化学性质对微生物功能多样性的影响,测定了土壤pH、有机质(Soil organic matter,SOM)、全氮(Total N,TN)、速效磷(Available P,AP)和速效钾(Available K,AK)5种土壤化学性质,并以此进行RDA分析(图3)。
如图3所示,不同处理土壤微生物功能多样性与土壤化学性质相关性明显。各个处理从CK处理开始向SOM、TN、AP、AK箭头方向呈现一定梯度分布。CK处理与土壤pH(P<0.01)呈现正相关,其余处理与SOM、TN、AP、AK(P<0.05)呈正相关,且相关性明显。其中OF、FS处理与土壤有机质、全氮速效磷、速效钾的相关性最大; OI1、OI2处理次之;CF处理在小麦季与在玉米季略有不同,小麦季受理化影响明显,与OI2处理受影响水平相近,玉米季受理化性质影响稍小,与OI1处理受影响水平相近。小麦季中OF、FS处理微生物功能多样性与土壤有机质相关性明显,玉米季则不明显。

图3 不同施肥处理土壤微生物功能多样性与土壤化学性质的RDA分析Fig.3 RDA between functional diversity of soil microbial communities and soil characteristics of soil samples
3 讨 论
AWCD能够准确反映土壤微生物代谢活性的强弱,微生物利用碳源能力的强弱可以根据AWCD值的高低来判断。而在Eco板中共有31种碳源,因此本研究中AWCD能够反映不同施肥处理下土壤微生物利用碳源能力的大小[31-32]。本研究结果表明,各施肥处理AWCD值均显著高于对照,其中秸秆还田处理和70%NPK+有机肥处理最高,表明采取增施有机肥或秸秆还田措施能显著提高农田土壤中微生物的碳源利用能力,而其他3个施肥处理碳源的利用能力略低。这可能是由于增施有机肥或秸秆还田会大量增加土壤中有机质的含量,大大改善了土壤性状,从而改善微生物生境,使其数量和种类增加,土壤中原来不被利用或者利用少的碳源开始利用并增强,最终结果是提高了土壤微生物群落的数量和代谢功能的多样性。朱海平等[34]、王光华等[35]研究也表明,施用厩肥、秸杆能显著增强土壤微生物生物量和基础呼吸量,提高维持土壤微生物多样性及功能。相反,单施化肥处理的土壤微生物对碳源的利用能力也高于不施肥处理,这与张瑞等[12]、李东坡等[35]研究相似。复合肥处理较不施肥处理的土壤微生物碳源利用水平高,但相较于FS和OF处理低,可能是由于复合肥中养分比例比较固定,难以满足土壤和各种作物的需要。土壤施用有机肥可使微生物能够利用的碳源趋于多元化,微生物能够利用的碳源种类越多,其生存能力就越强,代谢活性也就越高。
本研究各处理物种丰富度(H)和均匀度(E)结果表明,FS、OF处理土壤微生物种群多样性最高,OI2、OI1处理次之,CF处理较低,CK处理最低。这说明秸秆还田或增施有机肥会显著增强土壤微生物种群多样性,有机无机复合肥对提高土壤微生物种群多样性效果不明显。虽然两年数据略有差别,但处理间物种丰富度(H)和均匀度(E)变化趋势一致,且2013年各处理间差异更为明显。分析原因,OF处理由于用有机肥替代部分化肥,提高了土壤中有机质含量,为微生物提供了良好的生存环境,因此其微生物丰富度指数和均匀度指数远高于CK和CF。小麦季和玉米季土壤微生物物种丰富度指数和均匀度指数FS处理最高,可能是由于秸秆还田极大地增加了土壤中有机物的含量,大量纤维素在土壤中起到了疏松土质的作用,增加了土壤含氧量,提高了土壤微生物的代谢强度;此外,施加的秸秆腐熟剂,能够加快秸秆的腐熟,使更多的营养物质进入土壤,增加了微生物的丰富度。时鹏等[36]通过玉米连作及施肥试验也得出了同样的结果。
主成分分析结果显示,对于PC1和PC2起分异作用的主要碳源是糖类、氨基酸类和羧酸类物质,氨基酸类和糖类在PC1轴上的权重较大,而与PC2相关性较大的碳源主要是羧酸类、糖类和聚合物类。糖类和氨基酸类碳源是区分各个处理的主要碳源。此外,CK处理和CF处理,OF处理和FS处理,OI1处理和OI2处理碳源利用方式分别相似,并且与2013年及2012年相比其相似性更明显。可能是由于随着施肥处理时间的增长,各个处理土壤微生物群落趋于稳定,且施肥种类相似的处理其土壤微生物群落结构和功能也相似。
土壤微生物功能多样性与土壤化学性质的相关性分析结果表明,土壤化学性质与土壤微生物功能多样性密切相关。施肥能改变土壤中氮磷钾及有机质含量,从而影响土壤微生物功能的多样性。全量秸秆还田+秸秆腐熟剂+常规氮磷钾肥(FS)、有机肥+常规氮磷钾肥(OF)处理土壤中有机质、全氮速效磷、速效钾含量最高,土壤微生物功能多样性程度也最高;猪粪堆肥有机无机复合肥(OI2)、猪粪堆肥有机无机复合肥(OI1)次之,全量氮磷钾肥(CF)较低,不施肥对照(CK)最低。这表明秸秆还田+腐熟剂和有机替代部分化肥能提高土壤养分含量,同时大幅提高土壤微生物功能多样性,Zhao等[37]、Li等[38]也得出相似结论;猪粪堆肥有机无机复合肥也能提高土壤养分含量和微生物功能多样性,效果比常规氮磷钾肥(CF)稍好,这与Wei等[39]结论一致。RDA分析中,CF处理玉米季与小麦季有所差异,其原因可能是CF与其他处理相比,其玉米季土壤中氮磷钾流失程度高于小麦季[40]。
综上所述,所有施肥处理均有利于维持土壤微生物的群落多样性。秸秆还田+腐熟剂+常规施肥及有机肥替代部分氮磷钾肥显著提高了土壤微生物物种丰富度指数和均匀度指数,增强了微生物代谢活性,提高了土壤微生物功能多样性。猪粪堆肥有机无机复合肥也能提高土壤微生物种群和功能多样性,但效果低于秸秆还田和有机替代,仅比常规氮磷钾施肥好。所以,施肥可显著影响土壤微生物功能多样性,但其影响程度可能与施肥种类、施肥方式、土壤性质等因素密切相关。秸秆还田+腐熟剂和有机替代是否已是最优施肥方式,改变腐熟剂种类或者有机替代比例能否达到更好效果,这还有待于进一步研究。
[1] Pankhurst CE, Keller KO, Gupta V V S R. Biodiversity of soil microbial communities in agricultural systems[J].Biodiversity and Conservation,1996,5(2):197-209.
[2] Schloter M, Dilly O, Munch JN. Indicators for evaluating soil quality[J].Agriculture Ecosystems and Environment,2003,98(1/3): 255-262.
[3] Bardgett R D, Speir T W, Ross D J,et al. Impact of pasture contamination by copper, chromium and arsenic timber preservative on soil microbial properties and nematodes[J].Biology and Fertility of Soils,1994,18: 71-79.
[4] Enwall K, Nyberg K, Bertilsson S,et al. Long-term impact of fertilization on activity and composition of bacterial communities and metabolic guilds in agricultural soil[J].Soil Biology and Biochemistry,2007,39(1): 106-115.
[5] Bradley J C, Diane S S, Duffy E,et al. Effects of biodiversity on the functioning of trophic groups and ecosystems[J].Nature,2006,443: 989-992.
[6] Sparling G P. Ratio of microbial biomass carbon to soil organic carbon as a sensitive indicator of changes in soil organic matter[J].Australian Journal of Soil Research,1992,30: 195-207.
[7] Buenemann E K, Bossio D A, Smithson P C, et al. Microbial community composition and substrate use in a highly weathered soil as affected by crop rotation and P fertilization[J].Soil Biology and Biochemistry,2004,36(6): 889-901.
[8] Hai L, Li X-G, Li F-M, et al. Long-term fertilization and manuring effects on physically-separated soil organic matter pools under a wheat-wheat-maize cropping system in an arid region of China[J].Soil Biology and Biochemistry,2010,42(2): 253-259.
[9] Fauci MF, Dick R P. Soil microbial dynamics: short-and long-term effects of organic and inorganic nitrogen[J].Soil Science Society of America Journal,1994,58: 801-808.
[10]王锐,林先贵,陈瑞蕊,等.长期不同施肥对潮土芽胞杆菌数量的影响及其优势度的季节变化[J].土壤学报,2013,50(4): 778-785.
[11]王才斌,郑亚萍,梁晓艳,等.施肥对旱地花生主要土壤肥力指标及产量的影响[J].生态学报,2013,33(4): 1300-1307.
[12]张瑞,张贵龙,陈冬青,等.不同施肥对农田土壤微生物功能多样性的影响[J].中国农学通报,2013,29(2): 133-139.
[13]刘振香,刘鹏,贾绪存,等.不同水肥处理对夏玉米田土壤微生物特性的影响[J].应用生态学报,2015,26(1): 113-121.
[14]谭周进,周卫军,张杨珠,等.不同施肥制度对稻田土壤微生物的影响研究[J].植物营养与肥料学报,2007,13(3): 430-435.
[15]刘晓蒨,涂世华,孙锡发,等.长期不同施肥对稻田土壤微生物群落功能多样性的影响[J].生态学报,2013,33(17): 5210-5217.
[16]Roger BF, Tate RL. Temporal analysis of the soil microbial community along a top sequence in Pineland soils[J].Soil Biology and Biochemistry,2001,33(10): 1389-1401.
[17]李阜棣,喻子牛,何绍江.农业微生物学实验技术[M].北京:中国农业出版社,1996:69-72.
[18]赵斌,何绍江.微生物学实验[M].北京:科学出版社,2002:251,253-254.
[19]郑华, 欧阳志云, 方治国,等.BIOLOG在土壤微生物群落功能多样性研究中的应用[J].土壤学报,2004,(3):456-461.
[20]Kennedy AC, Smith KL. Soil microbial diversity and the sustainability of agricultural soils[J].Plant and Soil, 1995, 170(1): 75-86.
[21]侯晓杰,汪景宽,李世鹏,等.不同施肥处理与地膜覆盖对土壤微生物群落功能多样性的影响[J].生态学报,2007,27(2): 655-661.
[22]Classen AT, Boyle SI, Heskins KE, et al. Community-level physiological profiles of bacteria and fungi: plate type and incubation temperature influences on contrasting soils[J].FEMS Microbiology Ecology,2003,44: 319-328.
[23]Gafand JL, Mills AL. Classification and characterization of heterotrophic microbial communities on the basis of patterns of community-level sole-carbon-source utilization[J].Applied and Environmental Microbiology,1991,57: 2351-2359.
[24]郭宝林,杨俊霞,李永慈,等.主成分分析法在仁用杏品种主要经济性状选种上的应用研究[J].林业科学,2000,36(6): 53-56.
[25]何晓群.多元统计分析[M]. 北京:中国人民大学出版社,2008.
[26]Kela PW, Jason AG, Matthias G, et al. Data transformations in the analysis of community-level substrate utilization data from microplates[J].Journal of Microbiological Methods,2007,69: 461-469.
[27]Grove JA, Kautola H, Javadpour S, et al. Assessment of changes in the microorganism community in a biofilter[J].Biochemical Engineering Journal,2004,18: 111-114.
[28]Min L, Xiao M-X. Effect of heavy metals on substrate utilization pattern, biomass, and activity of microbial communities in a reclaimed mining wasteland of red soil area[J].Ecotoxicology and Environmental Safety, 2007,66: 217-223.
[29]Magurran AE. Ecological diversity and its measurement[M].USA: Princeton University Press,1988,141-162
[30]郝黎仁,樊元,郝哲欧,等.SPSS实用统计分析[M].北京:中国水利水电出版社,2003.
[31]O’Donnell AG, Seasman M, Macrae A, et al. Plants and fertilisersas drivers of change in microbial community structure and function in soils[J].Plant and Soil, 2001,232(1): 135-145.
[32]Benizri E, Amiaud B. Relation between plants and soil microbial communities in fertilized grasslands[J].Soil Biochemistry, 2005,37(11): 2055-2064.
[33]朱海平,姚槐应,张勇勇,等.不同培肥管理措施对土壤微生物生态特征的影响[J].土壤通报,2003, 34(2): 140-142.
[34]王光华,刘俊杰,齐晓宁,等.Biolog和PCR-DGGE技术解析施肥对德惠黑土细菌群落结构和功能的影响[J].生态学报, 2008, 28(1): 220-226.
[35]李东坡,武志杰,陈利军,等.长期培肥黑土微生物量磷动态变化及影响因素[J].应用生态学报,2004, 15(10): 1897-1902.
[36]时鹏,高强,王淑平,等.玉米连作及其施肥对土壤微生物群落功能多样性的影响[J].生态学报,2010, 30(22): 6173-6182.
[37]Shicheng Zhao, Kejiang Li, Wei zhou,et al. Changes in soil microbial community, enzyme activities and organic matter fractions under long-term straw return in north-central China[J].Agriculture, Ecosystems and Environment,2016,(216): 82-88.
[38]Juan Li, Julia Mary Cooper, Zhi’an Lin,et al. Soil microbial community structure and function are significantly affected by long-term organic and mineral fertilization regimes in the North China Plain[J].Applied Soil Ecology,2015,(96): 75-87.
[39]Wei Tian, Lei Wang, Yan Li,et al. Responses of microbial activity, abundance, and community in wheat soil after three years of heavy fertilization with manure-based compost and inorganic nitrogen[J]. Agriculture, Ecosystems and Environment,2015,(213): 219-227.
[40]Liyue Guo, Guanglei Wu, Yong Li,et al. Effects of cattle manure compost combined with chemical fertilizer on topsoil organic matter, bulk density and earthworm activity in a wheat-maize rotation system in Eastern China[J].Soil & Tillage Research,2016,(156): 140-147.
Effects of Different Fertilization on Soil Microbial Community and Functional Diversity in Maize-Wheat Crop Rotation
XING Peng-fei1, 2,3, WU Xiao-sen2, 3,4, GAO Sheng-chao2,3, LI Hong-jie5,ZHAO Tong-kai5,ZHOU Xiao-lin5, SHEN De-long2,3, SUN Jun-de1
(1.Coll.ofLand&Environ’t,ShenyangAgric.Uni.,Shenyang110866; 2.Inst.ofAgric.Res. &Reg’lPlan.,ChineseAcad.ofAgric.Sci.,Beijing100081; 3.LaboratoryofQualityandSafetyriskAssessmentforMicrobialProductsMinistryofAgriculture,Beijing100081;4.Coll.ofLifeSci.,Agric.Uni.ofHebei,Baoding071000;5.DezhouAcad.ofAgric.Sci.,Dezhou253015 )
The diversity of soil microbes can reflect the soil fertility and different fertilization also works importantly on soil microbial population and diversity. In this study, soil after the harvest of two-year in succession of maize season and wheat season in Dezhou field ecosystem station run by CAAS was taken as the research object to study the influence of different fertilization on microbial community functional diversity with six different fertilization treatments using Biolog technique. The results showed that each of six fertilization treatments had significant differences in AWCD (average well color development), and each of them were all significantly higher than that of the control without fertilization (CK). Soil microbial communities richness index (H) and evenness index (E) of fertilization treatments FS (conventional NPK+ straw + straw decomposing inoculants) and OF (70% conventional NPK + 30% swine excrement) were higher than others’. PCA (principal component analysis) and RDA (redundancy analysis) showed that OF and FS had similar functional diversity of microbial communities, and they had high level relativity with SOM (soil organic matter), TN (total N), AP (available P), and AK (available K). The treatment of swine excrement compost + organic + inorganic compound fertilizer 1 800 kg/hm2(OI1) and the treatment of swine excrement compost + organic + inorganic compound fertilizer 3 600 kg/hm2(OI2) were treated similarly, their functional diversity were lower than FS and OF, and higher than CF. To sum up the above mentioned, the degree of soil microbial community and functional diversity of OF treatment and FS treatment was higher than those other treatments, indicated that straw field-returning plus straw decomposing preparation and organic fertilizer to replace part of NPK fertilizer could improve soil microbial community and functional diversity, and conduce to protect soil microbial ecology.
different fertilization; soil microbe; community and functional diversity; Biolog
农业部公益性农业行业科研专项(201103004);农业部生物有机肥创制重点实验室开放课题资助
邢鹏飞 男,硕士研究生。主要从事微生物生态学方面的研究。E-mail:xingruofeng@126.com
2015-09-07;
2015-12-24
Q939.96
A
1005-7021(2016)01-0022-08
10.3969/j.issn.1005-7021.2016.01.005
* 通讯作者。孙军德 男,教授,博士生导师。主要从事微生物农药与肥料、食药用真菌菌种选育与栽培等研究。
E-mail: sunjunde108@163.com
沈德龙 男,研究员,硕士生导师。主要从事农用微生物资源和应用基础研究、微生物肥料行业管理工作。E-mail:shendelong@caas.cn

