质膜钙ATP酶异构体1~3在新生大鼠耳蜗基底膜的表达△
陈请国褚汉启周良强陈金刘云罗蜜陶雁玲
质膜钙ATP酶异构体1~3在新生大鼠耳蜗基底膜的表达△
陈请国1褚汉启1周良强1陈金1刘云1罗蜜2陶雁玲1
目的 通过Western blot方法检测质膜钙ATP酶异构体1~3(plasma membrane Ca2+-ATPase isoforms 1~3,PMCA1~3)在新生大鼠耳蜗基底膜(basilar membrane,BM)的表达,并检测PMCA2在单个新生大鼠耳蜗毛细胞纤毛的表达量。方法 ①取出生后2天(P2)和8天(P8)健康SD大鼠各4只,断头后分离出BM,提取总蛋白,分别取20μg,通过Western blot法检测BM的PMCA1~3表达。②取P2和P8大鼠BM总蛋白3μg,通过Western blot方法检测BM的PMCA2的表达。③取4只P8大鼠,分离出BM,提取总蛋白,分别取5、10、20 μg总蛋白并取100、400和800 ng牛血清白蛋白(BSA)作为对照组,跑完电泳后将胶分为2部分,部分泳道用于SYPRO染胶,其余泳道用于Western blot检测PMCA2的表达。结果 ①在20μg的P2和P8大鼠BM总蛋白中,PMCA1仅有微弱的表达(分别为0.126±0.024、0.131±0.012),PMCA2表达水平较高(分别为4.16±0.528、4.25±0.319),PMCA3几乎没有表达(均为0),三者间差异有统计学意义(P<0.05)。②在3μg的P2和P8大鼠BM总蛋白中,P8大鼠PMCA2的表达水平(4.571±0.336)高于P2大鼠(3.622±0.285),差异有统计学意义(P<0.05)。③PMCA2在单个P8大鼠BM的含量约为2.5 ng。结论 PMCA1~3在新生大鼠耳蜗BM的表达水平不同,PMCA2表达量最大,这可能是由于耳蜗毛细胞对这几种PMCA亚型有不同的Ca2+调节需求。
质膜钙ATP酶异构体1; 质膜钙ATP酶异构体2; 质膜钙ATP酶异构体3; 基底膜; 耳蜗
在内耳中,Ca2+参与耳蜗毛细胞纤毛的机械电转导过程,对维持正常听觉生理发挥着关键作用。质膜钙ATP酶异构体(plasma membrane Ca2+-ATPase isoforms,PMCAs)是维持耳蜗毛细胞内Ca2+浓度平衡的重要蛋白质之一,它的主要作用是将毛细胞内Ca2+转移到细胞外,从而维持毛细胞内低Ca2+水平。已知PMCA存在四种亚型,分别是PMCA1~4[1],PMCA1~3在耳蜗内表达,而PMCA4表达很微弱,甚至不表达[2,3]。目前有关PMCA1~3在内耳表达的研究主要集中在成年大鼠,在新生大鼠内耳的研究较少[4,5]。本实验通过Western blot方法检测出生2天(P2)和8天(P8)大鼠耳蜗基底膜(basilar membrane,BM)PMCA1~3的表达,并应用SYPRO染胶法检测单个P8大鼠BM的PMCA2含量,以推测PMCA2在耳蜗毛细胞纤毛的表达量。报告如下。
1 材料与方法
1.1 实验动物 选择出生2天(P2)的健康SD大鼠4只,出生8天(P8)的健康SD大鼠8只(由华中科技大学同济医学院动物中心提供,并具备合格证书)。所有动物实验都经过华中科技大学同济医学院动物委员会同意,并按照标准的兽医标准执行。
1.2 主要试剂 Tris-base、甘氨酸(Glycine)、十二烷基硫酸钠(SDS)、Tween-20、脱脂奶粉蛋白、Marker、聚丙烯酰胺凝胶、Bradford定量液、上样缓冲液、BAS标准液(美国Bio-Rad公司),醋酸(美国Thermo Fisher Scientific公司),硝酸纤维素膜(美国Schleicher&Schuell公司),蛋白酶抑制剂、二硫苏糖醇(DTT)(美国Sigma公司),PMCA1~3抗体、内参蛋白GAPDH抗体(美国Affinity Bioreagents公司),HRP结合的羊抗兔二抗、ECL增强化学发光试剂、胶片、Sypro Ruby染胶液、蛋白质抽提液(美国Invitrogen Life Sciences)。
1.3 实验方法
1.3.1 P2和P8大鼠BM总蛋白提取 取P2和P8大鼠各4只,用海罗芬麻醉后断头,解剖出耳蜗,挑开骨质后去掉螺旋韧带和螺旋神经节组织,分离耳蜗基底膜(BM)(分离过程中用液氮罐保持低温,防止组织蛋白降解),剔除Tectorial膜和Reissner氏膜,然后提取总蛋白,用Bradford法测蛋白浓度。
1.3.2 Western blot方法比较PMCA1~3在P2和P8大鼠BM的表达差异 分别取P2和P8大鼠BM总蛋白20μg,在沸水中变性后加到7.5%聚丙烯酰胺凝胶上样孔,在170 V恒压条件下电泳1 h后转膜,根据泳道位置将膜剪成条带状,放到密封袋中,分别加入兔抗PMCA1~3抗体(1:1 000)、GAPDH(1:1 000)、4℃下在摇床上孵育过夜。TBST溶液(10 m M Tris-HCl(p H 8.0),150 m M NaCl,0.05%Tween 20)洗涤3次,每次10 min,加入用5%脱脂奶粉稀释的HRP结合的羊抗兔二抗(1:2 500),室温孵育1 h。TBST液体洗涤3次,每次10 min,用ECL增强化学发光法显色。之后显影、定影、压片、曝光到柯达胶片上,时间2~4 min。扫描后用Photoshop标记图片。之后取3μg的P2和P8大鼠BM总蛋白,依次加入兔抗PMCA2抗体(1:1 000),GAPDH(1:1 000)、HRP结合的羊抗兔二抗(1:3 000),具体步骤同上。以上每个步骤重复5次。
1.3.3 单个P8大鼠耳蜗BM的PMCA2含量检测
取4只P8大鼠的耳蜗,分离出BM(具体方法同上),加80μl蛋白抽提液和40μl蛋白酶抑制剂,提取总蛋白,获取上清液共117μl;用Bradford法测量蛋白浓度,分别上样5、10和20μg总蛋白,对照组分别加入100、400和800 ng牛血清白蛋白(BSA)。跑完电泳后将胶切为两部分,一部分用于SYPRO染胶(含10μg和20μg的总蛋白及100~800 ng BSA蛋白的泳道),另一部分(含5μg蛋白的泳道)用于做Western blot检测。将用于SYPRO染色的胶放到干净的容器,加入100 ml固定液(50%甲醛,7%醋酸,溶于双蒸水),放在摇床上固定30 min,倒掉液体后加入新鲜固定液,继续固定30 min;倒掉固定液后加入60 ml SYPRO Ruby染胶液,放到摇床上摇晃过夜。将胶转移到另外一个干净的容器,加入洗涤液(10%甲醛,7%醋酸,溶于双蒸水)摇床上摇晃30 min,之后用双蒸水漂洗胶2次,每次5 min,将胶放到凝胶成像系统中扫描。切下的另外一块胶用来做Western blot检测,转膜后封闭,加入一抗和二抗,具体方法同前。通过测量蛋白Marker条带之间的间距,比较Western blot实验后的胶片条带和SYPRO染胶后的蛋白条带,确定SYPRO染胶上PMCA2蛋白条带的位置。用Photoshop软件分别测量不同BSA含量条带的灰度值,画出BSA含量VS灰度值曲线,得到关系等式;然后测量PMCA2蛋白条带的灰度值,应用到BSA关系等式后算出条带中PMCA2的含量,通过计算上样的BM蛋白体积和BM蛋白提取液总体积的比值,算出8个BM中总的PMCA2含量,除以8得到单个BM的PMCA2含量。
1.4 统计学方法 用Photoshop软件测量PMCA1~3蛋白条带和内参蛋白条带GAPDH的灰度值,计算PMCA1~3条带和GAPDH条带的灰度值比值,作为PMCA1~3的相对表达量。实验数据以均数±标准差(±s)表示,使用SPSS 16.0软件对数据进行单因素方差分析和处理,采用t检验做比较,P<0.05表示差异具有统计学意义。
2 结果
2.1 PMCA1~3在P2和P8大鼠BM的表达差异
从图1看出,PMCA1在P2和P8大鼠的BM中表达较少,而PMCA2的表达强烈,PMCA3几乎没有表达。三者之间的表达差异具有统计学意义(P<0.05)。在20μg P2和P8大鼠BM总蛋白中PMCA1、PMCA2的表达差异无统计学意义(P>0.05)(表1)。
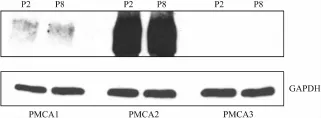
图1 通过Western blot方法检测PMCA1~3在P2和P8大鼠BM的表达电泳图
表1 20μg P2和P8大鼠BM总蛋白中PMCA1~3表达的蛋白条带灰度值比值(±s)
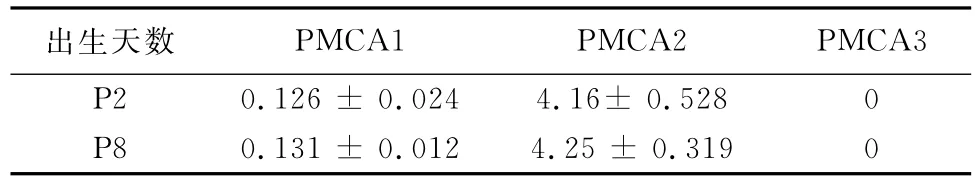
表1 20μg P2和P8大鼠BM总蛋白中PMCA1~3表达的蛋白条带灰度值比值(±s)
出生天数PMCA1 PMCA2 PMCA3 P2 0.126±0.024 4.16±0.528 0 P8 0.131±0.012 4.25±0.319 0
从表1看,PMCA2的表达太过强烈,可能影响其灰度值的检测。为了进一步检测P2和P8大鼠BM PMCA2表达差异,将BM总蛋白的上样量从20μg减少为3μg,再做Western blot,结果发现P8的蛋白条带灰度值比值(4.571±0.336)明显比P2(3.622±0.285)大,差异有统计学意义(P<0.05)(图2)。
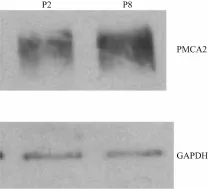
图2 Western blot方法检测PMCA2在3μg的P2和P8大鼠耳蜗BM表达电泳图
2.2 单个P8大鼠BM的PMCA2的含量 比较Western blot胶片条带和SYPRO染胶后的蛋白条带,用黑色直线标记的是PMCA2蛋白条带(图3)。用凝胶成像系统扫描凝胶后,用Photoshop测量不同BSA含量条带的灰度值,800 ng条带为191.85,400 ng条带为165.6,100 ng条带为113.27,分别减去背景灰度值后,用Excel画出BSA蛋白含量VS灰度值曲线,得到关系等式y=0.093 5x+21.638(y为灰度值,x为BSA蛋白含量),然后测量10μg和20μg上样蛋白条带中PMCA2条带的灰度值,减去背景灰度值后应用上面等式算出PMCA2含量,最后推算出单个P8大鼠基底膜中PMCA2的含量为2.5 ng左右。
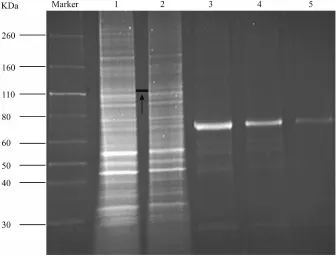
图3 SYPRO染胶后的PMCA2蛋白条带
3 讨论
Ca2+在内耳发挥着不可或缺的作用,因此调控内耳Ca2+平衡的机制研究也显得尤为重要。目前已知下列机制参与维持Ca2+平衡:PMCAs和Na+/Ca2+交换蛋白(NCX)将Ca2+排出细胞外、位于内质网的肌浆-内质网Ca2+-ATPase(SERCA)结合胞质内的Ca2+、Ca2+单输送体将Ca2+运送到线粒体、胞质内的钙缓冲蛋白结合游离Ca2+等。对毛细胞而言,由于它的纤毛浸泡在内淋巴液中,内淋巴液中丰富的K+阻碍Na+/Ca2+交换体发挥作用,同时毛细胞纤毛内缺少Ca2+储存系统来隔离Ca2+[6],因此,它主要依靠Ca2+缓冲系统及PMCA来调控胞内Ca2+浓度。PMCA2是PMCA家族中唯一与听觉有直接关联的亚型[7],PMCA2基因突变的小鼠出现先天性聋,主要原因是PMCA2突变后排钙能力明显下降,毛细胞纤毛附近淋巴液中的Ca2+水平降低[8],导致毛细胞适应的速度减慢,机械电转导通道开放的几率增加,甚至使它处于完全开放的状态[9],结果使毛细胞对声音刺激反应迟钝,从而出现耳聋。
虽然没有证据表明PMCA1和PMCA3与听觉有直接关联,但不排除它们协助PMCA2维持正常听觉功能,因此,了解PMCA1~3在BM的表达有一定的意义。前期通过免疫荧光检查发现PMCA2主要在BM的毛细胞纤毛表达,PMCA1和PMCA3除了在毛细胞表达外,在BM其他组织也有表达,但表达量很低[5];故检测BM的PMCA2表达相当于检测毛细胞纤毛的PMCA2表达;检测BM中PMCA1和PMCA3的表达也能间接了解它们在毛细胞的表达情况。本研究结果显示,PMCA1~3在新生大鼠BM的表达量有明显差异,PMCA2表达量最大,PMCA1次之,PMCA3未见明显表达,PMCA1在P2和P8大鼠BM的表达量区别不大;PMCA1主要表达于毛细胞的胞体侧膜[5],同样发挥着将胞内Ca2+转移到胞外的作用。从文中结果看,P8大鼠BM的PMCA2表达量明显强于P2大鼠,而PMCA2主要表达在外毛细胞纤毛,间接说明随着大鼠生长发育,外毛细胞纤毛PMCA2表达量明显增多。已有研究证实小鼠耳蜗外毛细胞的机械电转导电流随着小鼠生长发育也逐渐增大[10];由于Ca2+进入毛细胞是机械电转导电流出现的关键环节,PMCA2负责将胞内大部分Ca2+排出,因此,表明PMCA2和机械电传导电流之间存在着紧密的联系。此外,PMCA2对毛细胞机械电转导通道的发育也起着重要作用,此在发育中的小鸡耳蜗毛细胞得到证实[11]。PMCA3主要表达于内毛细胞的pericuticular necklace,在内毛细胞的胞体侧膜也有微弱的表达[2]。本实验未能在P2和P8大鼠的BM检测到PMCA3的表达,推测PMCA3在新生大鼠BM没有表达,或者表达很微弱,可能需要增加总蛋白上样量(比如50μg)才能检测到,方能进一步比较PMCA3在P2和P8大鼠BM的表达差异。从文中PMCA1~3在大鼠耳蜗BM的表达差异可以看出,BM对PMCA2的需求最大,PMCA1次之,PMCA3几乎没有,这可能与PMCA1~3在耳蜗发挥的生理功能不同有关。
前期研究证实PMCA2在P8大鼠耳蜗毛细胞纤毛的表达基本达到成年水平[5],因此,本研究取P8大鼠耳蜗BM,间接得出单个大鼠耳蜗毛细胞中PMCA2的含量为2.5 ng。根据Beurg等[12]对大鼠的研究,每个毛细胞的纤毛面积约为200μm2,每个耳蜗大约有11 000个毛细胞,每μm2纤毛含有6 000个钙泵,故每个耳蜗中约有1.32×1010个钙泵,而每摩尔物质中含有6.02×1023个微粒,可以推算每个耳蜗中含有2.19×10-14摩尔钙泵,而PMCA2的分子量为127 KDa,因此,重量为2.78 ng,该推测结果和本实验结果相近。PMCA在牛蛙毛细胞纤毛的分布密度为2 000/μm2[13,14],而大鼠毛细胞纤毛的PMCA密度为6 000/μm2,是牛蛙的几倍,这可能是由于哺乳动物听觉机制复杂,耳蜗毛细胞对Ca2+有着更高的调控需求。因此,检测PMCA2在耳蜗毛细胞的表达量有助于进一步了解PMCA2与内耳听觉功能的关联。
1 Keeton TP,Burk SE,Shull GE.Alternative splicing of exons encoding the calmodulin-binding domains and C termini of plasma membrane Ca2+-ATPase isoforms 1,2,3,and 4[J].J Biol Chem,1993,268:2740.
2 Dumont RA,Lins U,Filoteo AG,et al.Plasma membrane Ca2+-ATPase isoform 2a is the PMCA of hair bundles[J].J Neurosci,2001,21:5066.
3 Crouch JJ,Schulte BA.Expression of plasma membrane Ca-ATPase in the adult and developing gerbil cochlea[J].Hear Res,1995,92:112.
4 陈请国,褚汉启,王显红,等.质膜钙ATP酶异构体2在新生大鼠螺旋神经节细胞中的表达[J].中华耳鼻咽喉头颈外科杂志,2010,45:128.
5 Chen QG,Mahendrasingam S,Tickle JA,et al.The development,distribution and density of the plasma membrane calcium ATPase 2 calcium pump in rat cochlear hair cells[J].Eur J Neurosci,2012,36:2302.
6 Jacobs RA,Hudspeth AJ.Ultrastructural correlates of mechanoelectrical transduction in hair cells of the bullfrog's internal ear[J].Cold Spring Harb Symp Quant Biol,1990,55:547.
7 Street VA,Mc Kee-Johnson JW,Fonseca RC,et al.Mutations in a plasma membrane Ca2+-ATPase gene cause deafness in deafwaddler mice[J].Nat Genet,1998,19:390.
8 Wood JD,Muchinsky SJ,Filoteo AG,et al.Low endolymph calcium concentrations in deafwaddler 2J mice suggest that PMCA2 contributes to endolymph calcium maintenance[J].J Assoc Res Otolaryngol,2004,5:99.
9 Ricci AJ,Crawford AC,Fettiplace R.Tonotopic variation in the conductance of the hair cell mechanotransducer channel[J].Neuron,2003,40:983.
10 Lelli A,Asai Y,Forge A,et al.Tonotopic gradient in the developmental acquisition of sensory transduction in outer hair cells of the mouse cochlea[J].J Neurophysiol,2009,101:2961.
11 Si F,Brodie H,Gillespie PG,et al.Developmental assembly of transduction apparatus in chick basilar papilla[J].J Neurosci,2003,23:10815.
12 Beurg M,Nam JH,Chen QG,et al.Calcium balance and mechanotransduction in rat cochlear hair cells[J].J Neurophysiol,2010,104:18.
13 Lumpkin EA,Hudspeth AJ.Regulation of free Ca2+concentration in hair-cell stereocilia[J].J Neurosci,1998,18:6300.
14 Yamoah EN,Lumpkin EA,Dumont RA,et al.Plasma membrane Ca2+-ATPase extrudes Ca2+from hair cell stereocilia[J].J Neurosci,1998,18:610.
(2015-10-08收稿)
(本文编辑 雷培香)
The Expression of Plasma Membrane Ca2+-ATPase lsoforms 1~3 in the Basilar Membrane of Neonatal Rat Cochlea
Chen Qingguo*,Chu Hanqi,Zhou Liangqiang,Chen Jin,Liu Yun,Luo Mi,Tao Yanling
(*Department of Otolaryngology-Head and Neck Surgery,Tongji Hospital,Tongji Medical College,Huazhong University of Science and Technology,Wuhan,430030,China)
Objective To study the expression of plasma membrane Ca2+-ATPase isoforms 1~3(PMCA 1~3)in the basilar membrane(BM)of the neonatal rat cochlea by Western blot.The PMCA2 content in single BM of the neonatal rat was also examined.Methods Four rats at postnatal 2 days(P2)and 8 days(P8)were respectively decapitated and their BMs were isolated.The total proteins of BMs were extracted.The 20μg total proteins were respectively loaded to the gel.The expression of PMCA1-3 was detected by Western blot.Likewise,3μg total proteins from P2 and P8 rat BM were loaded.The expression of PMCA2 was detected by Western blot.Four rats at P8 were decapitated and their BM was isolated.The 5μg,10μg and 20μg total proteins of P8 rat BM were added to the gel and 100 ng,400 ng and 800 ng bovine serum albumin(BSA)were also loaded as reference.After electrophoresis,the gel was separated into two parts.One part was used for SYPRO staining and the other part was used for PMCA2 detection by Western blot.Results In the 20μg BM total proteins of P2 and P8 rats,the expression of PMCA1 was weak(0.126±0.024,0.131±0.012,respectively),PMCA2 was strong(4.16±0.528,4.25±0.319,respectively),and PMCA3 was barely expressed(0).There was a statistical difference among PMCA1,PMCA2 and PMCA3(P<0.05).In the 3μg BM total proteins of P2 and P8 rats,the expression of PMCA2 in P8(4.571± 0.336)was higher than P2(3.622±0.285).There was a statistical difference(P<0.05).The PMCA2 content in the BM of a P8 rat was about 2.5 ng.Conclusion There was a different-level expression of PMCA1~3 in the neonatal rat BM with highest expression of PMCA2,which could be explained that cochlear hair cells had different requirements of Ca2+turning for these PMCA isoforms.
Plasma membrane Ca2+-ATPase isoform 1(PMCA1); Plasma membrane Ca2+-ATPase isoforms 2(PMCA2); Plasma membrane Ca2+-ATPase isoforms 3(PMCA3); Basilar membrane; Cochlea
10.3969/j.issn.1006-7299.2016.04.011
时间:2016-6-29 16:16
R339.16
A
1006-7299(2016)04-0366-05
△ 国家自然科学基金青年基金(81300827)资助
1 华中科技大学同济医学院附属同济医院耳鼻咽喉-头颈外科(武汉 430030); 2 湖北文理学院附属襄阳市中心医院耳鼻咽喉-头颈外科
陈请国,男,湖北人,主治医师,主要研究方向为听觉生理。
陶雁玲(Email:18907183041@163.com)
网络出版地址:http://www.cnki.net/kcms/detail/42.1391.R.20160629.1616.072.html

