混合培养基模式培养杂交瘤细胞表达单克隆抗体
黄亚杰,朱光凯,刘 珊,赵永强,谢 波,刘道军
(1.汕头大学 医学院,汕头 515041;2.中国科学院过程工程研究所 生化工程国家重点实验室,北京 100190)
混合培养基模式培养杂交瘤细胞表达单克隆抗体
黄亚杰1,2,朱光凯2,刘 珊2,赵永强2,谢 波2,刘道军1
(1.汕头大学 医学院,汕头 515041;2.中国科学院过程工程研究所 生化工程国家重点实验室,北京 100190)
采用混合培养基模式将杂交瘤细胞进行减血清悬浮驯化培养,通过优化提高单克隆抗体的表达量,并进行抗体的分离纯化。在杂交瘤细胞悬浮培养优化过程中,最终确定的血清浓度为2%胎牛血清,培养基配比为RPM1640:SFM4CHO:OptiCHO(4.5:4.5:1),接种密度为3×105cells/mL,采用批次补料流加培养,每2 d流加1次,每次流加量为初始体积的3%,抗体的表达量从原始的84 mg/L提高到168 mg/L。将其进一步在5 L搅拌式生物反应器中进行培养,离心后上清经protein A亲和层析纯化,确定抗体的产量为240 mg/L。
杂交瘤细胞培养;单克隆抗体;悬浮驯化;亲和层析
单克隆抗体具有特异性强、成分均一可控等优势,广泛应用于疾病治疗、医学诊断、生物免疫检测和蛋白纯化等领域[1-3]。虽然杂交瘤细胞表达的单抗鼠源性限制了鼠单抗药物的纵深发展,但作为分析诊断等用途仍占有相当大的市场,且其作为表面抗原的研究,蛋白的亲和纯化,组织相容性检测和放射免疫测定等方面的应用有着广阔的前景[4-5]。
随着动物细胞培养规模的扩大和单抗需求的增长,杂交瘤细胞的培养工艺和方法得到了不断地改进[6-7],包括培养基的优化[8-9],培养工艺的设计[10-11],纯化方法的选择等[12-13]。但是杂交瘤细胞的体外培养表达量仍普遍较低[14]。而且杂交瘤细胞的培养常用基础培养基加入高浓度(10%~20%)的血清[15-16],这样不但增加了杂交瘤细胞培养的成本,而且血清的存在提高了引入内毒素的风险,同时给下游的分离纯化带来很大困难[17]。杂交瘤细胞的无血清悬浮培养需要加入血清替代物,对细胞生长和抗体表达影响并不显著[18-20]。虽然对培养基成分进行优化可以改善杂交瘤细胞的生长和提高抗体表达量,但培养基一般由60~80种成分组成,繁琐的优化设计实验对杂交瘤细胞生长密度和表达量的提高空间有限[21-22]。
本研究在对杂交瘤细胞进行减血清悬浮驯化培养的同时,尝试采用了几种培养基混合培养的模式,对杂交瘤细胞培养和制备工艺进行了优化,以期提高杂交瘤细胞培养的密度和抗体产量。
1 材料与方法
1.1 材料与试剂
杂交瘤细胞(北京三元基因工程有限公司提供);RPMI1640(Gibco,RPMI1640TMbasic);SFM4CHO(HyClone,SFM4CHOTM);OptiCHO(Gibco,OptiCHOTM);Protein A(GE Healthcare,MabSelect SuReTM);FD004(中国科学院过程工程研究所生化工程国家重点实验室研制);Tris、Tris-HCl、NaCl、乙酸均为西陇化工股份有限公司,分析纯试剂;胎牛血清(天津康源生物技术有限公司);其他均为市售分析纯试剂。
1.2 实验仪器
5 L细胞反应器(Applikon Biotechnology,5 L ez-control);二氧化碳培养箱(Thermo Scientific,HERA CELL 240i);细胞计数仪(Invitrogen,CountessTMautomated cell counter);倒置显微镜(OPTEC,BDS200);低温高速离心机(Thermo Scientific,SORVALL Biofuge Stratos);常温低速离心机(上海安亭科学仪器厂,DL4000B);Protein Purify System (PPS,中国科学院过程工程研究所生化工程国家重点实验室);层析柱(上海华美实验仪器厂,BOMEXTM3.5×30 cm);酶标仪(Thermo Scientific,VARIOSKAN FLASH 3001)
1.3 实验方法
1.3.1 杂交瘤细胞减血清悬浮驯化培养
将细胞复苏后接种于T75方瓶中(3×105cells/mL的接种密度,培养液为含10%胎牛血清的RPMI1640,37℃,5%CO2饱和湿度的培养箱培养)。每2 d传代(细胞长满90%以上,胰酶消化细胞),细胞稳定后,减血清为8%,逐次培养和递减血清浓度至4%。此时从T75方瓶中取出生长期的细胞,1200 r/min离心4 min,弃去上清,分别培养于添加含有4 mmol/L Gln,4%胎牛血清的新鲜培养基RPM1640、SFM4CHO、OptiCHO、RPM1640:SFM4CHO(1:1)、RPM1640:OptiCHO(1:1) 、RPM1640:SFM4CHO:OptiCHO(3:4:3)、RPM1640:SFM4CHO:OptiCHO (4.5:4.5:1)。以40 mL培养体积,3×105cells/mL的接种密度接种于125 mL摇瓶中,放置于5% CO2饱和湿度的培养摇床中,37℃,125 r/min转速培养。每隔2 d换液传代,细胞稳定后,减血清为2%。
1.3.2 杂交瘤细胞培养工艺的研究
1)细胞接种密度考察。
采用不同接种密度考察其对杂交瘤细胞生长及抗体表达的影响。将不同密度0.3×106、0.5×106、0.8×106和1×106cells/mL细胞接种于125 mL的摇瓶中(基础培养基为4 mmol/L Gln,2% FBS的RPMI1640:SFM4CHO(1:1)40 mL,125 r/min转速,37℃,5% CO2饱和湿度的培养摇床培养)。流加培养基FD004,每次流加液体积为初始体积的5%,流加2次,分别于第3天,第6天流加。每天检测细胞密度和活率,培养结束留样测定抗体含量。
2)细胞培养过程中混合培养基的配比。
通过不同培养基的配比筛选,考察不同培养基对杂交瘤细胞生长与抗体表达的影响。将杂交瘤细胞以0.3×106cells/mL的接种密度接种于125 mL摇瓶中(125 r/min转速,37oC,5% CO2饱和湿度的培养摇床培养)。流加培养基FD004,每次流加液体积为初始体积的5%,流加2次,分别于第3天,第6天流加。基础培养基分别为含4 mmol/L Gln,2%FBS的RPM1640、SFM4CHO、OptiCHO、RPM1640:SFM4CHO(1:1)、RPM1640:OptiCHO(1:1) 、RPM1640:SFM4CHO:OptiCHO(3:4:3)、RPM1640:SFM4CHO:OptiCHO (4.5:4.5:1)各40 mL。每天检测细胞密度和活率,培养结束留样测定抗体含量。
3)细胞培养过程中流加量与流加时间的确定。
杂交瘤细胞以40 mL含4 mmol/L Gln,2%FBS的RPMI1640:SFM4CHO:OptiCHO(4.5:4.5:1)为基础培养基,0.3×106cells/mL的接种密度接种于125 mL摇瓶中(125 r/min转速,37℃,5% CO2饱和湿度的培养摇床培养)。以FD004为流加液,采用表1中3种流加方案。每天检测细胞密度和活率,培养结束留样测定抗体含量。

表1 细胞培养流加方案
4)杂交瘤细胞培养反应器工艺的探索。

1.3.3 细胞培养上清液亲和层析纯化工艺的确定
1)洗脱pH值的筛选。
将冻存上清液在37℃水浴中解冻,加入2 mol/L NaCl;采用的柱子填料为Mab Select Sure (GE healthcare),体积为200 mL,平衡液(2 mol/L NaCl,25 mmol/L Tris(Tris 0.73 g/L;Tris-HCl 2.98 g/L),pH 7.7)平衡2个柱体积(CV 50 mL),流速6 mL/min;上样500 mL,流速5 mL/min;平衡液作为淋洗液,淋洗2个柱体积,流速6 mL/min;洗脱液(不同pH 3.0、3.5、4.0的醋酸溶液),收集洗脱峰;用1 mol/L Tris中和目的蛋白浓缩液至pH 6.0;平衡液作为冲洗液,冲洗2个柱体积,流速6 mL/min;纯水冲洗2个柱体积,流速6 mL/min,20%乙醇冲洗2个柱体积,4℃保存。

表2 反应器工艺参数
2)平衡缓冲液中盐浓度的考察。
在筛选出的pH值条件下考察含1 mol/L和2 mol/L NaCl上清液和平衡液对纯化效果的影响。纯化步骤同上。
1.3.4 检测方法
1)细胞计数。
取10 μL细胞样品,加入10 μL 0.4%台盼蓝染液染色,吹打混匀,用移液枪吸取10 μL,打入一次性细胞计数板中,在细胞计数仪中计细胞密度与活率。
2)抗体浓度检测。
样品上清中的抗体浓度采用酶联免疫吸附法(ELISA)测定。首先将抗原吸附在96孔板上,然后添加抗体标准品和待测样品分别与抗原结合,最后添加荧光标记的二抗,通过显色剂显色,用酶标仪D450 nm做出标准曲线,通过计算得出上清中的抗体浓度。
2 结果与分析
2.1 杂交瘤细胞减血清悬浮驯化培养
杂交瘤细胞是非贴壁依赖性细胞,在有细胞贴壁因子存在的条件下,可以贴在方瓶瓶壁之上,但细胞胞体呈圆球形,故杂交瘤细胞在有血清存在下会贴壁生长,因为血清中含有贴壁因子,随着血清浓度的降低,在4%血清时开始出现悬浮细胞。随着血清浓度减至2%以下时,细胞的生长状态变差。细胞的最大密度降低,维持周期变短。故最终考虑保留血清浓度在2%。细胞稳定传代后,细胞清亮透明,形状规整,基本无死细胞的存在。
2.2 杂交瘤细胞培养工艺的研究
2.2.1 细胞接种密度的考察
以0.3×106、0.5×106、0.8×106和1×106cells/mL 4种不同的接种密度接种细胞于125 mL摇瓶培养8 d。图1为不同接种密度下细胞的生长情况,结果可知,以0.3×106cells/mL、0.8×106cells/mL获得的最高活细胞密度达到2.0×106cells/mL高于其他两种接种密度的获得的最高活细胞密度;以0.3×106cells/mL接种的细胞在第6天达到最高活细胞密度,细胞活率第7天维持在70%,以0.8×106cells/mL接种的细胞在第3天达到最高活细胞密度,细胞活率在第6天下降至60%。图2总结了不同接种密度下活细胞密度对时间的累积积分值(IVCC)和最终获得的抗体含量值,4种不同接种密度下以0.3×106cells/mL、0.8×106cells/mL的IVCC值最高为11.7×106/mL·d和11.95×106/mL·d,而以0.3×106cells/mL接种的细胞最终获得抗体含量最高为78.83 mg/L,而其他3种情况抗体产量相当。
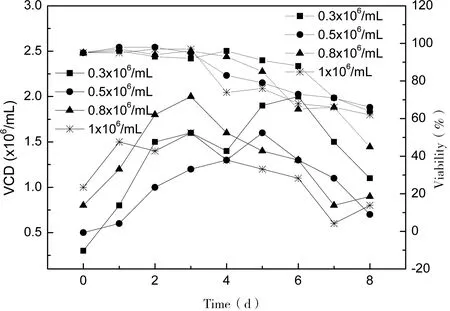
图1 不同接种密度的细胞生长曲线
Note: Solid line-VCD; Short dot line-Viability
2.2.2 细胞培养过程中混合培养基的配比选择
图3为不同培养基条件下细胞的生长情况,对比1(RPM1640)、2(SFM4CHO)、3(OptiCHO)、4(RPM1640+SFM4CHO)、5(RPM1640+OptiCHO)、6[RPM1640:SFM4CHO:OptiCHO(3:4:3)]、7[RPM1640:SFM4CHO:OptiCHO(4.5:4.5:1)]等7种基础培养基,单一培养基(除OptiCHO培养基外)与混合培养基相比,混合培养基可以达到更高的细胞生长密度;细胞生长周期维持更长时间。其中混合培养基RPM1640:SFM4CHO:OptiCHO(4.5:4.5:1)的最高活细胞密度为3.4×106cells/mL。虽然单一OptiCHO培养基的最高活细胞密度与RPM1640:SFM4CHO:OptiCHO(4.5:4.5:1)混合培养基相当,但其活细胞密度对时间的累积积分值(IVCC)和最终获得的抗体表达量相对于混合培养基较低(图4),OptiCHO培养基的IVCC值和抗体表达量分别为15.42×106/mL·d和114.31 mg/L,而RPM1640+OptiCHO、RPM1640:SFM4CHO:OptiCHO(3:4:3)、RPM1640:SFM4CHO:OptiCHO(4.5:4.5:1)等混合培养基的抗体表达量相当,依次为127.21 mg/L、124.57 mg/L和127.78 mg/L,综合考虑单一OptiCHO培养基的成本较高,因此选择RPM1640:SFM4CHO:OptiCHO(4.5:4.5:1)混合培养基更为经济、合理。

图2 不同接种密度条件下活细胞密度对时间的积分和抗体表达量
Note: Solid line-IVCC; Bar graph-Titer
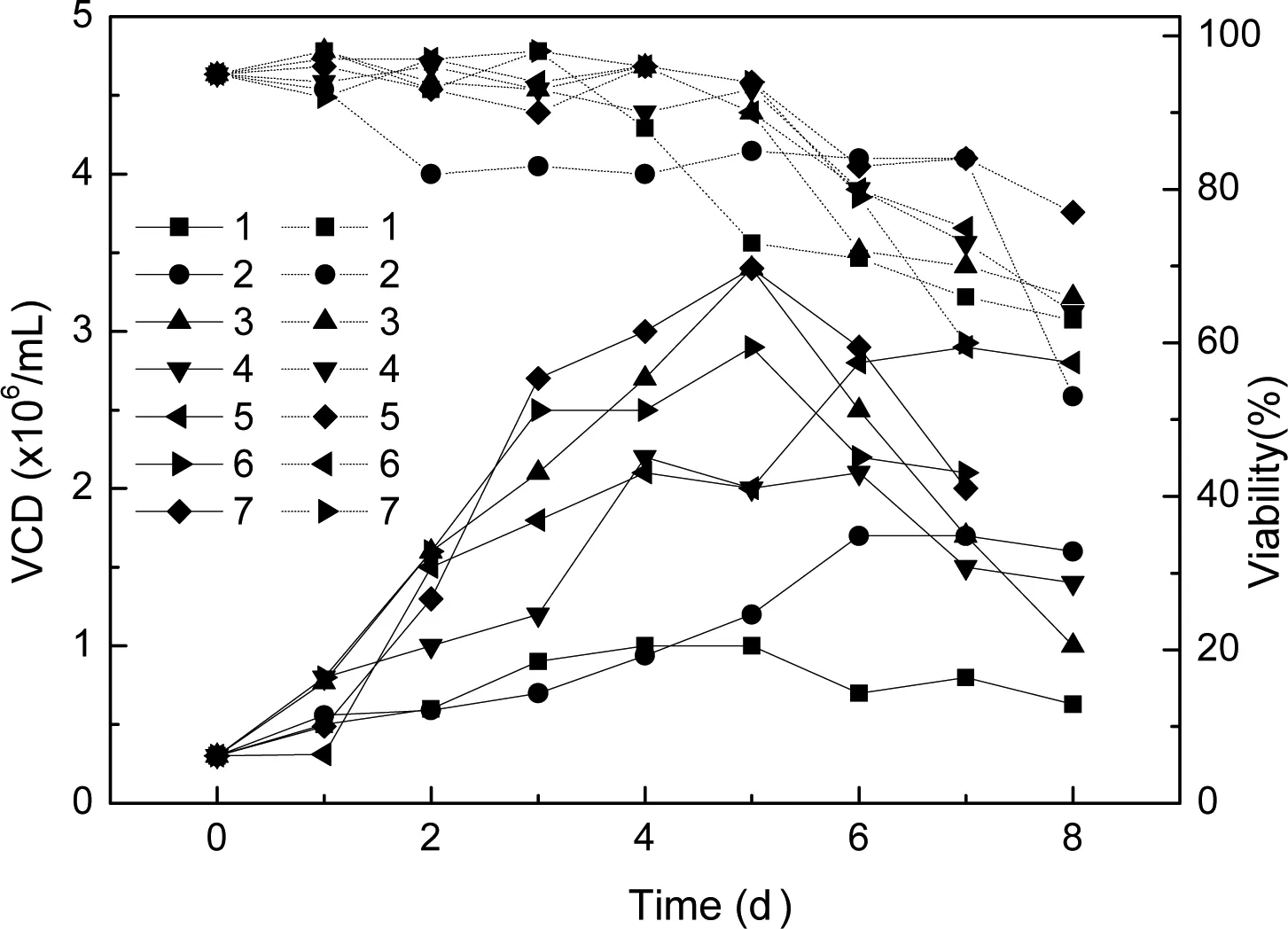
图3 不同培养基的细胞生长曲线
Note: Solid line-VCD; Short dot line-Viability;1:RPM1640;2:SFM4CHO;3:OptiCHO;4:RPM1640:SFM4CHO(1:1);5:RPM1640:OptiCHO(1:1);6:RPM1640:SFM4CHO:OptiCHO(3:4:3);7:RPM1640:SFM4CHO:OptiCHO(4.5:4.5:1)
2.2.3 批次补料流加培养工艺的优化
批次补料流加培养是动物细胞培养中通常采用的培养工艺,采用的流加液流加量、流加次数和时间是流加工艺中的重要参数。为了确立杂交瘤细胞较优的流加时间和流加量,考察了3种流加方案下,杂交瘤细胞的生长和抗体表达量情况。
从图5的细胞生长曲线可知,3种流加方案细胞达到的最高活细胞密度依次是4.1×106、3.7×106和3.5×106cells/mL。但方案1细胞活率维持较高水平时间较短,可能是较少的补料量导致杂交瘤细胞的营养不足以维持细胞生长。图6所示为3种方案下细胞的IVCC值和最终获得的抗体表达量。3种流加方案的表达量依次为122.62、168.21和145.77 mg/L。方案2可以得到比其他两种方案更高的抗体表达量。所以最终选择方案2作为杂交瘤细胞的批次补料流加培养模式。
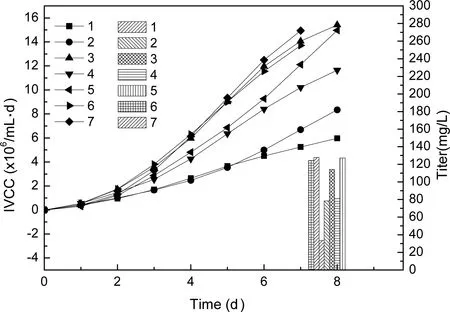
图4 不同培养基时活细胞密度对时间的积分和抗体表达量
Note: Solid line-IVCC; Bar graph-Titer;1:RPM1640;2:SFM4CHO;3:OptiCHO;4:RPM1640:SFM4CHO(1:1);5:RPM1640:OptiCHO(1:1);6:RPM1640:SFM4CHO:OptiCHO(3:4:3);7:RPM1640:SFM4CHO:OptiCHO(4.5:4.5:1)

图5 不同流加时间的细胞生长曲线
Note: Solid line-VCD; Short dot line-Viability
2.2.4 杂交瘤细胞培养反应器工艺的确定
根据杂交瘤细胞培养前期摇瓶实验结果进行了5L反应器工艺研究,以确定稳定的杂交瘤细胞培养工艺。通过前期摇瓶实验结果确定反应器上罐的接种密度为0.3×106cells/mL,培养基为含2%血清的RPM1640:SFM4CHO:OptiCHO(4.5:4.5:1),流加方案为2、4、6隔天流加,每次流加量为总体积的3%。由于反应器中能更好地控制细胞培养的溶氧、温度和pH值,5L反应器中细胞最高活细胞密度可达到5.1×106cells/mL,明显高于摇瓶实验结果,培养第9天细胞活率大于70%(图7),IVCC值和最终抗体表达量分别为30.07×106/mL·d,240mg/L(图8),反应器培养过程中乳酸和铵根离子的含量维持在很低水平。
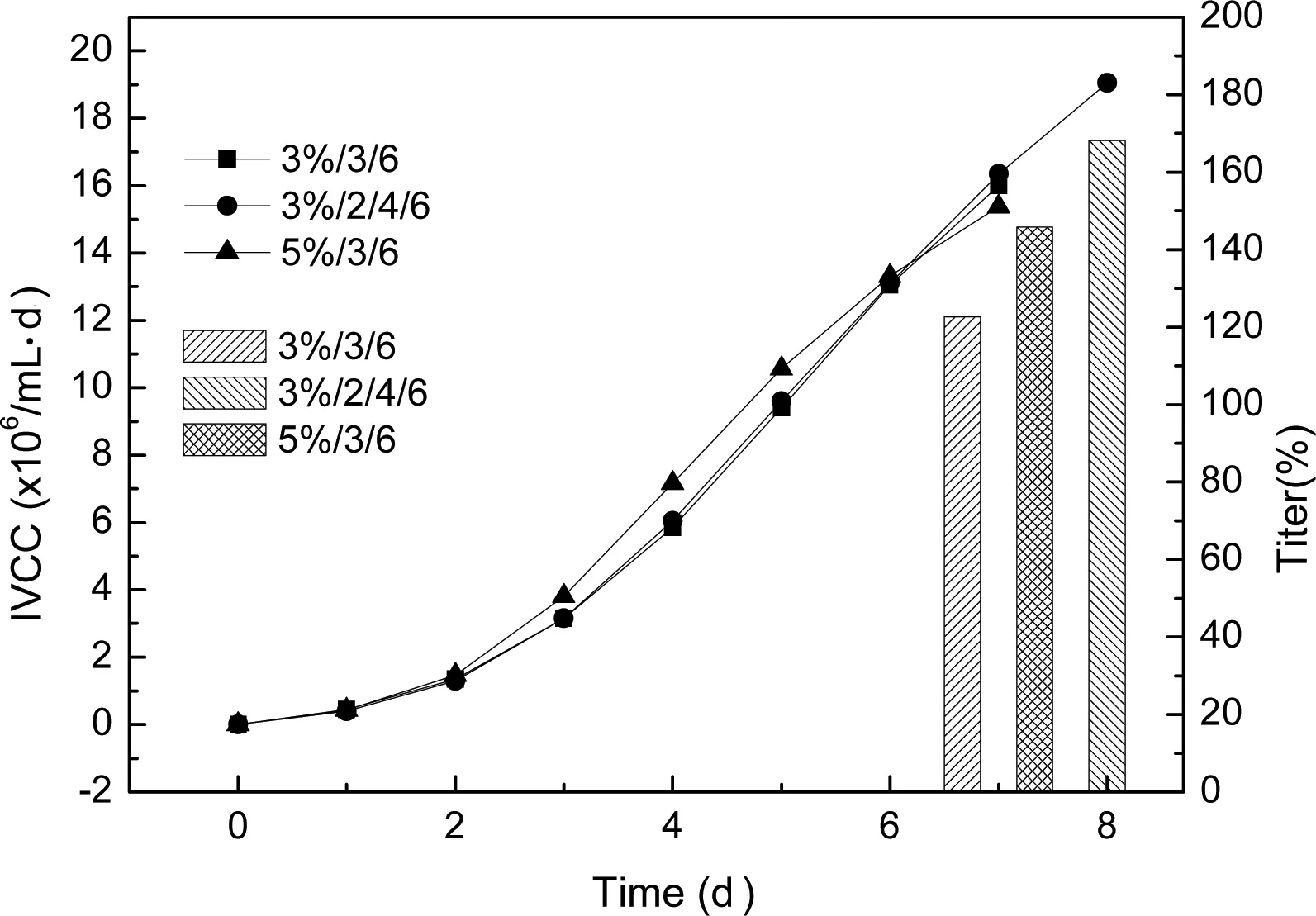
图6 不同流加方案时活细胞密度对时间的积分和抗体表达量
Note: Solid line-IVCC; Bar graph-Titer

图7 5L细胞培养反应器中细胞生长曲线
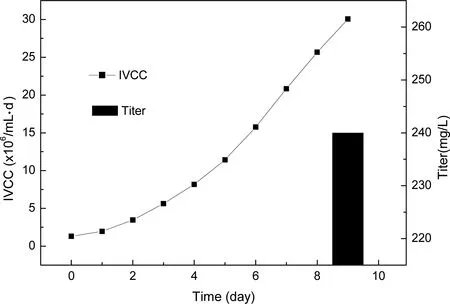
图8 细胞培养反应器中活细胞密度对时间的积分和抗体表达量
2.2.5 抗体亲和层析纯化工艺的确定
盐浓度和洗脱pH值是影响抗体亲和纯化的两个重要参数。其中,在低盐浓度下杂交瘤抗体与Protein A的结合活性较低,故考察含有1、2 mol/L NaCl上清液和平衡液条件下对纯化效果的影响。同时考察了不同pH值的洗脱液(pH 3.0、3.5、4.0)对最终洗脱效果的影响。在含2 mol/L NaCl的上清和平衡缓冲液时,在洗脱液pH 3.0、3.5时洗出的蛋白出现浑浊,离心之后,经紫外吸收法测得细胞上清抗体浓度分别为97 mg/L,128 mg/L,而pH 4.0的洗脱液洗脱后测得的抗体浓度为224 mg/L(上样细胞上清抗体浓度为240 mg/L)。洗脱液在pH 4.0,抗体回收率明显高于pH 3.0和3.5,因此选择洗脱液pH 4.0。
在筛选出的pH值条件下考察含1 mol/L NaCl的上清和平衡液对抗体纯化的影响。最后洗出的细胞上清抗体浓度为188 mg/L。含1 mol/L NaCl上清和平衡液比含2 mol/L NaCl上清和平衡液损失更多的抗体蛋白,故最终选择洗脱液pH 4.0,2 mol/L NaCl上清和平衡液作为杂交瘤细胞单克隆抗体的亲和层析条件。
3 讨论与结论
影响杂交瘤细胞表达抗体的因素很多,其中培养基和培养条件是其中的两个主要因素。虽然通过对培养基组成成分进行综合改进的方法[14]可以有效地提高杂交瘤细胞的生长和抗体表达量,但此方法繁琐,工作量大,而本研究中通过培养基混合的方式不但提高了杂交瘤细胞的生长和抗体表达量,而且方法简单,经济、易于实现。虽然杂交瘤细胞无血清培养可以减少一定成本,但在提高细胞生长和抗体产量方面空间有限,而且改变细胞的生长代谢状况[23],本研究中通过减血清培养不但提高了杂交瘤细胞的最高生长密度和抗体表达量,而且生物反应器中细胞代谢产生的乳酸和铵离子很低,这对于延长杂交瘤细胞的培养周期十分重要。同时,优化抗体纯化的洗脱缓冲液盐浓度和pH值[24],这对于杂交瘤细胞生产单克隆抗体都会提供很好的借鉴和帮助。
综上所述,本研究以杂交瘤细胞作为单克隆抗体表达细胞,通过培养基筛选、优化细胞培养和分离纯化工艺,提高抗体表达量,得出如下结论:
1)确定了杂交瘤细胞培养的接种密度为0.3×106cells/mL,采用的混合培养基为含2%血清的RPM1640:SFM4CHO:OptiCHO(4.5:4.5:1)的培养基。
2)采用的流加培养工艺为细胞培养的第2、4、6天流加,每次3%(初始体积)的流加量可以得到较高的细胞表达量。
3)经过摇瓶培养优化,最高细胞培养密度从2.2×106cells/mL提高到4.1×106cells/mL,抗体的表达量从84 mg/L提高到168 mg/L。
4)5 L生物反应器的实验结果显示,细胞最终抗体浓度可达到240 mg/mL,较摇瓶产量有所提高。
5)采用的亲和分离纯化工艺为洗脱液pH 4.0,上清和平衡液中加入2 mol/L NaCl。
[1]KOHLER G,MILSTEIN C.Continuous cultures of fused cells secreting antibody of predefined specificity.1975 [J].Biotechnology,1992,24:524-526.
[2]DICKSON A J.Enhancement of production of protein biopharmaceuticals by mammalian cell cultures: the metabolomics perspective [J].Curr Opin Biotechnol,2014,30: 73-79.
[3]WALSH G.Biopharmaceutical benchmarks 2014 [J].Nat Biotechnol,2014,32(10): 992-1000.
[4]AVERBUCH S,GREEN G,NOVOTNY J.The challenges of drug-diagnostic (Rx-Dx) co-development: a biopharmaceutical perspective [J].Ann Oncol,2012,23: 6-7.
[5]GLUKHOVA X A,PRUSAKOVA O V,TRIZNA J A,et al.Updates on the production of therapeutic antibodies using human hybridoma technique [J].Curr Pharm Des,2016,22(7): 870-878.
[6]ZALAI D,GOLABGIR A,WECHSELBERGER P,et al.Advanced development strategies for biopharmaceutical cell culture processes [J].Curr Pharm Biotechno,2015,16(11): 983-1001.
[7]谢 波,李栾峰,杜春玲,等.利用新型一次性激流灌注式生物反应器培养动物细胞 [J].过程工程学报,2011,11(6): 1050-1054.
[8]ZHANG L,SHEN H,ZHANG Y X.Fed-batch culture of hybridoma cells in serum-free medium using an optimized feeding strategy [J].J Chem Technol Biotechnol,2004,79(2): 171-181.
[9]HENCSEY Z,FIZIL A,INZELT-KOV CS M,et al.Effect of medium composition on hybridoma growth and antibody production [J].Acta Microbiol Immunol Hung,1996,43(4): 359-370.
[10]DEWASME L,FERNANDES S,AMRIBT Z,et al.State estimation and predictive control of fed-batch cultures of hybridoma cells [J].J Process Contr,2015,30: 50-57.
[11]CASABLANCAS A,GAMEZ X,LECINA M,et al.Comparison of control strategies for fed-batch culture of hybridoma cells based on on-line monitoring of oxygen uptake rate,optical cell density and glucose concentration [J].J Chem Technol Biot,2013,88(9): 1680-1689.
[12]JIANG Y,LI F,ZHA D,et al.Purification process development of a recombinant monoclonal antibody expressed in glycoengineered pichia pastoris [J].Protein Expres Purif,2011,76(1): 7-14.
[13]VOGEL J H,NGUYEN H,GIOVANNINI R,et al.A new large‐scale manufacturing platform for complex biopharmaceuticals [J].Biotechnol Bioeng,2012,109(12): 3049-3058.
[14]SEN S,Roychoudhury P K.Development of optimal medium for production of commercially important monoclonal antibody 520C9 by hybridoma cell [J].Cytotechnology,2013,65 (2): 233-252.
[15]SEN S,ROYCHOUDHURY P K.Step-up/step-down perfusion approach for increased mab 520C9 production by a hybridoma cell line [J].Biotechnol Lett,2013,35(2): 153-163.
[16]KAMTHAN S,GOMES J,ROYCHOUDHURY P K.Production of monoclonal antibodies for breast cancer by HB8696 hybridoma cells using novel perfusion system [J].Enzyme Microb Tech,2014,64: 44-51.
[17]EVEN M S,SANDUSKY C B,BAMARD N D.Serum-free hybridoma culture ethical,scientific and safety considerations [J].Trends Biotechnol,2006,24(3): 105-108.
[18]RADFORD K,NILOPERBOWO W,REID S,et al.Weaning of three hybridoma cell lines to serum free low protein medium[J].Cytotechnology,1991,6(1): 65-78.
[19]林福玉,陈昭烈,刘 红,等.大规模动物细胞培养的问题及对策 [J].生物技术通报,1999(1): 32-35.
[20]GONG X,LI D,LI X,et al.Fed-batch culture optimization of a growth-associated hybridoma cell line in chemically defined protein-free media[J].Cytotechnology,2006,52(1): 25-38.
[21]HEINRICH C,BECKMANN T F,KLAUSING S,et al.Introducing a new chemically defined medium and feed for hybridoma cell lines[J].BMC Proceedings,2013,7(s6): 82-83.
[22]BARNES D,SATO G.Serum-free cell culture: a unifying approach [J].Cell,1980,22(3): 649-655.
[23]SHIBUYA K,HAGA R,NAMBA M.A serum substitute for fed-batch culture of hybridoma cells[J].Cytotechnology,2008,57: 187-197.
[24]FAHRNER R L,KNUDSEN H L.BASEY,BASEY C D,et al.Industrial purification of pharmaceutical antibodies: development,operation,and validation of chromatography processes[J].Biotechnol Genet Eng Rev,2001,18: 301-327.
Monoclonal antibodies production by hybridoma cellculture based on mixed medium model
HUANG Ya-jie1,2,ZHU Guang-kai2,LIU Shan2,ZHAO Yong-qiang2,XIE Bo2,LIUDao-jun1
(1.Medical College,Shantou University,Shantou 515041; 2.National Key Laboratory of BiochemicalEngineering,Institute of Process Engineering,Chinese Academy of Science,Beijing 100190,China )
In this study,hybridoma cell was adapted to the mixed medium containing less fetal bovine serum through suspension domestication,and the antibody concentration increased largely.The components of mixed medium were RPM1640:SFM4CHO:OptiCHO(4.5:4.5:1) with 2% FBS and the fed-batch fermentation process was carried out,in which the initial inoculation concentration was 3×105cells/mL,and 3% (initial volume) chemical-defined feed medium was added every other day during cultivation.The antibody concentration increased to 168 mg/L from 84 mg/L.The hybridoma cells were further cultured in a 5 L stirred-bioreactor,and the products were purified by protein A affinity chromatography and the purified antibody concentration was 240 mg/L.
hybridoma cell culture; monoclonal antibody; suspension domestication; affinity chromatography
2016-02-26;
2016-03-10
收稿日期:国家863课题资助(2012AA02A406)
黄亚杰,硕士,研究方向生物制药,E-mail: 1848836411@qq.com
谢 波,博士,研究方向生物制药,E-mail: bxie@ipe.ac.cn;刘道军,研究员,研究方向生物医用高分子材料,E-mail: liudj@stu.edu.cn
10.3969/j.issn.2095-1736.2016.06.104
R392
B
2095-1736(2016)06-0104-06

