鸭疫里默氏杆菌TbdR1表位抗原免疫原性研究
罗雅莉,黄 春,李 沛,孔庆科
(四川农业大学 动物医学院预防兽医研究所,成都 611130 )
鸭疫里默氏杆菌TbdR1表位抗原免疫原性研究
罗雅莉,黄 春,李 沛,孔庆科
(四川农业大学 动物医学院预防兽医研究所,成都 611130 )
TbdR1(TonB-dependent receptor 1)是鸭疫里默氏杆菌(Riemerellaanatipestifer,RA)血清1、2 和10型中的一个很好的交叉免疫原性抗原。通过生物信息学分析,分段表达TbdR1的表位抗原,并对其免疫原性进行初步探究。结果表明,分段后的表位抗原对雏鸭均具有一定的保护力,这为深入研究鸭疫里默氏杆菌亚单位疫苗奠定了基础。
鸭疫里默氏杆菌;TonB依赖性受体;免疫原性
鸭疫里默氏杆菌是危害禽类的一类重要的致病菌,呈世界性流行趋势,该菌主要危害雏鸭、鹅和火鸡,它可导致感染的动物大量死亡,耐过动物饲料转化率低,并且生长迟缓,从而造成严重的经济损失[1-3]。TonB依赖性受体主要存在于革兰氏阴性菌外膜,是一群活跃在外膜的转运蛋白家族[4],其主要生物功能是协助细菌吸收铁离子和帮助锰、镍、VB12、碳水化合物等营养物质的运输[5]。晶体结构分析显示TonB依赖性受体是一类保守性蛋白,主要由两种亚基即塞子结构域和β 桶结构域构成[6]。外膜上的TonB依赖性受体与铁或者是铁载体结合后,再与配体TonB 相结合,通过构型的改变来通过细胞的通道进入到细胞内,此过程的能量由TonB 复合体供给[7-9]。在对病原菌的研究过程中发现,TbdR1除具有转运功能外,其还参与Fe的获取和宿主感染,是一个潜在的毒力因子,并且在鸭疫里默氏杆菌血清型1、2和10型中具有交叉免疫原性[10-13],因此推测其有可能诱导机体产生交叉免疫保护,而这正是灭活苗的不足之处。
通过生物信息学分析发现TbdR1表位抗原主要集中于两个区域,因此将其分别进行克隆表达和纯化,并以纯化蛋白作为抗原免疫雏鸭,研究其所能引起的免疫保护率。本研究最终发现表位抗原作为亚单位疫苗能起到一定的免疫保护,这为深入研究鸭疫里默氏杆菌亚单位疫苗奠定了基础。
1 材料与方法
1.1 材料
1.1.1 试验菌株和质粒
鸭疫里默氏杆菌 CH-1株,大肠杆菌 DH5α、Rosetta,质粒 pET-32a等均由本实验室保存。
1.1.2 试验动物
雏鸭购自雅安某鸭场。
1.1.3 主要试剂
质粒小提试剂盒、DNA纯化回收试剂盒购自TIANGEN公司;PrimeStar DNA聚合酶、Solution I购自Takara公司;NdeI、BamH I限制性内切酶购自NEB公司;异丙基硫代半乳糖苷(IPTG)购自Solarbio公司;亲和层析柱(HisTrap)购自GE公司;BCA 蛋白定量试剂盒购自Thermo公司;HRP标记的山羊抗鸭IgG购自KPL公司;商品化灭活疫苗浆利佳(主要成分为血清I型鸭疫里默氏杆菌)购自成都天邦生物制品有限公司。
1.1.4 生物信息学分析软件
用NCBI 的BLAST 和 Expert Protein Analysis System 分析其理化性质和氨基酸组成,蛋白的结构域用 NCBI 的 conserved domain search program 分析,蛋白质大小及等电点预测利用 DNASTAR 中的 EditSeq 分析,Protparam软件分析蛋白质的疏水性/亲水性,BepiPred1.0bServer进行蛋白质抗原表位解析,亚细胞定位通过 PSORTb v.3.0 分析。
1.2 方法
1.2.1 序列分析
通过BLAST分析,查找到RA CH-1株与DSM15868株的tbdR1相似的序列(gi: 403312028),将此序列进行生物信息分析,根据抗原表位解析结果将此序列分成两部分:J1(AA24-394)和J2(AA433-887)。
1.2.2 引物的设计与合成
根据序列分析结果,选择优势抗原表位集中区域设计特异性引物,如表1所示。引物合成由华大基因完成。
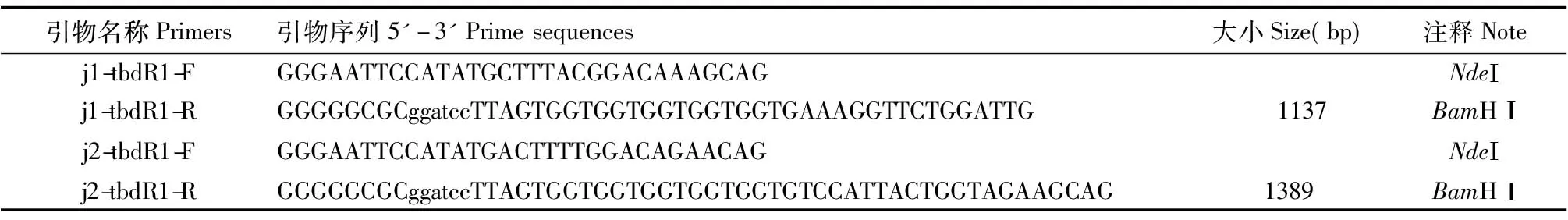
表1 实验所用引物
1.2.3 表达载体的构建
以RA CH-1株基因组为模板,利用设计的特异性引物,分别扩增j1-tbdR1和j2-tbdR1基因片段。反应体系参照Premier star酶说明书,PCR扩增条件:98℃预变性2 min;98℃变性10 s,55 ℃退火15 s,72℃延伸10 s,共30个循环;72 ℃最终延伸10 min。扩增产物经1%琼脂糖凝胶电泳检测后,符合预期大小的产物利用DNA纯化回收试剂盒回收。回收产物和载体质粒经相同酶切(NdeI 和BamH I)后。回收片段和质粒经16 ℃连接后转入DH5α。经氨苄青霉素初筛和PCR鉴定后,获得阳性克隆,并送成都擎科技术有限公司测序鉴定。
1.2.4 重组蛋白的表达和纯化
提取鉴定正确的质粒并转入Rosetta进行表达,经终浓度为1mmol/L异丙基-β-D-硫代半乳糖苷(IPTG)诱导3 h后收集菌液。利用SDS-PAGE检测分析。大量蛋白纯化利用GE公司的镍柱进行层析纯化,操作步骤按照GE公司产品说明书进行。洗脱下来的蛋白经SDS-PAGE检测分析,并用BCA试剂盒定量(参照说明书进行)。
1.2.5 RA CH-1全菌血清的制备
以109CFU的RA CH-1通过腹腔免疫7日龄雏鸭,共免疫3次,每次免疫间隔2周,最后一次免疫10 d后收集血清并测定抗体滴度,-20℃保存并用于随后Western blot分析。
1.2.6 Western blot分析
Western blot分析按如下方法进行:以纯化蛋白为检测对象经SDS-PAGE电泳后,电转移至PVDF膜上,5%脱脂奶粉室温封闭1h,一抗为制备的全菌血清(1:500稀释),二抗为 HRP标记的山羊抗鸭IgG(1:5000稀释),最后加入显色底物,显色2 min后加入终止液停止显色。
1.2.7 免疫保护试验
动物实验共分为6组,包括3个实验组(J1-TbdR1免疫组、J2-TbdR1免疫组和J1-TbdR1、J2-TbdR1共免疫组),一个商品苗免疫组作免疫程序对照,一个未免疫组作攻毒模型对照,一个空白组作空白对照。纯化蛋白经弗氏完全佐剂乳化后以皮下免疫方式免疫2日龄雏鸭,免疫剂量为0.2 mg/只,每组10只,血清一型是西南地区养鸭业爆发传染性浆膜炎的主要流行性血清型之一[14],因此免疫18 d后用RA CH-1 以10倍LD50剂量(1×109CFU/100 μL),以大腿肌肉注射方式攻毒。未免疫组注射相同剂量的生理盐水。观察记录攻毒后10 d内雏鸭死亡情况,利用GraphPad Prism 软件进行数据处理和分析。
2 结果
2.1 序列分析
分析结果表明TbdR1含有913个氨基酸,预测蛋白大小约为100.5 ku,等电点9.18,整条多肽链表现为亲水性,预测该蛋白有OM channels superfamily 和TonB-hemlactrns两个保守区,亚细胞定位预测分析显示该蛋白位于细菌的外膜。
2.2 截断表位抗原的扩增及表达载体构建
片段1、2分别为1137 bp和1389 bp,PCR产物在1200 bp左右有明显的条带,符合预期,如图1-A所示。将构建好的质粒经PCR鉴定(图1-B、C),与预期相符;测序鉴定与GenBank公布一致,证明重组质粒构建成功。

图1 tbdR1-J1的扩增产物和重组质粒PCR鉴定电泳
A:The PCR production of j1-tbdR1 and j2-tbdR1(1: j1-tbdR1;2:j2-tbdR1)。B:Identification of recombinant plasmid pET-J1-TbdR1 by PCR(1 and 3: pET-J1-TbdR1)。 C:Identification of recombinant plasmid pET-J2-TbdR1 by PCR(1 and 2: pET-J2-TbdR1.M:Marker DL2000)
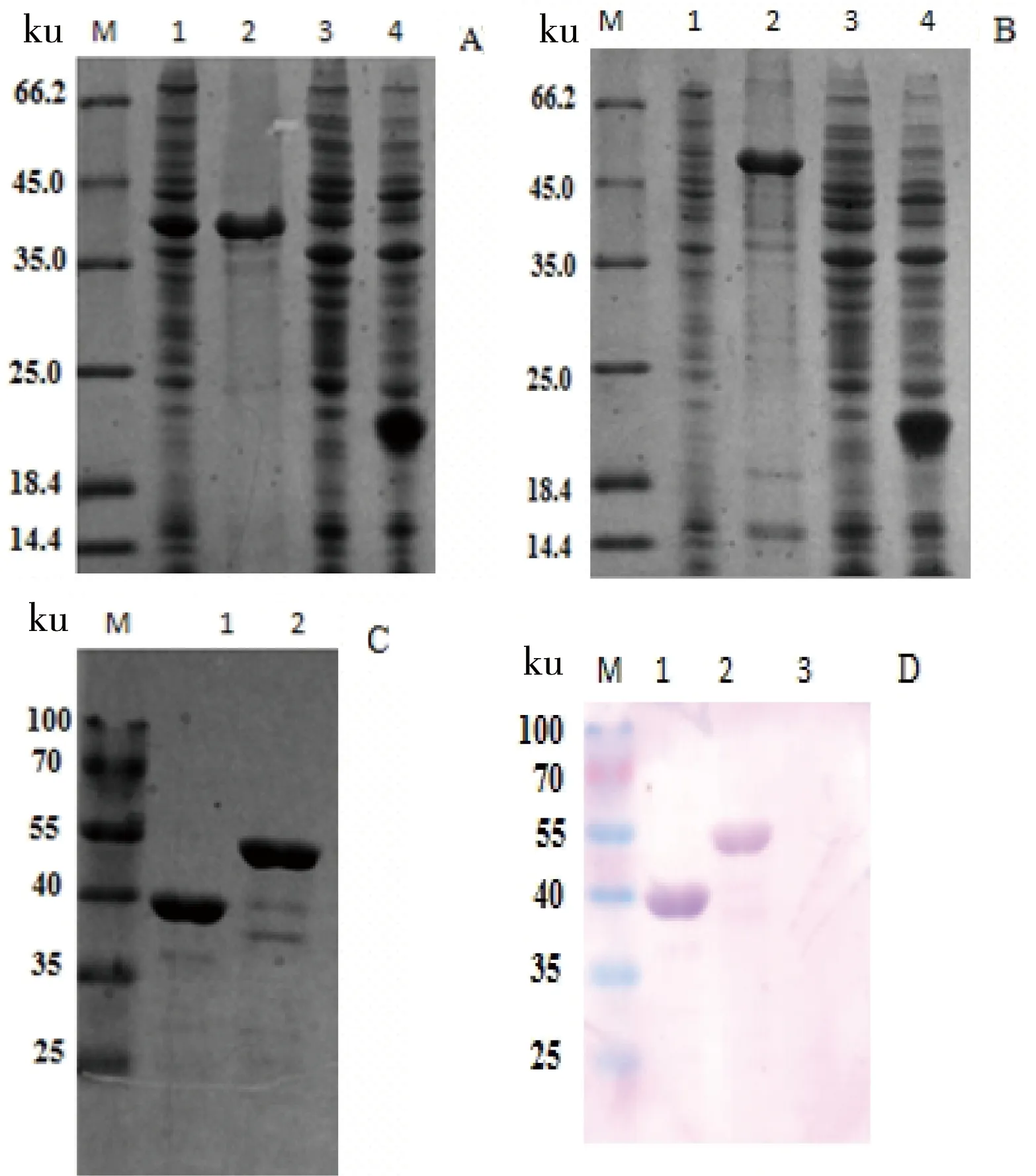
图2 重组蛋白的诱导表达(A/B)和纯化(C)以及特异性检测(D)
A: 1:The total proteins of induced Rosetta pET-J1-TbdR1; 2: The precipitate of induced Rosetta pET-J1-TbdR1; 3: The total proteins of uninduced Rosetta pET-J1-TbdR1; 4: The total proteins of induced Rosetta pET32a。B:1: The supernatant of induced Rosetta pET-J2-TbdR1; 2: The precipitate of induced Rosetta pET-J2-TbdR1; 3: The total proteins of uninduced Rosetta pET-J2-TbdR1; 4: The total proteins of induced Rosetta pET32a。C: 1:The purifed fusion protein J1; 2:The purifed fusion protein J2。 D:1:The purifed fusion protein J1; 2:The purifed fusion protein J2; 3: Negative control;M:Protein maker
2.3 截断抗原的表达及纯化
重组质粒在Rosetta中经1mmol/L IPTG大量诱导表达后,利用镍柱层析纯化,纯化蛋白经SDS-PAGE电泳检测,结果表明纯化蛋白在35~45 ku和45~66.2 ku之间,分别与J1(41.5 ku)J2(51.3 ku)对应如图2所示。
2.4 Western blot分析
Western blot分析表明,在35~55 ku处分别有蛋白特异带,证明纯化的融合蛋白能与抗RA CH-1全菌血清特异性结合且特异性强。
2.5 免疫保护
动物实验结果如表3及图3所示。实验组中,共免疫组致死率最低,其次是第4组和第3组,致死率较高。
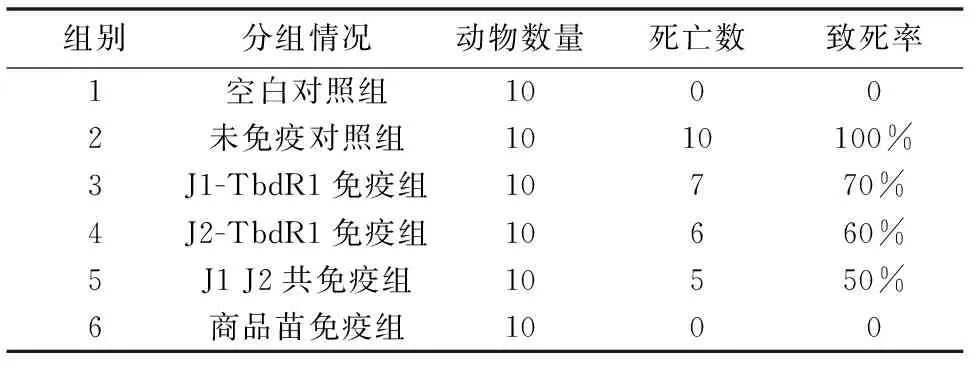
表3 动物攻毒实验结果
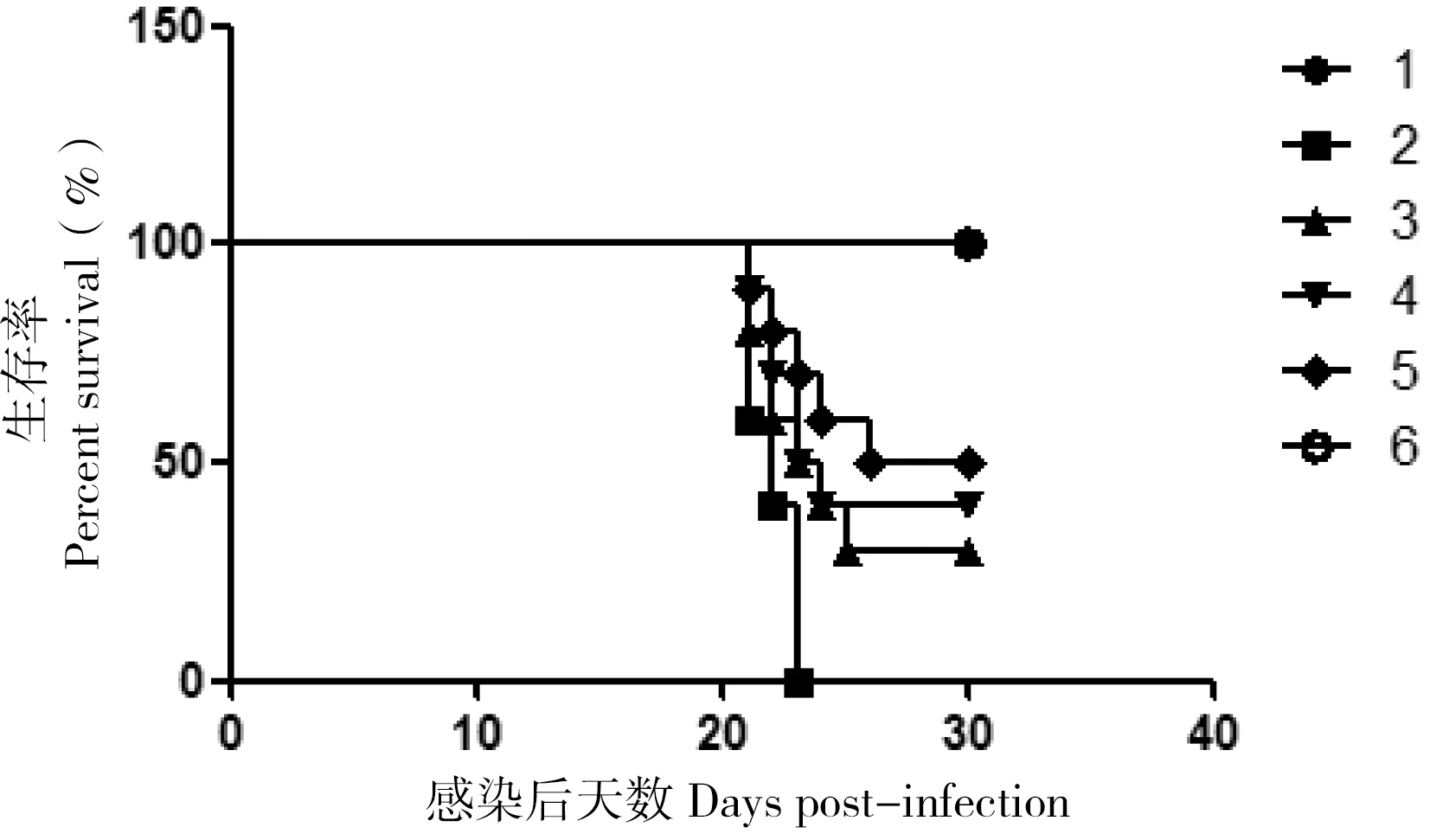
图3 RA CH-1 感染雏鸭后的死亡率统计
Fig 3 Lethality rate of ducks after chanllenge of RA CH-1
3 讨论
鸭疫里默氏杆菌至少存在21种血清型,每种血清型之间没有明显的交叉保护力[12,15-16],免疫灭活苗有时无法产生免疫保护,而亚单位疫苗成分明确,无核酸,生物安全性高,部分亚单位疫苗可引起交叉免疫保护,因此研究RA亚单位疫苗很有必要[17]。TonB依赖性受体除了具有转运功能和与病原菌致病能力相关外,它作为革兰氏阴性菌外膜蛋白的一种,在对荧光假单胞菌[10]和杜克雷嗜血杆菌[18]以及鸭疫里默氏杆菌[12]的研究中也被证实了具有免疫原性,这些研究为TonB依赖性受体作为亚单位疫苗的开发奠定了基础。
在致病菌感染宿主机体的过程中,致病菌会加强相关毒力因子的表达,而部分毒力因子具有一定的免疫原性[19-20]。目前已经被证明的毒力因子有OmpA[21]VapD[22]、CAMP cohemolysin[23]和TbdR1[13]以及Siderophore-interacting protein(Sip)[24],其中OmpA[25]、TbdR1[12]和CAMP cohemolysin[26]被证实具有免疫原性,Chu等人[17]研究表明ompA和CpG寡脱氧核苷酸融合后构建的新型重组基因工程疫苗具有很好的保护效果,这为亚单位疫苗的佐剂选择提供了参考。
胡青海等[12]发现TbdR1在RA血清型1、2和10型中具有交叉免疫原性。本试验中,J1-TbdR1免疫组和J2-TbdR1免疫组的死亡率均低于未免疫对照组,共免疫组明显低于阳性对照组,说明两段抗原表位能引起较好的免疫保护。商品苗免疫组致死率最低,说明此亚单位疫苗还有待从佐剂的选择、免疫的剂量、免疫的方式等方面完善。
4 结论
本研究成功克隆了TbdR1表位抗原片段,攻毒保护实验结果表明两段表位抗原均具有一定的免疫保护原性且共免疫时免疫保护效果最好。本试验为进一步研究TbdR1亚单位疫苗和交叉免疫保护奠定了基础。
[1]CHEN Y P,TSAO M Y,LEE S H,et al.Prevalence and molecular characterization of chloramphenicol resistance inRiemerellaanatipestiferisolated from ducks and geese in Taiwan[J].Avian Pathology,2010,39(5): 333-338.
[2]HESS C,ENICHLMAYR H,JANDRESKI-CVETKOVIC D,et al.Riemerellaanatipestiferoutbreaks in commercial goose flocks and identification of isolates by MALDI-TOF mass spectrometry[J].Avian Pathology,2013,42(2): 151-156.
[3]PATHANASOPHON P,PHUEKTES P,TANTICHAROENYOS T,et al.A potential new serotype ofRiemerellaanatipestiferisolated from ducks in Thailand[J].Avian Pathology,2002,31(3): 267-270.
[4]ANDREWS S C,ROBINSON A K,RODR GUEZ-QUI ONES F.Bacterial iron homeostasis[J].FEMS Microbiology Reviews,2003,27(2-3): 215-237.
[5]CHIMENTO D P,KADNER R J,WIENER M C.TheEscherichiacoliouter membrane cobalamin transporter BtuB: structural analysis of calcium and substrate binding,and identification of orthologous transporters by sequence/structure conservation[J].Journal of Molecular Biology,2003,332(5): 999-1014.
[6]FERGUSON A D,DEISENHOFER J.TonB-dependent receptors-structural perspectives[J].Biochimica et Biophysica Acta (BBA)-Biomembranes,2002,1565(2): 318-332.
[7]KOEBNIK R.TonB-dependent trans-envelope signalling: the exception or the rule?[J].Trends in Microbiology,2005,13(8): 343-347.
[8]BRAUN V.Energy transfer between biological membranes[J].ACS Chemical Biology,2006,1(6): 352-354.
[9]KREWULAK K D,VOGEL H J.TonB or not TonB: is that the question? [J].Biochemistry and Cell Biology,2011,89(2): 87-97.
[10]HU Y H,DANG W,SUN L.A TonB-dependent outer membrane receptor ofPseudomonasfluorescens: virulence and vaccine potential[J].Archives of Microbiology,2012,194(9): 795-802.
[11]TAUSEEF I,HARRISON O B,WOOLDRIDGE K G,et al.Influence of the combination and phase variation status of the haemoglobin receptors HmbR and HpuAB on meningococcal virulence[J].Microbiology,2011,157(Pt5): 1446-1456.
[12]HU Q,DING C,TU J,et al.Immunoproteomics analysis of whole cell bacterial proteins ofRiemerellaanatipestifer[J].Veterinary Microbiology,2012,157(3-4): 428-438.
[13]LU F,MIAO S,TU J,et al.The role of TonB-dependent receptor TbdR1 inRiemerellaanatipestiferin iron acquisition and virulence[J].Veterinary Microbiology,2013,167(3-4): 713-718.
[14]WANG X,LIU W,ZHU D,et al.Comparative genomics ofRiemerellaanatipestiferreveals genetic diversity[J].BMC Genomics,2014,15: 479.
[15]LIU H,WANG X,DING C,et al.Development and evaluation of a trivalentRiemerellaanatipestifer-inactivated vaccine[J].Clinical and Vaccine Immunology,2013,20(5): 691-697.
[16]LIAO H,CHENG X,ZHU D,et al.TonB Energy Transduction Systems ofRiemerellaanatipestiferAre Required for Iron and Hemin Utilization[J].PloS One,2015,10(5): e0127506.
[17]CHU C Y,LIU C H,LIOU J J,et al.Development of a subunit vaccine containing recombinantRiemerellaanatipestiferouter membrane protein A and CpG ODN adjuvant[J].Vaccine,2015,33(1): 92-99.
[18]LEDUC I,FUSCO W G,CHOUDHARY N,et al.Passive immunization with a polyclonal antiserum to the hemoglobin receptor ofHaemophilusducreyiconfers protection against a homologous challenge in the experimental swine model of chancroid[J].Infection and Immunity,2011,79(8): 3168-3177.
[19]SCHAIBLE U E,KAUFMANN S H.Iron and microbial infection[J].Nature Reviews Microbiology,2004,2(12): 946-953.
[20]HSIAO A,ZHU J.Genetic tools to study gene expression during bacterial pathogen infection[J].Advances in Applied Microbiology,2009,67: 297-314.
[21]HU Q,HAN X,ZHOU X,et al.OmpA is a virulence factor ofRiemerellaanatipestifer[J].Veterinary Microbiology,2011,150(3-4): 278-283.
[22]WENG S C,LIN W,CHANG Y,et al.Identification of a virulence-associated protein homolog gene and ISRa1 in a plasmid ofRiemerellaanatipestifer[J].FEMS Microbiology Letters,1999,179(1): 11-19.
[23]CRASTA K C,CHUA K L,SUBRAMANIAM S,et al.Identification and characterization of CAMP cohemolysin as a potential virulence factor ofRiemerellaanatipestifer[J].Journal of Bacteriology,2002,184(7): 1932-1939.
[24]TU J,LU F,MIAO S,et al.The siderophore-interacting protein is involved in iron acquisition and virulence ofRiemerellaanatipestiferstrain CH3[J].Veterinary Microbiology,2014,168(2-4): 395-402.
[25]HUANG B,SUBRAMANIAM S,FREY J,et al.Vaccination of ducks with recombinant outer membrane protein (OmpA) and a 41 kDa partial protein (P45N′) ofRiemerellaanatipestifer[J].Veterinary Microbiology,2002,84(3): 219-230.
[26]HUANG B,KWANG J,LOH H,et al.Development of an ELISA using a recombinant 41 kDa partial protein (P45N′) for the detection ofRiemerellaanatipestiferinfections in ducks[J].Veterinary Microbiology,2002,88(4): 339-349.
Research on immunogenicity of the epitope peptide of TonB-dependent receptor 1 ofRiemerellaanatipestifer
LUO Ya-li,HUANG Chun,LI Pei,KONG Qing-ke
(Institute of Preventive Veterinary Medicine,Sichuan Agricultural University,Chengdu 611130,China)
TonB-dependent receptor 1(TbdR1) was recently discovered to be an immunogenic antigen,which showed cross-reaction amongR.anatipestiferserotypes 1,2,and 10.Through bioinformatics analysis.Some of the epitope peptide of TonB-dependent receptor 1 ofRiemerellaanatipestiferwere chosen and researched about their immunogenicity.The results showed that ducks can be protected to some extent by epitope peptide establishing a foundation of the research of the development of the subunit vaccine.
Riemerellaanatipestifer; TonB-dependent receptor; immunogenicity
2016-01-13;
2016-02-02
收稿日期:四川省青年基金(2014JQ0006)
罗雅莉,硕士研究生,研究方向为动物微生物与免疫,E-mail:hyacinth216@outlook.com
孔庆科,研究员,研究方向为微生物学和疫苗学,E-mail:kongqiki@163.com
10.3969/j.issn.2095-1736.2016.06.029
S852.61
A
2095-1736(2016)06-0029-04

