唾液酰基转移酶ST6Gal-I在肿瘤中的生物学作用
赵玉洁,汪淑晶
(大连医科大学 生物化学与分子生物学教研室 糖生物学研究所,大连 116044)
唾液酰基转移酶ST6Gal-I在肿瘤中的生物学作用
赵玉洁,汪淑晶
(大连医科大学 生物化学与分子生物学教研室 糖生物学研究所,大连 116044)
唾液酸修饰是糖基化修饰的一种重要形式,与肿瘤的发生发展密切相关。唾液酸修饰是在唾液酰基转移酶的作用下,通过糖苷键转移到糖蛋白或糖脂分子末端的半乳糖上。细胞表面唾液酸的高表达与肿瘤的发生发展及临床愈后密切相关,并且与唾液酸相关的肿瘤抗原现在已成为许多恶性肿瘤的靶向研究分子。研究表明,在细胞癌变过程中,唾液酸化糖链结构的改变与其对应的唾液酰基转移酶的表达和活性相关,现综述在肿瘤发生发展过程中ST6Gal-I的作用及其表达和活性的改变。
ST6Gal-I;肝癌;侵袭;转移;凋亡
糖基化修饰在细胞生物体发育过程中起着十分重要的作用。细胞间的信号转导、物质运输以及细胞黏附等生物学行为均受细胞膜表面糖链的调控。大量研究表明,糖基化修饰参与炎症发生、细胞免疫调节以及血管生成等生理病理活动,且糖基化与肿瘤生物学行为也密切相关。在细胞内糖基化过程中,糖基转移酶(Glycotransferase)起着十分重要的作用,它依赖于单糖分子前体及其自身的可用性,在唾液酰基转移酶和岩藻糖基转移酶等糖苷酶的作用下形成唾液酸和岩藻糖,这一系列的生物学行为发生在细胞内质网、高尔基体、细胞核和细胞质中[1-3]。目前,关于唾液酸化结构和通过唾液酸化载体蛋白调节信号传导控制细胞入侵从而增强细胞生存等转移性细胞行为的分子机制研究尚少,但已证实的是,许多唾液酸化结构均与癌症相关[4-5]。据相关文献报道,肿瘤细胞中经常发现异常表达的唾液酰基转移酶,因此推测唾液酰基转移酶的异常表达与肿瘤的发生发展密切相关。
1 唾液酸基本结构
唾液酸(sialic acid)是一种带负电荷的九碳单糖,它作为末端结构通常附着在细胞膜表面N-聚糖、O-聚糖以及鞘糖脂的糖复合物上[6]。迄今为止,研究发现唾液酸可通过一些唾液酰基转移酶,以α2,3和α2,6两种连接方式与Gal或GalNAc连接,或者以α2,8的连接方式与唾液酸蛋白相结合。鉴于细胞膜表面唾液酸的带负电荷性以及寡糖链末端的定位性,唾液酸不仅能调节细胞膜的构象以及其稳定性,还能够调节细胞与环境间的相互作用以及细胞间的跨膜、迁移、增殖、分化和凋亡等正常信号的传递[7-8]。另一方面,唾液酸化作用的改变还与肿瘤的恶性程度密切相关,有研究发现高表达的唾液酸能够保护肿瘤细胞逃避免疫系统的识别和攻击[9]。
2 唾液酸糖基转移酶分类
唾液酸糖基转移酶,它是以CMP-Neu5Ac为糖基供体,催化从胞苷酸-N-乙酰神经氨酸将N-乙酰神经氨酸转移给神经节苷脂或糖蛋白的末端糖残基,释放胞苷酸的酶。唾液酸糖基转移酶的底物较为单一,唾液酸供体仅为CMP-Neu5Ac,由于其底物和催化的原因,又被称为唾液酰基转移酶。
目前在哺乳动物中发现了列出19种唾液酰基转移酶,根据底物特异性和催化合成形成新的糖苷键类型可以把唾液酰基转移酶进一步细分为4类:ST3Gal I~VI;ST6Gal I、II;ST6GalNAc I~Ⅵ以及ST8Sia I~VI(见表1)。这些唾液酰基转移酶分别将CMP-Neu5Ac中的Neu5Ac以α2,3、α2,6以及α2,8糖苷键的形式转移到β-半乳糖、N-乙酰半乳糖胺或其他唾液酸上。
3 唾液酸异常表达与癌症发生的关系
当细胞发生癌变时,细胞膜表面的糖蛋白和糖脂首先发生改变。糖蛋白糖链结构的异常使细胞间的识别和信息传递发生障碍,而糖链的合成是通过糖基转移酶将糖基由供体(如UDPG)转移到糖链受体上,糖基转移酶或糖苷酶的改变决定着糖链结构的改变,各种唾液酸转移酶应用共同的供体单磷酸胞苷活化的唾液酸(CMP-Neu5Ac)对糖链末端进行唾液酸化修饰。此外有研究发现,在肿瘤形成过程中,唾液酸通过刺激表皮生长因子受体(EGFR)的磷酸化来增强酪氨酸激酶抑制剂(TKIs)的敏感性,从而为肿瘤的治疗提供新的线索[10]。相关研究表明,不同种类的唾液酰基转移酶在肿瘤细胞中的表达具有明显差异,它们通过改变细胞膜表面糖链末端唾液酸化的结构或数量,来影响肿瘤的发生和发展。
4 α2,6唾液酸化与癌症发生发展的关系
ST6Gal-I介导的α2,6唾液酸化在癌症进展中十分重要,肿瘤细胞表面α2,6唾液酸的不同表达量可影响肿瘤细胞的增殖、迁移和侵袭。实验研究首先在结肠癌、乳腺癌,肝癌,宫颈癌,绒毛膜癌,急性髓性白血病等疾病中发现高表达的ST6Gal-I,然后在恶性脑癌中也发现ST6Gal-I的异常高表达[11-13],最新研究发现高表达ST6Gal-I介导的唾液酸化可促进肿瘤组织血管的形成,且α2,6唾液酸遮盖了β-半乳糖绑定的半乳凝集素的识别位点,其主要作用是抑制凝集素siglec-2家族,进而影响半乳凝集素黏附、迁移以及凋亡的能力[14]。此外,最近研究显示肿瘤细胞表面ST6Gal-I的异常高表达可促使肿瘤细胞在自然杀伤细胞(NK)和调整性T淋巴细胞(Teff)/系统性T淋巴细胞(Treg)细胞水平发生免疫逃逸,进而削弱T细胞对肿瘤细胞的杀伤作用[15]。针对此现象,干扰α2,6唾液酸可作为新的肿瘤治疗靶点。
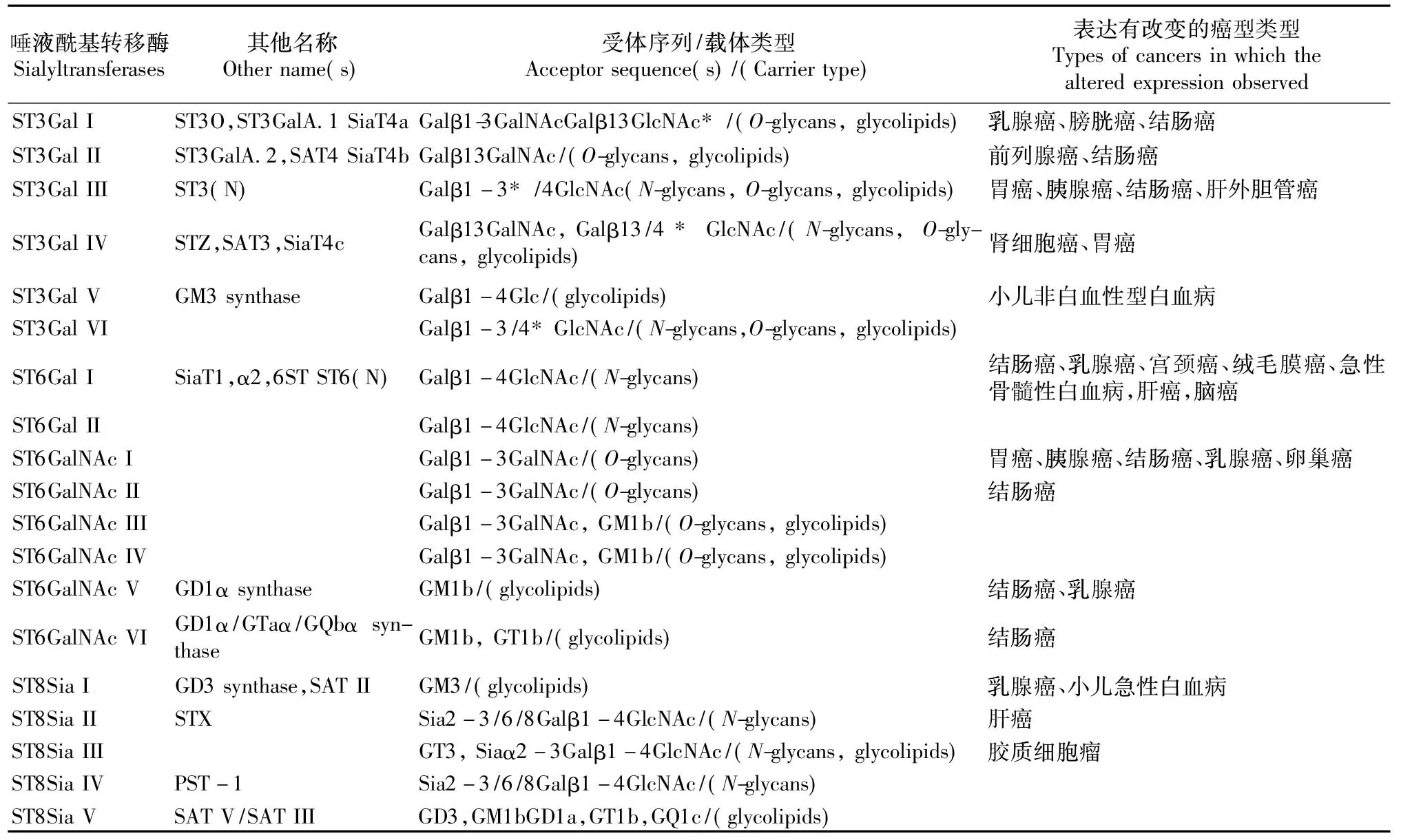
表1 唾液酰基转移酶在不同肿瘤中的表达
4.1 ST6Gal-I在不同癌症中表达的底物特异性
ST6Gal-I的表达在不同癌症中受不同启动子(P1、P2和P3)调节[16],并且caveolin-1可激活ST6Gal-I的转录[17]。P1启动子作用于宫颈癌和肝癌组织[18],进一步通过荧光素酶分析显示,P1启动子结合位点Sp1和HNF1的突变只影响肝癌细胞系HepG2细胞中启动子活性,在宫颈癌细胞系C33A细胞中并没有明显变化,这表明了ST6Gal-I启动子活性的调节与细胞类型有关[19]。此外,与宫颈癌中P1启动子活性相比,在NIH3T3细胞(小鼠胚胎成纤维细胞)中,则通过P3启动子诱导ST6Gal-I表达,这说明ST6Gal-I的表达是通过不同的转录因子调节;ST6Gal-I的启动活性也受表观遗传学调控[20],甲基化ST6Gal-I启动子后可导致膀胱癌中ST6Gal-I基因沉默。除了它的启动子活性,ST6Gal-I的表达也能够在转录后水平被调控。研究表明ST6Gal-I可形成GOLPH3复合体,在高尔基体内发挥分泌运输原癌基因的功能,下调乳腺癌细胞MDA-MB-231中该基因的表达,可使α2,6连接唾液酸的能力降低[21]。可见,ST6Gal-I通过其修饰的靶蛋白来发挥功能。因此更好地理解ST6Gal-I的底物特异性,则有助于抑制ST6Gal-I特异性药物的研发。
4.2 ST6Gal-I促进肿瘤细胞的侵袭转移
相关研究显示ST6Gal-I在恶性肿瘤的侵袭和转移中发挥重要作用。有文献报道,在结肠癌中高表达ST6Gal-I可促进α2,6涎化糖类产物的增加从而促进肿瘤的转移;在MDA-MB-435人乳腺癌细胞和OV4卵巢癌细胞中ST6Gal-I的高表达可导致细胞间的黏附能力降低从而提高细胞的侵袭能力[22]。但有研究发现,在人乳腺癌MCF-7细胞中,其黏附能力并无明显变化,这说明α2,6唾液酸的作用具有细胞差异性[23]。在肿瘤早期转移阶段,肿瘤细胞释放趋化因子使巨噬细胞和炎症细胞到达肿瘤组织周围的基质区域,随后肿瘤相关巨噬细胞(tumor-associated macrophages,TAMs)穿透基底膜,使肿瘤细胞逃离基底膜的束缚到达周围正常组织基质区[24]。TAMs通过释放血管生成调节酶类,如MMP-2、MMP-7和MMP-9等基质金属蛋白酶(MMPs),促进肿瘤组织血管生成,为肿瘤的生长和转移提供氧分和营养,从而提高肿瘤的侵袭和运动能力。本课题组研究发现,ST6Gal-I的表达在不同转移能力的骨肉瘤细胞中也具有明显差异性,可正性介导肿瘤细胞的迁移和侵袭能力[25]。
在整合素β1的I型结构域内有3个N-糖基化位点,该区域的α2,6唾液酸化程度在配体结合中十分重要。在卵巢癌中,高表达α2,6唾液酸化的整合素β1可导致细胞黏附、侵袭和迁移能力的增强[26];在结肠癌的研究中,同样发现整合素β1的高α2,6唾液酸化会使细胞与I型胶原蛋白和层黏连蛋白的黏附作用增强。这是由于α2,6唾液酸化的整合素能与胞内踝蛋白(Talin)结合,激活胞内P130cas、ERK1/2以及MEK信号通路,从而增强细胞的迁移能力,当细胞中整合素β1低表达时,ST6Gal-I表达含量变化不会引起细胞转移[27]。因此,可以推测ST6Gal-I通过作用于整合素β1来增强肿瘤细胞的侵袭和迁移能力。
4.3 ST6Gal-I抑制肿瘤细胞凋亡
研究证实肿瘤细胞表面的ST6Gal-I能够使细胞抗凋亡,并使体内α2,6唾液酸产物增加。α2,6唾液酸化通过细胞内半乳糖凝素介导凋亡信号通路。许多半乳糖被发现是通过凝集素糖类与细胞膜表面以及细胞外基质的糖复合物相互作用,从而获得促凋亡的能力[28-29]。最近研究表明α2,6唾液酸作为一种半乳糖捆绑的抑制剂,上调细胞表面α2,6唾液酸含量能够通过绑定半乳糖进而阻止促凋亡[30]。除了半乳糖介导信号通路外,α2,6唾液酸还能够通过抑制细胞凋亡通路(Fas)和肿瘤坏死因子受体1(TNFR1)来诱导其抗凋亡作用[31]。
在不同肿瘤细胞中,Fas促凋亡的活性被唾液酸化屏蔽[32],从而影响肿瘤细胞的生存,α2,6唾液酸通过干扰细胞凋亡信息来抑制Fas的凋亡活性,干扰复杂的诱导信号和阻止Fas受体的内在化[33]。在结肠癌中,高表达ST6Gal-I后,Fas与其死亡结构域相关蛋白(FADD)不能结合,进而不能形成死亡诱导信号复合物(DISC)。高表达ST6Gal-I的TNFR1可以使细胞逃离TNF-α诱导的凋亡,最终阻断细胞凋亡信号传导[30,33]。因此,这可说明α2,6唾液酸化是通过干扰半乳糖凝素以及细胞凋亡信息来诱导肿瘤细胞的抗凋亡作用。
4.4 ST6Gal-I与肿瘤干细胞的关系
肿瘤干细胞(CSCs)指能够自我更新和分化的一小部分肿瘤细胞,根除这部分细胞是癌症治疗领域的新发现。高表达的ST6Gal-I与CSCs相关,在某些方面能够维持干细胞的生物学行为[34]。另一方面,上皮间质转化(EMT)被认为是肿瘤干细胞(CSCs)增殖的重要机制,EMT描述一种反式分化过程,这种反式分化可以使全部的极性上皮细胞进行多种生物化学的改变,从而使这些细胞获得间充质干细胞样的特征与属性。此外,相关研究结果显示,ST6Gal-I介导TGF-β诱导EMT发生[35],下调ST6Gal-I的表达可抑制TGF-β诱导细胞迁移的增加。最新研究发现,ST6Gal-I在人类多能干细胞(hPSCs)的功能性和分化调控中起着十分重要的作用,可通过药理学的途径使唾液酰基转移酶的功能发生改变,进而影响hPSCs分化的多样性[36]。这说明肿瘤干细胞(CSCs)中ST6Gal-I的高表达可促进细胞转移,ST6Gal-I的表达可减少细胞对不同刺激的敏感性从而抑制凋亡延长肿瘤干细胞的寿命。
5 总结与展望
综上所述,唾液酰基转移酶的异常表达可导致细胞膜表面糖链的异常唾液酸化,进而影响细胞的生物学行为。唾液酰基转移酶与肿瘤的增殖、分化、迁移和侵袭密切相关,而不同的唾液酰基转移酶的转录机制不同,因此,进行与其相关研究就显得十分重要。我们希望通过更精准的检测方法来进一步鉴定唾液酸酶和唾液酰基转移酶的功能,从微观角度提出合理的酶催化反应机理,检测酶活性变化,在肿瘤微环境中分析糖基化的调节模式,为新型糖类药物的研发提供强有力的理论支持,为癌症治疗发展高效的唾液酸酶抑制剂奠定基础,对揭示肿瘤的发展和转移机制以及评估疾病愈后具有重要的意义。
[1]GLAVEY S V,HUYNH D,REAGAN M R,et al.The cancer glycome: carbohydrates as mediators of metastasis [J].Blood Reviews,2015,29(4): 269-279.
[2]DRAKE R R,JONES E E,POWERS T W,et al.Altered glycosylation in prostate cancer [J].Advances in Cancer Research,2015,126: 345-382.
[3]张嘉宁,汪淑晶.唾液酸生物学与人类健康和疾病 [J].生命科学,2011(7): 678-684.
[4]DALL'OLIO F,MALAGOLINI N,TRINCHERA M,et al.Sialosignaling: sialyltransferases as engines of self-fueling loops in cancer progression [J].Biochimica et Biophysica Acta (BBA) - General Subjects,2014,1840(9): 2752-2764.
[5]LU J,ISAJI T,IM S,et al.Expression of N-acetylglucosaminyltransferase III suppresses alpha2,3-sialylation,and its distinctive functions in cell migration are attributed to alpha2,6-sialylation levels [J].J Biol Chem,2016,291(11): 5708-5720.
[6]VARKI N M,AJIT V.Diversity in cell surface sialic acid presentations: implications for biology and disease [J].Laboratory Investigation,2007,87(9): 851-857.
[7]SCHULTZ M J,SWINDALL A F,BELLIS S L.Regulation of the metastatic cell phenotype by sialylated glycans [J].Cancer Metastasis Reviews,2012,31(3-4): 501-518.
[8]SCHAUER R.Sialic acids as regulators of molecular and cellular interactions [J].Current Opinion in Structural Biology,2009,19(5): 507-514.
[9]BÜLL C,DEN BROK M H,ADEMA G J.Sweet escape: sialic acids in tumor immune evasion [J].Biochimica et Biophysica Acta (BBA) - Reviews on Cancer,2014,1846(1): 238-246.
[10]YEN H Y,LIU Y C,CHEN N Y,et al.Effect of sialylation on EGFR phosphorylation and resistance to tyrosine kinase inhibition [J].Proc Natl Acad Sci U S A,2015,112(22): 6955-6960.
[11]ZHAO Y,LI Y,MA H,et al.Modification of sialylation mediates the invasive properties and chemosensitivity of human hepatocellular carcinoma [J].Molecular & Cellular Proteomics,2013,13(2): 520-536.
[12]DALL'OLIO F,CHIRICOLO M,D'GRUPPIONI A,et al.Expression of beta-galactoside alpha2,6 sialyltransferase and of alpha2,6-sialylated glycoconjugates in normal human liver,hepatocarcinoma,and cirrhosis [J].Glycobiology,2004,14(1): 39-49.
[13]WANG P H,LI Y F,JUANG C M,et al.Altered mRNA expression of sialyltransferase in squamous cell carcinomas of the cervix [J].Gynecologic Oncology,2001,83(1): 121-127.
[14]KIMURA N,OHMORI K,MIYAZAKI K,et al.Human B-lymphocytes express alpha2-6-sialylated 6-sulfo-N-acetyllactosamine serving as a preferred ligand for CD22/Siglec-2 [J].Journal of Biological Chemistry,2007,282(44): 32200-32207.
[15]PERDICCHIO M,CORNELISSEN L A,STRENG-OUWEHAND I,et al.Tumor sialylation impedes T cell mediated anti-tumor responses while promoting tumor associated-regulatory T cells [J].Oncotarget,2016,7(8): 8771-8782.
[16]O'HANLON T P,LAU J T.Analysis of kidney mRNAs expressed from the rat beta-galactoside alpha 2,6-sialyltransferase gene [J].Glycobiology,1992,2(3): 257-266.
[17]YU S,FAN J,LIU L,et al.Caveolin-1 up-regulates integrin α2,6-sialylation to promote integrin α5β1-dependent hepatocarcinoma cell adhesion [J].Febs Letters,2013,587(6): 782-787.
[19]MILFLORES-FLORES L,MILLN-PÉREZ L,SANTOS-LPEZ G,et al.Characterization of P1 promoter activity of the beta-galactoside alpha2,6-sialyltransferase I gene (siat 1) in cervical and hepatic cancer cell lines [J].Journal of Biosciences,2012,37(2): 259-67.
[20]ANTONY P,ROSE M,HEIDENREICH A,et al.Epigenetic inactivation of ST6GAL1 in human bladder cancer [J].Bmc Cancer,2014,14: 901.
[21]ISAJI T,IM S,GU W,et al.An oncogenic protein Golgi phosphoprotein 3 up-regulates cell migration via sialylation [J].Journal of Biological Chemistry,2014,289(30): 20694-20705.
[22]LIN S,KEMMNER W,GRIGULL S,et al.Cell surface alpha 2,6 sialylation affects adhesion of breast carcinoma cells [J].Experimental Cell Research,2002,276(1): 101-110.
[23]YUAN Y,WU L,SHEN S,et al.Effect of alpha 2,6 sialylation on integrin-mediated adhesion of breast cancer cells to fibronectin and collagen IV [J].Life Sciences,2016,149: 138-145.
[24]NOY R,POLLARD J W.Tumor-associated macrophages: from mechanisms to therapy [J].Immunity,2014,41(1): 49-61.
[25]MENG Q,REN C,WANG L,et al.Knockdown of ST6Gal-I inhibits the growth and invasion of osteosarcoma MG-63 cells [J].Biomed Pharmacother,2015,72: 172-178.
[26]CHRISTIE D R,SHAIKH F M,LUCAS J A 4th,et al.ST6Gal-I expression in ovarian cancer cells promotes an invasive phenotype by altering integrin glycosylation and function [J].Journal of Ovarian Research,2008,1(1): 3.
[27]SHAIKH F M,SEALES E C,CLEM W C,et al.Tumor cell migration and invasion are regulated by expression of variant integrin glycoforms [J].Experimental Cell Research,2008,314(16): 2941-2950.
[28]ELOLA M T,WOLFENSTEIN-TODEL C,TRONCOSO M F,et al.Galectins: matricellular glycan-binding proteins linking cell adhesion,migration,and survival [J].Cellular & Molecular Life Sciences: CMLS,2007,64(13): 1679-1700.
[29]HE J,BAUM L G.Galectin interactions with extracellular matrix and effects on cellular function [J].Methods in Enzymology,2006,417: 247-256.
[30]ZHUO Y,BELLIS S L.Emerging role of alpha2,6-sialic acid as a negative regulator of galectin binding and function [J].Journal of Biological Chemistry,2011,286(8): 5935-5941.
[31]LIU Z,SWINDALL A F,KESTERSON R A,et al.ST6Gal-I regulates macrophage apoptosis via α2-6 sialylation of the TNFR1 death receptor [J].Journal of Biological Chemistry,2011,286(45): 39654-39662.
[32]SUZUKI O,NOZAWA Y.Sialic acids linked to glycoconjugates of Fas regulate the caspase-9-dependent and mitochondria-mediated pathway of Fas-induced apoptosis in Jurkat T cell lymphoma [J].International Journal of Oncology,2003,23(3): 769-774.
[33]SWINDALL A F,BELLIS S L.Sialylation of the Fas death receptor by ST6Gal-I provides protection against Fas-mediated apoptosis in colon carcinoma cells [J].Journal of Biological Chemistry,2011,286(26): 22982-22990.
[35]LU J,ISAJI T,IM S,et al.β-Galactoside α2,6-sialyltranferase 1 promotes transforming growth factor-β-mediated epithelial-mesenchymal transition [J].Journal of Biological Chemistry,2014,289(50): 34627-34641.
[36]WANG Y C,STEIN J W,LYNCH C L,et al.Glycosyltransferase ST6GAL1 contributes to the regulation of pluripotency in human pluripotent stem cells [J].Scientific Reports,2015,5: 13317.
The biology function of ST6Gal-I in tumor
ZHAO Yu-jie,WANG Shu-jing
(Biochemistry and Molecular Biology Teaching and Research Section,Sugar Institute for Biological Studies,Dalian Medical University,Dalian 116044,China )
Modification of sialic acid is an important form of glycosylation,which is correlated with the occurrence and development of carcinoma closely.Under the influence of saliva acyltransferase,sialic acid is transferred to galactose which is at the end of glycoprotein or glycolipid through glyosidic bond.It is reported that high expression of sialic acid on cell surface plays a vital role on oncogenesis and clinical prognostic.Nowadays,more and more researchers pay attention to the molecular research about antigen of sialic acid relating to the target of carcinoma formation.Studies have shown that in the process of carcinogenesis,the acyltransferase expression and activity are corresponding to the change of sugar chain structure in saliva acid.The role of ST6Gal-I in the development of tumor and the change of its expression and activity during oncogenesis were discussed in this review.
ST6Gal-I; liver cancer; invasion; metastasis; apoptosis
2016-03-07;
2016-03-23
收稿日期:国家自然科学基金,(No.31470799)
赵玉洁,硕士研究生,研究方向为肿瘤糖生物学,E-mail:zhaoyujie012816@163.com
汪淑晶,副教授,硕士生导师,研究方向为糖生物学,E-mail:wangshujing@dlmedu.edu.cn
10.3969/j.issn.2095-1736.2016.06.082
R730.2
A
2095-1736(2016)06-0082-04

