湖北黄石野生驯化扦插雷公藤芽、叶中雷公藤甲素的含量分析
汪文强,邓奇,肖安菊
(湖北理工学院医学院,湖北黄石435003)
湖北黄石野生驯化扦插雷公藤芽、叶中雷公藤甲素的含量分析
汪文强,邓奇,肖安菊
(湖北理工学院医学院,湖北黄石435003)
【目的】探讨湖北黄石野生驯化扦插雷公藤芽、叶中雷公藤甲素含量变化。【方法】采自湖北通城、江西萍乡、湖南岳阳、浙江丽水和福建泰宁等地的雷公藤样品,于黄石市湖北理工学院医学院雷公藤种植基地野生驯化1年后,采枝条扦插2年。分别于2015年5、7、9、11月,采收上述5省的野生驯化扦插的雷公藤芽和叶,采用石油醚除杂—70%(体积分数)甲醇水提—氯仿萃取的方法处理样品,HPLC法测定雷公藤甲素的含量。【结果】5、7月种源于湖北通诚的雷公藤芽和叶中基本不含有雷公藤甲素;自5月至11月种源于湖南岳阳和浙江丽水的雷公藤叶中雷公藤甲素含量逐渐升高;11月各来源的雷公藤叶中雷公藤甲素含量最高。雷公藤叶中雷公藤甲素的含量因种源而不同。【结论】湖北黄石地区可以种植雷公藤。11月采集的雷公藤叶更有利于提取、分离雷公藤甲素单体。
雷公藤/生产和制备;雷公藤甲素/分析;色谱法,高压液相
雷公藤甲素是雷公藤片、雷公藤多苷片的主要成分,主要来源于野生资源的雷公藤根。人工种植雷公藤则是因其生长周期长(长达6年)、栽培成本高而受到广泛限制。近20年,由于国内市场对雷公藤片、雷公藤多苷片的需求大幅度增加,致雷公藤野生资源锐减。其原因是根中雷公藤甲素的含量较少,按全国雷公藤甲素年产量为10余公斤计算,需要消耗350吨以上雷公藤根才能满足生产(根中雷公藤甲素含量为30 μg/g)[1]。虽然雷公藤甲素可以生物合成,但其存在合成路线较长、得率低、反应条件苛刻等[2-3]局限性,故从自然植物中提取雷公藤甲素依然是主要途径。如何节约雷公藤资源,如何提高雷公藤甲素的产量,是目前亟待解决的问题。
许多学者致力于从雷公藤其他部位提取雷公藤甲素的研究,取得了一些进展。李汉保等[4]报道雷公藤叶中雷公藤甲素含量高于根3倍;吴春敏[5]报道10月采集福建泰宁的2份样品含量为89.7 μg/g,高于根皮;张少燕等[6]报道浙江金华的雷公藤叶中雷公藤甲素含量39.7 μg/g,仅次于根皮的41 μg/g。基于以上研究现状,本课题组采集野生雷公藤样品移栽驯化,剪取枝条扦插,寻找适宜于湖北黄石市生长的优质雷公藤种源;应用扦插2年的雷公藤芽和叶,测定雷公藤甲素的含量,观察雷公藤芽、叶中雷公藤甲素含量变化规律,以期为后续从雷公藤叶中提取分离雷公藤甲素奠定基础,现报道如下。
1 材料
1.1 药材来源雷公藤芽、叶(是野生于湖北通城、江西萍乡、湖南岳阳、浙江丽水和福建泰宁等5地,移栽至黄石1年后,再采集枝条扦插成活2年的雷公藤芽和叶。此移栽处理能消除种植年限对雷公藤甲素含量的影响),分别于2015年5、7、9和11月在湖北理工学院医学院雷公藤种植基地采集,将叶用线穿起,悬挂晾干,将芽平铺于桌面,自然晾干,粉碎备用。
1.2 仪器与试剂STI 501型HPLC色谱系统[Kromastar C18柱(250 mm×4.6 mm,5 μm)赛智科技];QT08超声清洗器(天津市瑞普电子仪器公司);RE-52A型旋转蒸发仪(上海亚荣生化仪器厂);雷公藤甲素(批号:Y2556Y17052,纯度>980 mg/g,上海源叶生物科技有限公司);甲醇(色谱纯,山东禹王实业有限公司),色谱用水为双蒸水;其他甲醇、石油醚、乙酸乙酯、氯仿、四氯化碳等均为分析纯。
2 方法与结果
2.1 色谱条件流动相为甲醇—水(体积比为45∶55);流速:0.8 mL/min;检测波长:218 nm;柱温为室温;进样量为20 μL[4,7]。
2.2 对照品溶液的配制精密称取雷公藤甲素标准品5 mg,加甲醇定容至10 mL,得标准品贮备液。
2.3 供试品溶液的配制取各种雷公藤芽和叶2 g,精密称定,置250 mL圆底烧瓶中,加石油醚50 mL,微沸回流2 h,滤除石油醚,挥干药渣。加体积分数为70%的甲醇溶液100 mL,回流2 h,分离得到甲醇提取液,重复提取1次,合并甲醇提取液,减压回收甲醇至约10 mL;剩余液用50 mL四氯化碳分2次萃取,弃四氯化碳层;剩余液层继续用75 mL氯仿分3次萃取,合并氯仿萃取液,减压回收氯仿至近干,残渣用9 mL甲醇分2次加入溶解,转移至10 mL容量瓶中定容,得供试品溶液[8]。
2.4 方法学考察
2.4.1 线性关系考察分别精密吸取贮备液0.1、0.25、0.5、1.0、2.5 mL于25 mL容量瓶中,用甲醇稀释成2、5、10、20、50 μg/mL标准溶液。按2.1项色谱条件进样检测,以浓度C对峰面积A求出线性回归方程:A=74796C-141853,r=0.9992,结果表明雷公藤甲素标准品在2~50 μg/mL范围内与峰面积呈良好的线性关系。
2.4.2 精密度试验精密吸取同一对照品溶液20 μL,连续进样5次,计算雷公藤甲素峰面积的sR为1.54%,表明仪器的精密度良好。
2.4.3 稳定性试验取同一供试品溶液,自配制好后0、4、8、12、24 h分别进行测定,计算雷公藤甲素峰面积的sR为1.39%,表明供试品溶液在配制后的24 h内基本稳定。
2.4.4 重复性试验取同一雷公藤叶样品粉末5份,每份2 g,精密称定,按2.3项方法制备,依法测定,结果5份雷公藤甲素峰面积的sR为2.96%。
2.4.5 加样回收试验取已知含量的11月采湖北雷公藤叶粉末2 g,共6份,精密称定,精密加入雷公藤甲素贮备液0.08 mL、0.1 mL、0.12 mL各2份,按2.3项方法制备,依法测定。代入回归方程计算平均回收率为95.4%,sR为2.55%,结果见表1。
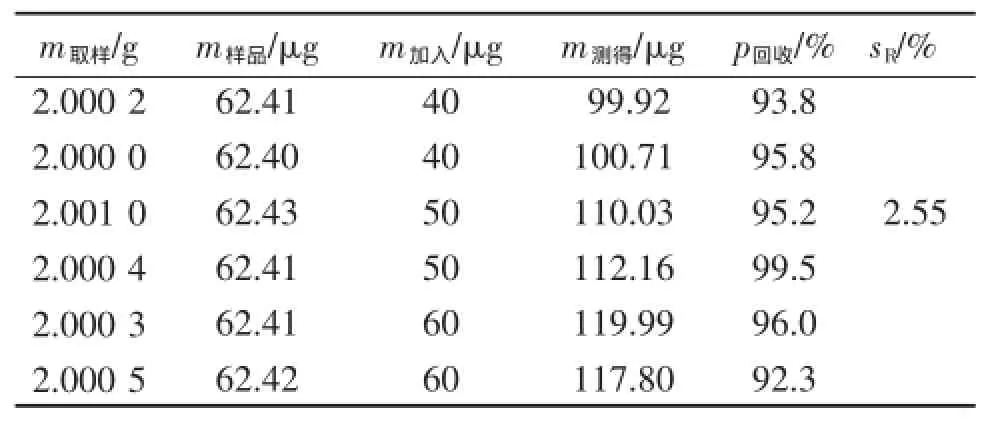
表1 加样回收试验结果Table 1Recovery test results
2.5样品的含量测定取雷公藤芽和叶粉末2 g,精密称定,按2.3项方法制备供试品溶液,过0.45 μm微孔滤膜,进样20 μL,按2.1项色谱条件测得峰面积,每个样品进样2次,代入回归方程计算含量,结果见表2。11月采集种源于湖北通城的雷公藤芽和叶的色谱见图1。
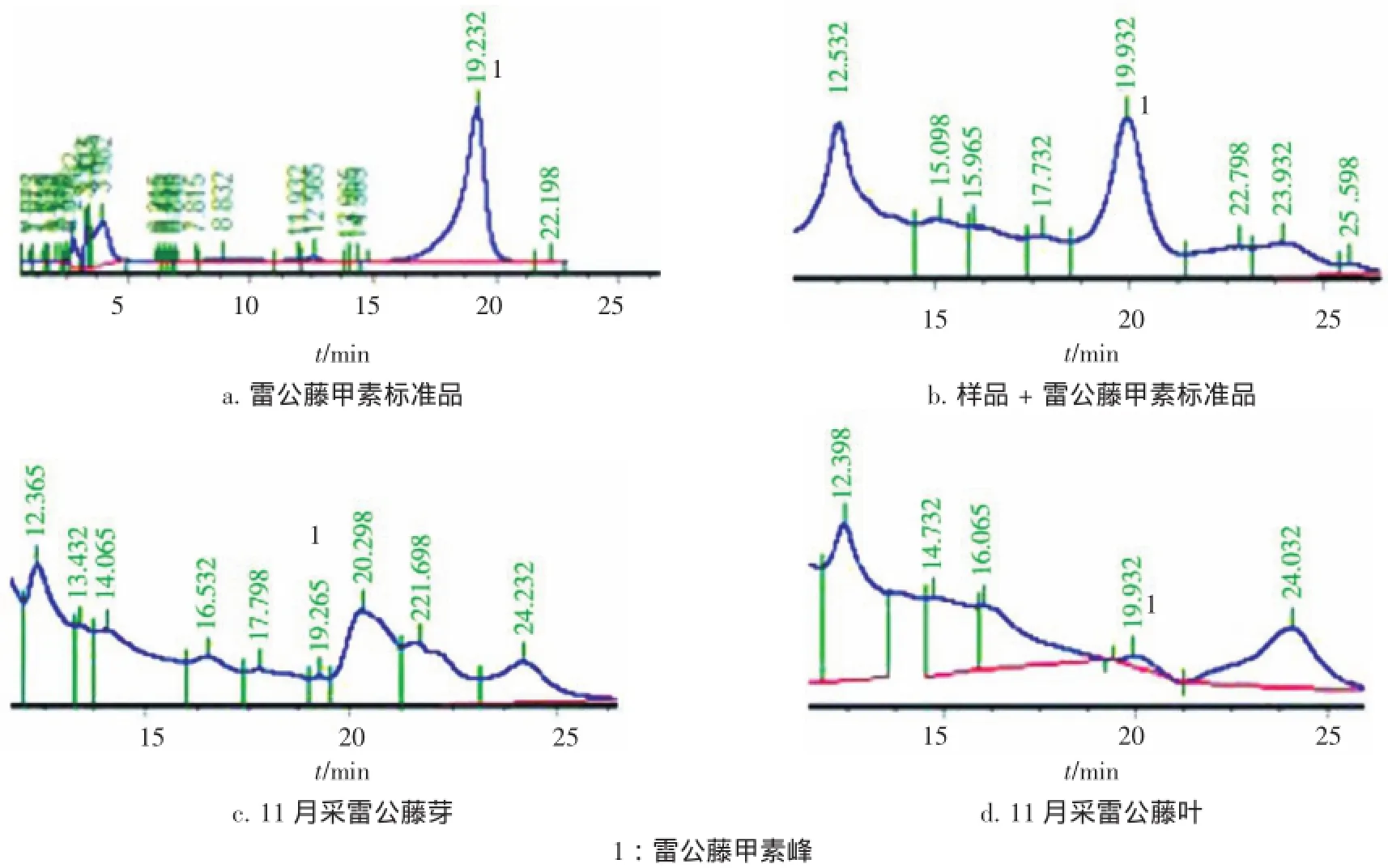
图1 11月采集的雷公藤叶和芽中雷公藤甲素的HPLC图谱Figure 1HPLC chromatograms of triptolide in the buds and leaves of Tripterygium wilfordii harvested in November
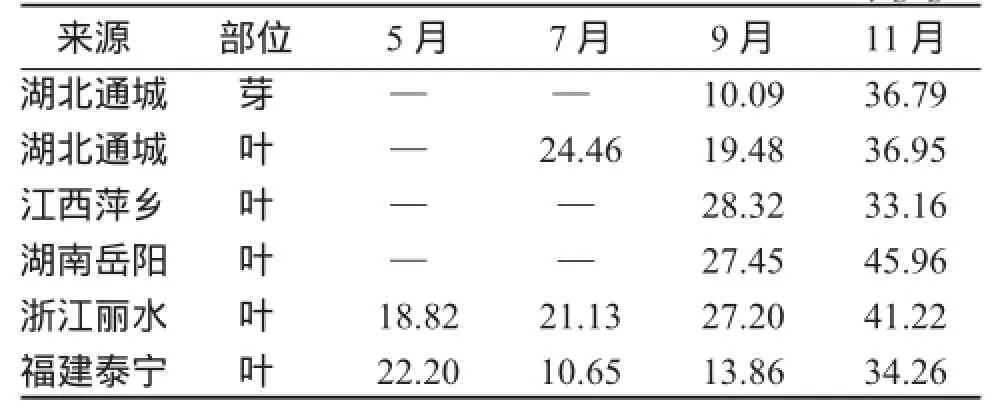
表2 不同来源的雷公藤芽、叶中雷公藤甲素含量(N=3)Table 2Comparison of triptolide content in the buds and leaves of Tripterygium wilfordii from different sourcesw/(μg·g-1)
3 讨论
雷公藤芽有毒性,有报道成人服下嫩芽7个尖即可致死[9]。但是否不同时间采集的雷公藤芽都具有较高含量的雷公藤甲素呢?本课题组分别采集了5、7、9、11月的雷公藤芽,测定雷公藤甲素的含量,结果显示,在5、7月芽中没有检测到雷公藤甲素,9月芽的雷公藤甲素含量较低,11月芽中雷公藤含量较高,这表明雷公藤芽中雷公藤含量的多少与采集月份有密切的关系,11月采集的芽的雷公藤甲素含量最高。
雷公藤叶中雷公藤甲素的含量因种源不同、采集月份不同而有较大区别。表2数据显示:不同月份湖南、浙江种源的雷公藤叶含雷公藤甲素均较其他种源的高,江西和福建种源次之,但这是否与提供扦插枝条的雷公藤的生长年限有关,还需扩大样本量进行检测;11月各种源雷公藤叶中雷公藤甲素含量均高于5、7、9月,与文献[5]报道一致,表明11月采集的雷公藤叶更有利于提取和分离雷公藤甲素。
2012年本课题组率先在黄石市本校基地上进行雷公藤野生驯化、剪枝条扦插繁殖工作,至2015年,来自于湖南和浙江的野生雷公藤生长年限长,枝条和根分支多,根粗壮,直径约3 cm,福建的植株根直径1~1.5 cm,江西的植株最小,根直径小于1 cm。4年的种植情况表明,上述5地种源的雷公藤都能够在湖北黄石市种植成活。扦插成活2年的雷公藤叶中雷公藤甲素的含量变化情况也与其他产区相近,但是适宜于黄石种植的优质雷公藤种源的确定,还有待于进一步从多部位雷公藤甲素含量和药材亩产量等方面进行研究。
[1]徐铮奎.开发雷公藤单体成分新药市场前景广阔[J].中国医药工业杂志,2006,37(10):130.
[2]程传杰,申亮,舒金兵,等.雷公藤甲素及其衍生物的合成研究进展[J].合成化学,2009,17(6):645.
[3]夏舜民,夏志,齐一萍,等.雷公藤甲素的半合成研究[J].中国药科大学学报,1999,30(1):13.
[4]李汉保,王玉玺,王曙东,等.雷公藤地上部分资源利用初探[J].中药材,1990(4):16.
[5]吴春敏.雷公藤化学成分与多组分含量测定研究[D].上海:第二军医大学,2010.
[6]张少燕,范永升,沈炜,等.雷公藤不同部位中6个单体成分的含量比较[J].中华中医药学刊,2013,31(5):1122.
[7]湖北省食品药品监督管理局.湖北省中药材质量标准[S].武汉:湖北科学技术出版社,2009:148-149.
[8]程敬丽,朱烈,朱国念,等.雷公藤甲素的提取工艺[J].农药,2005,44(7):316.
[9]丁艳蕊.雷公藤毒副反应概述[J].中医药研究,1994(3):60.
【责任编辑:黄玲,侯丽颖】
Determination of Triptolide Content in Buds and Leaves of Wild Tripterygium wilfordii Cuttings Cultivated in Hubei Huangshi
WANGWenqiang,DENG Qi,XIAO Anju
(College ofMedical Science,Hubei Polytechnic University,Huangshi 435003 Hubei,China)
ObjectiveTo study the changes of triptolide contents in the buds and leaves of wile Tripterygium wilfordii cuttings cultivated in Huangshi city of Hubei province.MethodsTripterygium wilfordii samples were collected from Hubei Tongcheng,Jiangxi Pingxiang,Hunan Yueyang,Zhejiang Lishui,Fujian Taining,and then were cultivated at Tripterygium wilfordii planting base of College of Medicine of Huangshi municipal Hubei Polytechnic University.After one-year cultivation,their cuttings were cultured for another 2 years.In May,July,September,November of 2015,the buds and leaves of cuttings of the above Tripterygium wilfordii were harvested,and then were processed by petroleum ether(for clearing impurity)-70%(volume fraction)methanol water extraction-chloroform extraction methods.High performance liquid chromatography(HPLC)was used to detect of the contents of Triptolide.ResultsTriptolide was undetectable in the buds and leaves of Hubei Tongcheng Tripterygium wilfordii in May and July.The contents of triptolide in the leaves of Hunan Yueyang and Zhejiang Lishui Tripterygium wilfordii were increased gradually from May to November.The contents of triptolide in the leaves of Tripterygium wilfordill form all the above places were highest in November.The contents of triptolide in the leaves of Tripterygium wilfordii varied because of the difference in sample sources.ConclusionTripterygium wilfordii can be cultivated at Hubei Huangshi area.Triptolide can be easily extracted and separated from the leaves of Tripterygium wilfordii collected in November.
Tripterygium wilfordii/production&preparation;triptolide/analysis;chromatography,high performance liquid
R284.1
A
1007-3213(2016)06-0868-04
10.13359/j.cnki.gzxbtcm.2016.06.025
2016-06-17
汪文强(1994-),男,本科在读;E-mail:416253453@qq.com
肖安菊(1965-),女,本科,教授;E-mail:1157592750@qq.com
湖北高校国家级大学生创新训练计划项目(编号:201410920012,201510920008)

