耳聋基因检测在遗传性耳聋诊断及遗传咨询中的应用
张昊昱张宁张 华朱俊真
1河北省人民医院三优中心
2秦皇岛市第一医院
·临床研究·
耳聋基因检测在遗传性耳聋诊断及遗传咨询中的应用
张昊昱1张宁1张 华2朱俊真1
1河北省人民医院三优中心
2秦皇岛市第一医院
目的从基因检测确定耳聋发病原因,同时为受检者的婚育遗传咨询与干预措施提供依据。方法 对来自7个家庭共21例自愿受检者进行检测前咨询告知其检测的目的方法及意义后,使用耳聋基因芯片和直接测序法对其进行耳聋基因检测。结果在21例受检者中检出1例GJB2 235delC纯合突变、4例复合杂合突变。2例GJB2 235delC与SLC26A4 IVS7-2A>G双重杂合突变。12例杂合突变(2例GJB2基因杂合突变,10例SLC26A4基因杂合突变),2例SLC26A4基因与GJB2基因未检出。并对不同发病原因,不同就诊需求的耳聋家庭提供准确遗传咨询、指导和干预。结论 临床上检测遗传性耳聋的基因对于遗传咨询、生育聋儿风险率评估、产前诊断以及开展治疗等均可提供重要的指导作用。
遗传性耳聋;基因检测,产前基因诊断;突变;遗传咨询
耳聋是临床上常见的严重影响患者认知与交流能力的疾病,无论从精神上还是经济上都将给患者家庭与社会带来沉重的负担。2006年第二次全国残疾人抽样调查统计数据显示,我国听力言语残疾者人数达2780万[1]。我国新生儿中患先天性耳聋的比例约为千分之一[2],大约50%以上的先天性耳聋由遗传因素引起[3]。
因此,如果在婚前、孕前或产前进行耳聋基因检测,有助于了解咨询者、病人及其家属所携带基因突变类型和构成,可有效预防耳聋发生。本研究中,使用耳聋基因芯片和直接测序法对21名自愿接受检测者进行耳聋基因检测并进行遗传咨询。
1 对象与方法
1.1 研究对象
研究对象均来自咨询门诊,7个家庭共21名受检者,包括3例婚前耳聋基因检测,2例孕前耳聋基因检测,2例产前诊断(羊水和脐血各1例)中前来就诊者以及家系中有关成员。在遗传咨询的基础上,对自愿接受基因检测的,让其签署知情同意书。并按要求填写个人基本信息后,病历采集包括母亲孕育期间有关信息,建立详尽的病历档案。再进行采集标本。
1.2 方法
1.2.1 采集受检者的外周血3-5ml,EDTA抗凝,注入真空采血管,统一编号;或用滤纸采集卡,采集受检者末梢血,共采三个血斑,每个样本至少3个血斑,且每个血斑直径大于8毫米,血滴自然渗透,滤纸正反面血斑一致,血斑无污染,血斑无渗血环,统一编号,及时递送检测。若是婴幼儿则可采足跟血,儿童可采集手指血。
1.2.2 检测使用北京博奥生物公司的耳聋基因诊断芯片和天津华大基因科技有限公司医学检验所飞行时间质谱及直接测序法,检测我国常见的四个基因:GJB2、GJB3、SLC26A4与12SrRNA共20个位点(GJB2:35delG、167delT、176del16、235delC、299-300delAT;GJB3:538C>T、547G>A;SLC26A4:2168A>G、IVS7-2A>G、281C>T、589G>A、1174A>T、1226G>A、1229C>T、IVS15+5G>A、1975G>C、2027T>A、2162C>T;12SrRNA:1494C>T、1555A>G),并进行分析。
1.2.3 明确受检者的基因型,确定突变位点后,向受检者提供详尽的遗传咨询,以及各种干预措施。
2 结果
应用基因芯片法与直接测序法在21名受检者中检出1例GJB2 235delC纯合突变、4例复合杂合突变:GJB2 235delC,299-300delAT复合杂合突变、SLC26A4 IVS7-2A>G,1975G>C复合杂合突变、SLC26A4 IVS7-2A>G,2027 T>A复合杂合突变、SLC26A4 IVS7-2A>G,2168A>G复合杂合突变。2例GJB2 235delC与SLC26A4 IVS7-2A>G双重杂合突变。12例杂合突变:其中GJB2 235delC与299-300delAT杂合突变各1例,剩余10例为SLC26A4基因杂合突变,SLC26A4 IVS7-2A>G杂合突变5例、SLC26A4 1226G>A杂合突变3例、SLC26A4 1975G>C杂合突变1例、SLC26A4 2168A>G杂合突变1例。2例SLC26A4基因与GJB2基因均未检出突变。(见表)
2.1 婚前耳聋基因检测及遗传咨询
例1:耳聋患者齐X婚前咨询,接受基因检测,结果显示该患者为GJB2 235delC纯合突变,告知其以后的婚配对象需进行耳聋基因检测,若其也是耳聋患者,则应避免同证婚配。
例2:王X与其男友吴X基因检测结果:王X结果为阴性(野生型);吴X结果为SLC26A4 IVS7-2A>G杂合突变。告知二人SLC26A4基因的遗传规律,其后代有50%几率为SLC26A4基因的携带者,50%为野生型。
例3:聋人情侣朱XX和魏XX双方年龄均为26岁,智力正常(均在本地聋哑学校学习10年),极重度耳聋。咨询目的是了解婚后生育下一代是否同样也为耳聋患者。该对情侣自愿接受耳聋基因检测,女方基因检测结果为阴性。男方为GJB2 235delC杂合突变与SLC26A4 IVS7-2A>G双重杂合突变携带。为了了解其遗传背景,对男方进行家系调查:其父母听力、智力均正常,基因检测结果:其父亲为SLC26A4 1226G>A杂合突变携带;其母亲结果与男方相同。男方的姐姐为GJB2 235delC杂合突变和SLC26A4 1226G>A双重杂合突变携带,男方姐姐的儿子为SLC26A4 1226G>A杂合突变携带。告知二人GJB2和SLC26A4基因的遗传规律,二人若婚育,后代必定为耳聋基因的携带者。两人结婚后决定在医生指导下妊娠,后经产前基因诊断,结果为SLC26A4 IVS7-2A>G杂合突变,生育了听力智力均正常女婴,现在幼儿园学习。
2.2 孕前耳聋基因检测及遗传咨询
例4:一对夫妇:张X与巩X进行孕前耳聋基因检测与遗传咨询,结果:张X基因检测结果为SLC26A4 IVS7-2A>G,2027T>A复合杂合突变,巩X基因检测结果为阴性(野生型)。告知该对夫妇SLC26A4基因的遗传规律,二人生育的胎儿必定为SLC26A4基因的携带者。
例5:夫妇二人生育第一胎男孩,5岁,有残余听力,经过基因检测,妻子携带为GJB2 299-300delAT杂合突变;丈夫携带为GJB2 235delC杂合突变,聋儿为GJB2 235delC,299-300delAT复合杂合突变携带。告知该对夫妇GJB2基因的遗传规律,由于夫妻双方均为相同耳聋基因携带者,若再生育后代,50%几率为GJB2基因携带者,25%几率为野生型,25%几率携带复合杂合突变,再次生育建议进行产前诊断,防止耳聋患儿的出生。
2.3 产前诊断病例与遗传咨询
例6先证者,男,9岁,大前庭水管扩大综合征聋,基因检测为SLC26A4 IVS7-2A>G,1975G>C复合杂合突变,其母已孕第二胎,产前诊断之前的基因检测结果为SLC26A4 IVS7-2A>G杂合突变携带;父亲为SLC26A4 1975G>C杂合突变携带。羊水结果胎儿基因型为IVS7-2A>G杂合突变。告知该夫妇SLC26A4基因的遗传规律,胎儿为携带者,患病几率较低,该夫妇决定继续妊娠,并告知该夫妇,胎儿成年后进行婚配,若其婚配对象也为相同基因的携带者,其后代有较高几率患耳聋,以防万一,胎儿日后的婚配对象需进行耳聋基因检测。
例7孕妇携带SLC26A4 IVS7-2A>G杂合突变;丈夫携带SLC26A4 2168A>G杂合突变;胎儿携带IVS7-2A>G,2168A>G复合杂合突变。告知该夫妇SLC26A4基因的遗传规律,并告知胎儿为复合杂合突变,患耳聋的几率极高,对该夫妇进行解释宣教后,夫妇自己选择终止妊娠,进行引产。通过本次研究说明耳聋基因诊断结合产前诊断,可以有效预防家庭再次生育聋儿。
3 讨论
遗传性耳聋包括非综合征型耳聋(non-syndrom⁃ic hearing impairment,NSHI)和综合征型耳聋(syn⁃dromic hearing impairment,SHI),其中NSHI占70%,SHI占30%[4]。自2003年开始的全国范围的聋病分子流行病学研究显示GJB2、SLC26A4,线粒体DNA 12SrRNA(A1555G和C1494T突变)是导致我国大部分遗传性耳聋患者发病的三个最常见的基因,其中21%的患者带有GJB2突变[5],14.5%的患者带有SLC26A4突变[6],3.8%的患者带有线粒体DNA 12SrRNA A1555G突变,0.6%的患者带有线粒体DNA 12SrRNA C1494T突变[7]。GJB2基因定位于人类的染色体13q11-q12,全长4804bp,有两个外显子,一个内含子,其编码区位于exon2,编码缝隙连接蛋白26(connexin 26,cx26)。GJB2在耳蜗中高表达,其突变可影响内耳缝隙连接,致使钾离子不能回流到内淋巴液,最终导致耳聋[8]。GJB2基因有多种突变方式可导致NSHI,在我国以235delC纯合突变最为常见。大约50%的常染色体隐性遗传NSHI患者带有GJB2基因突变[9]。有研究表明,GJB2基因突变导致的耳聋患者耳蜗听神经正常,即使为重度耳聋也可移植电子耳蜗恢复听力[10]。SLC26A4基因编码Pendrin为其突变导致外显子剪切位点异常或关键氨基酸发生置换等,影响Pendrin蛋白的合成和功能[11]。它的突变不仅可引起SHI:Pendred综合征(临床表现为甲状腺肿大和耳聋),也可引起NSHI:大前庭导水管综合征(EVAS)。我国EVAS患者中SLC26A4基因突变的检出率达到了97%。其病因是联系颅腔和内耳的通道发生异常肿大,任何可引起颅内压变化的因素,如感冒、碰撞等,均可使患者听力下降。线粒体DNA 12SrRNA基因突变后表现为患者机体对氨基糖苷类抗生素异常敏感,氨基糖苷类药物进入耳蜗和前庭后积累,与12SrRNA的结合最终导致细胞的损伤、凋亡,进而影响听力。线粒体DNA 12SrRNA基因突变可通过母亲传给后代,后代中只有女性可将其继续传给下一代。
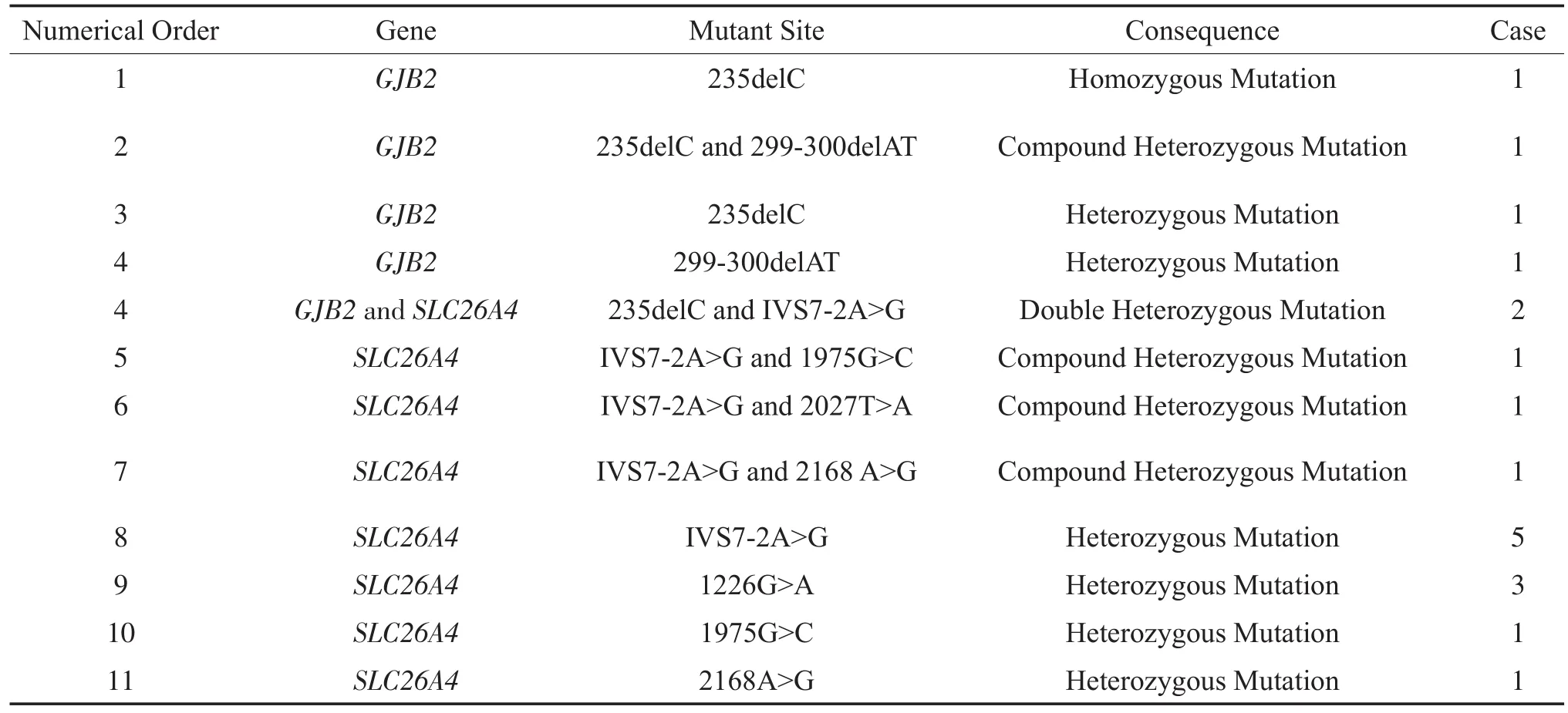
表1 本组耳聋病例基因型分类统计Table 1 Statistics and classification of genotypes of the deafness cases in this group
遗传性耳聋的基因检测可有效地明确病因:若常见耳聋基因突变未检出,则患者耳聋可能为非遗传因素导致,如孕妇妊娠期受病毒感染、分娩时受伤等,但不能排除其他基因突变的可能,需进一步进行家系调查,防止漏诊。本研究的7个案例,依据研究结果,对不同发病原因不同的需求者提供了准确而恰当的遗传咨询,进行婚配、生育指导和干预。整个过程对防止耳聋患儿的出生有积极意义,并可最终降低遗传性耳聋的发病率,阻止遗传性耳聋的发生。
本文中通过耳聋基因检测,明确了耳聋患者或耳聋基因携带者的基因型及突变位点,并以此为依据分析了生育耳聋患儿的风险,对受检者进行了婚配、生育指导。例1中明确了患者的基因型,若其日后的婚配对象也是耳聋患者,可依据基因检测结果,避免同证婚姻,防止耳聋患儿的出生。例3中先证者婚前与女友进行了耳聋基因检测,避免了同型基因婚配,孕后又进行了产前诊断,有效地避免了患儿出生。例3、例6中的耳聋基因携带者后代成年后可依据耳聋基因检测结果对其进行婚育指导,并采取相应的干预措施。例7中的夫妇决定终止妊娠,避免了耳聋患儿的出生,减轻了家庭和社会的负担。
应当指出的是,本研究基因检测主要包括中国人群中最常见的4种基因(GJB2、SLC26A4、GJB3及线粒体12SrRNA),对于基因检测未发现致聋基因的病例,因耳聋病因复杂,影响因素多,且有200余种目前已知的耳聋基因,所以并不能表示其后代完全无耳聋风险,如例3中对魏XX的基因检测结果为阴性,但是并不能排除其他基因突变的可能,为避免漏诊我们做了详细的家系调查,发现其母亲为糖尿病患者,有在怀孕期间病毒感染用药情况,魏XX的耳聋可能是在母亲孕期胎儿受外界影响所导致。
2008年至2010年这三年我国先天性耳聋的发病率分别为1.99%,2.15%和2.19%,呈现逐年增长的态势[12]。由于其增长趋势,在人群中开展耳聋基因检测有很大的必要性:(1)耳聋患者夫妇,在当下较为普遍的聋-聋婚配模式中,若双方具有相同的突变基因,则其后代患耳聋的几率将极高。在婚前进行耳聋基因检测,明确双方的基因型及突变位点,指导基因互补型婚姻,即避免相同基因型的耳聋患者间婚育,可有效地避免聋儿出生;(2)新生儿,因为一定比例的新生儿在听力筛查时表现正常[13],发生漏筛,但随着时间的推移,听力会下降,发生迟发性耳聋,如线粒体DNA 12SrRNA突变患儿使用氨基糖苷类抗生素后听力下降,或SLC26A4患儿在头部受到撞击,磕碰后听力下降。在新生儿听力筛查的同时进行耳聋基因检测,可警示其父母,以便采取相应的保护措施;(3)孕妇,对孕妇进行耳聋基因检测可有效地指导、干预其生育过程,若孕妇携带线粒体DNA 12SrRNA突变,则其家系中所有母系成员均具有相同突变,应终身禁止使用氨基糖苷类药物,若为GJB2、SLC26A4基因突变携带者,建议其配偶也进行耳聋基因检测,若双方为相同基因的携带者,需进行产前诊断,明确胎儿基因型,并进行生育指导与干预。我国每年有两千万孕龄女性生育,通过孕期耳聋基因检测,可预防大约7000名先天性聋儿出生和约40000名耳毒性药物敏感个体耳聋的发生。按人工耳蜗植入术治疗及康复费用40万元/例计算,可为国家节省耳聋治疗费用188亿/年[14];(4)由于耳聋基因的高携带率,且90%~95%的耳聋患儿出生在正常家庭[15],扩大耳聋基因检测的范围,通过对正常夫妇进行婚检或孕检,对其婚配、生育进行指导,才能从根本上杜绝遗传性耳聋的发生。
对于有明确生育耳聋患儿风险的夫妇,检测时应结合产前诊断,即在孕早期进行绒毛膜穿刺,孕中后期进行羊水或脐带血穿刺,进行产前基因诊断,可有效地规避生育耳聋患儿的风险,如例6和例7,当他们生育一个聋儿后,迫切想知道第二个孩子的情况,这时的基因诊断加上产前诊断可以明确胎儿的耳聋基因状态,提前采取干预措施,避免聋儿出生。耳聋产前诊断应尽可能在孕早期进行,早期得到诊断结果,早期进行生育选择,避免痛苦较大的中后期引产[16]。
在整个过程中,进行得当、妥帖的遗传咨询十分必要。耳聋遗传咨询是帮助人们理解和适应与耳聋相关的遗传学因素对医学、心理和家庭影响的过程[17]。一般来讲,遗传咨询应包含检测前咨询和检测后咨询[18]。在耳聋患者的遗传咨询中,检测前的遗传咨询应包含聋病的性质,遗传规律,致聋因素,检测方法等,检测后咨询应当在之前的基础上对检测结果进行科学、系统的分析和解释,并对受检者进行宣教,使其对自身的情况有充分的认识。对有生育计划的,结合家族史及病史对后代患病的风险进行评估,最终做出客观、准确的生育指导,提供相应的干预措施,达到防止遗传性耳聋发生的目的。
目前,有一定比例的耳聋病例无法与致聋基因、突变位点相对应,也有部分突变位点,尤其是相对罕见的错义突变,无法推断其与聋病发生的关系[19]。随着对耳聋基因研究的深入,一些新的基因及突变类型可能被纳入检测范围,一些突变类型也可能被排除,耳聋基因检测的准确性将大幅度提高,并为遗传咨询提供更详实的依据。可以预见的是,通过在人群中对遗传性耳聋相应的知识进行普及、宣教;并随着经济发展,医疗水平的提高,逐渐地扩大耳聋基因检测的范围,经过一两代人的干预,可逐步降低耳聋基因在人群中的携带比例,从根本上降低遗传性耳聋的发病率[20],并由此产生出极大的社会和经济效益。
1 第二次残疾人抽样调查办公室.全国第二次残疾人抽样调查主要数据手册.北京:华夏出版社,2007:2-38. Office of the second sampling survey on disabled people.Handbook of the second national survey on disabled people in China.Beijing: Huaxia Publishing House,2007:2-38.
2 李亮,鲁建光,刘颖,等.先天性非综合征型耳聋相关基因检测及热点突变分析[J].中华耳科学杂志,2012,10(2):246-251. LI Liang,LU Jianguang,LIU Ying,et al.Common deafness genes Detection and hot mutation spots analysis in patients with congenital non-syndromic hearing loss[J].Chinese Journal of otology,2012,10(2):246-251.
3 江凌晓,凌月仙,蔡桂君,等.遗传性耳聋基因芯片检测的临床应用研究[J].分子诊断与治疗杂志,2011,3(3):170-172. JIANG Lingxiao,LING Yuexian,CAI Guijun,et al.Research on the clinical application of DNA microarray on deafness gene mutations [J].Journal of Molecular Diagnosis and Therapy,2011,3(3):170-172.
4 Posukh O,Pallares-Ruiz N,Tadinova V,et al.First molecular screening of deafness in the Altai Republic population[J].BMC Med Genet,2005,6(12):6-12.
5 DAI P,Yu F,Han B,et al.GJB2 Mutation Spectrum in 2063 Chi⁃nese Patients with Nonsyndromic Hearing Impairment[J].TranslMed, 2009,7(1):1-12.
6 DAI P,Li Q,Huang D,et al.SLC26A4 c.919A>G varies among Chi⁃nese ethnic groups as a cause of hearing loss[J].Genet Med,2008,10(8):586-592.
7 戴朴.遗传性耳聋的预防和阻断[J].中华医学杂志,2007,87(40): 2811-2813. DAI Pu.Prevention and blocking of hereditary hearing loss[J].Na⁃tional Medical Journal of China,2007,87(40):2811-2813.
8 王辉兵,于飞,戴朴,等.GJB2结构功能及致病机制研究[J].中华耳科学杂志,2013,11(1):131-137. WANG Huibing,YU Fei,DAI Pu,et al.Research on the structure function and pathogenesis of GJB2[J].Chinese Journal of otology, 2013,11(1):131-137.
9 Walsh T,Shahin H,Elkan-Miller T,et al.Whole exome sequencing and homozygosity mapping identify mutation in the cell polarity pro⁃tein GPSM2 as the cause of nonsyndromic hearing loss DFNB82[J]. Am J Hum Genet,2010,87(1):90-94.
10 Wu CC,Lee YC,Chen PJ,et al.Predominance of genetic diagnosis and imaging results as predictors in determining the speech percept in performance outcome after cochlear implantation in children[J]. Arch Pediatr Adolesc Med,2008,162(3):269-276.
11 蒋树娟,何蓉.遗传性非综合征性耳聋基因诊断的研究进展[J].国际儿科学杂志,2011,38(5):421-425. JIANG Shujuan,HE Rong.Research progress in genetic diagnosis of hereditary non-syndrome deafness[J],International Journal of Pedi⁃atrics,2011,38(5):421-425.
12 中华人民共和国卫生部,中国出生缺陷防治报告.2012. Ministry of public health of the people's Republic of China,China birth defect prevention and control report.2012.
13 王秋菊.新生儿聋病基因筛查——悄然的革命[J].听力学及语言疾病杂志,2008,16(2):83-88. WANG Qiuju.Genetic screening for neonatal deafness:a quiet revo⁃lution[J].Journal of Audiology and Speech Pathology,2008,16(2):83-88.
14 韩明昱,楚严,卢彦平,等.孕期女性常见耳聋基因筛查与耳聋出生缺陷干预[J].中华耳科学杂志,2011,9(3):289-295. HAN Mingyu,CHU Yan,Lu Yanping,et al.Screening of common deaf genes in pregnant women and Management of deafness at birth[J].Chinese Journal of otology,2011, 9(3):289-295.
15 Mitchell RE.Karchmer MA.Chasing the mythical ten percent:pa⁃rental hearing status of deaf and hard of hearing students in the Unit⁃ed States[J].Sign Language Studies.2004,4(2):138-163.
16 陈晓华,余小艳,周洁,等.一个非综合征性耳聋家系的GJB2基因突变分析及产前诊断[J].解放军医学杂志,2014,39(7):557-561. CHEN Xiaohua,YU Xiaoyan,ZHOU Jie,et al.Mutation analysis of GJB2 gene and prenatal diagnosis in a non-syndromic deafness fam⁃ily[J].Medical Journal of Chinese People's Liberation Army,2014,39 (7):557-561
17 袁永一,戴朴.遗传性聋的精准医疗[J].临床耳鼻咽喉头颈外科杂志,2016.1(30):1-5. YUAN Yongyi,DAI Pu.Precise medicine of hereditary hearing loss [J].Journal of Clinical Otorhinolaryngology Head and Neck Surgery, 2016.1(30):1-5.
18 ACMG.Genetics Evaluation Guidelines for the Etiologic Diagnosis of Congenital Hearing Loss.Genetic Evaluation of Congenital Hearing loss Expert Panel.ACMG Statement[J].Genet Med.2002,4(3): 162-171.
19马琳,安会波,刘征燕,等.我国常见耳聋基因及其在临床预防和阻断耳聋中的应用[J].中国优生与遗传杂志,2015.1(23):126-127. MA Lin,AN Huibo,LIU Zhengyan,et al.Common deafness genes in China and their application in clinical prevention and treatment of deafness[J].Chinese Journal of Birth Health&Heredity,2015.1(23): 126-127.
20 朱俊真,曹琴英,葛军,等.耳聋患者相关常见致病基因的分子诊断[J].中华耳科学杂志,2013.4(11):575-577. ZHU Junzhen,Cao Qinying,Ge Jun,et al.Molecular Diagnosis of Deafness Patients in Related Pathogenic Gene[J].Chinese Journal of otology,2013.4(11):575-577.
The Application of Genetic testing of Deafness Genes in Hereditary Deafness Diagnosis and Genetic Counseling
ZHANG Haoyu1,ZHANG Ning1,ZHANG Hua2,ZHU Junzhen1
1 Hebel general hospital three-excellent cente
2 The first hospital of qinhuangdao
Objective To determine the cause of deafness through genetic testing,which can be used as the basis for genetic counseling and intervention measures provided to clients.Method After providing information of the purpose, methods,and significance of genetic testing,hereditary deafness gene chip and gene sequencing were used to test common deafness genes in 21 volunteers from 7 families.Results Among the 21 volunteers,we found 1 case carrying homozygous GJB2 235delC mutation,4 cases carrying compound heterozygous mutations,2 cases carrying double heterozygous GJB2 235delC and SLC26A4 IVS7-2A>G mutations,12 cases carrying simple heterozygous mutations(GJB2 mutations in 2 cases and SLC26A4 mutations in 10 cases),and 2 cases showing no GJB2 or SLC26A4 mutations.Clients received genetic counseling and intervention based on the particular etiologies and needs of each client.Conclusion Clinical deafness gene testing can provide efficient guidance for genetic counseling,evaluation of risk of birth of deaf babies,as well as prenatal diagnosis and intervention.
hereditary deafness;genetic testing,prenatal gene diagnosis;mutation;genetic counseling
R764
A
1672-2922(2016)05-639-5
2016-06-03审核人:翟所强)
10.3969/j.issn.1672-2922.2016.05.017
张昊昱,本科,研究方向:遗传咨询
张宁,Email:18932932122@163.com

