溴乙烷与氢氧化钠在不同溶剂中发生的反应
孟令澍
摘 要:化学是一门以实验为基础的科学。化学实验在化学教学中占有十分重要的地位。通过比较溴乙烷的取代反应和消去反应实验可得出这样的结论:溴乙烷与氢氧化钠在水和乙醇两种不同的溶剂中的反应情况不同,说明溶剂对反应有影响,溶剂极性越强越有利于溴乙烷的取代反应,越不利于消去反应。
关键词:高中化学 化学实验 溴乙烷 氢氧化钠
在学习人教版选修5《有机化学基础》第二章第三节“卤代烃”时,教材42页中的“思考与交流”部分的内容(比较溴乙烷的取代反应和消去反应)引起了我的注意,教材中没有演示实验,于是我想亲自动手完成这两个实验并解决心中的疑问,如“反应中氢氧化钠、水和乙醇各有什么作用”“反应历程是怎样的”“实验的生成物如何检验”“实验条件如何控制”等。
教材中没有明确溴乙烷性质的实验方案,所以需要自己来设计实验方案。在设计实验方案之前,我主要考虑的问题有:氢氧化钠水溶液浓度为多少最适宜?反应物的用量分别为多少适宜?实验是否需要加热?预测生成物及如何检验生成物?检验时药品加入顺序?产物中可能含有哪些副产物?溴乙烷有哪些物理性质?实验中要采取哪些措施来保证人身和实验的安全?带着这些问题我仔细阅读了教材,并查阅了相关资料。溴乙烷的沸点是38.4℃,较易挥发,密度比水大,难溶于水,溶于多种有机溶剂,溴乙烷蒸气有让人不愉快的气味,且溴乙烷蒸气有毒(这些性质在实验时都有所感受),所以做实验时我戴上了简易防毒面具。用滴管取溴乙烷时它容易从滴管中自动滴落,且滴到实验台上的药品迅速挥发。
一、溴乙烷在氢氧化钠水溶液中的取代反应
实验仪器:小试管、胶头滴管。试剂:溴乙烷、10%的氢氧化钠溶液、稀硝酸、硝酸银溶液。反应条件:常温。在具体操作中应完成以下四组对比实验,具体操作、观察到的现象和解释(结论)如下。
实验1:取少量溴乙烷于试管中加几滴硝酸银溶液,无明显现象。由此可知溴乙烷中只有溴原子。
实验2:取少量溴乙烷于试管中,再加适量水并振荡,几分钟后,用胶头滴管取少量上层液体于另一支试管中,滴加硝酸银溶液,无明显现象。由此可知溴乙烷不溶于水,也不与水发生反应。
实验3:取少量溴乙烷,再加入氢氧化钠溶液(体积比1∶3)于试管中并振荡,几分钟后用胶头滴管取少量上层液体于另一支试管中,滴加硝酸银溶液,出现黑褐色沉淀。
解释:加入的硝酸银与溶液中剩余的氢氧化钠反应生成氢氧化银,氢氧化银立即分解为氧化银。未能检验出反应的产物。
实验4:取少量溴乙烷,再加入氢氧化钠溶液(体积比1∶3)于试管中,几分钟后,用胶头滴管取少量上层液体于另一支试管中,先加稀硝酸,并用pH试纸检验,若呈酸性,再滴加硝酸银溶液,出现淡黄色沉淀。
解释:反应中溴乙烷中的溴原子转变为溴离子进入溶液,溴原子的位置被羟基所取代生成乙醇。
至此,我心中还有一个疑问:溴乙烷转变为乙醇,那么溴乙烷中的溴到底是被氢氧化钠中的氢氧根取代了还是被水中的羟基取代了呢?我带着疑问,开始查阅大学教材《有机化学》,以寻找答案。
原来溴乙烷的取代反应属于亲核取代SN2型(双分子)历程,氢氧化钠中的OH-进攻碳溴键的碳原子导致溴原子以溴离子脱离分子,水提供了极性溶剂的环境。又因为碳溴键的极性较强,较容易被取代。此反应在常温下即可发生(但实验中油状物的量并没有明显减少,可见反应也不是特别快),可适当加热以加快反应速率。
二、溴乙烷在氢氧化钠乙醇溶液中的消去反应
这个实验几经周折,经历多次失败,我绞尽脑汁查找资料、调整方案和装置,最后收获了成功。我精心准备第一批实验药品:溴乙烷、饱和氢氧化钠的乙醇溶液(溶解时需要不断加热至沸腾)、0.001%酸性高锰酸钾溶液。实验装置分三部分:制气装置(制乙烯)——除杂(除乙醇蒸气)——检验乙烯。仪器选择的原则是尽量简易,根据实验中要使用带导管的单孔或双孔胶塞的要求,我选用了短而粗的试管。反应条件:水浴加热,简易装置图如图1: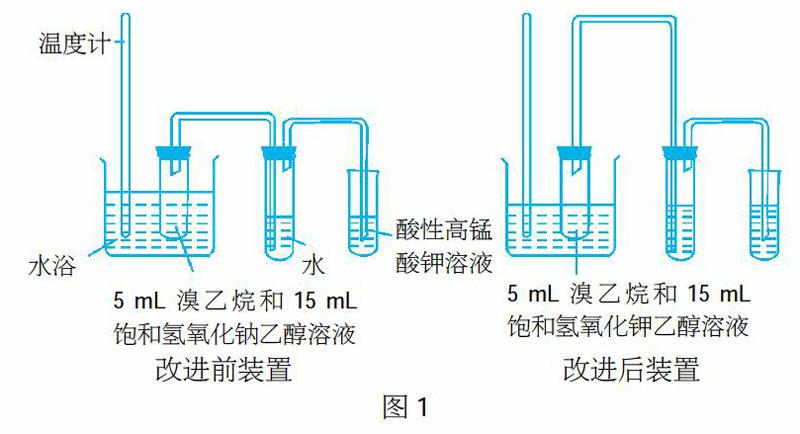
第一次实验:水浴温度从室温开始逐渐升温。在大试管中加入5 mL溴乙烷和15 mL饱和氢氧化钠乙醇溶液,水浴加热,温度逐渐升高,当升温至40℃开始有气泡冒出。导出气体先通入盛有水的试管中除杂,再通入0.001%高锰酸钾溶液中,气泡量较少并没有使高锰酸钾溶液褪色。继续升温至60℃,产生气泡量逐渐增多,但高锰酸钾溶液依旧未褪色。继续升温至70℃,产生气泡开始增多,但又逐渐减少,高锰酸钾溶液依旧未褪色,而且除杂装置中的水开始发生倒吸,实验被迫终止,实验失败。
失败原因:实验中制气装置反应很明显有气泡产生,除杂试管中气泡量也较大,但进入检验的小试管中的气体量很少,酸性高锰酸钾溶液不褪色,说明乙烯的产率很低。乙烯产率低的原因是温度逐渐升高,加热时间过长,溴乙烷挥发过多,反应速率较慢导致的。
改进措施:水浴温度直接选取了60℃~70℃,以加快反应速率。
第二次实验:水浴温度直接选取了60℃~70℃,实验果然剧烈了许多,气泡量增加,我满怀欣喜地盯着酸性高锰酸钾溶液的颜色,5分钟后气泡逐渐减少,但酸性高锰酸钾溶液却没有褪色,装置又开始倒吸,实验终止,实验失败。
为什么产生的乙烯量还是那么少?我开始查阅《有机化学》,研究溴乙烷的消去反应历程。该书中以1-溴丙烷为例,解释了其消去反应为双分子消除(E2)历程,在1-溴丙烷与氢氧化钠的乙醇溶液发生消去反应时,同时又发生了取代反应,其中消去反应产物占9%,而取代所得产物占91%。那么在溴乙烷与氢氧化钠醇溶液中,消去反应和亲核取代反应是同时进行的,而且相互竞争,这一类卤代烃的反应中,消去反应不占优势。通过这个过程,我更加深刻地理解了有机反应通常伴有副反应发生,因此化学反应方程式中用“→”表示。弄明白了溴乙烷制得乙烯的实验不是那么容易发生的问题后,又该如何改进实验得到更多的乙烯呢?
实验突破:教材中的一句话提醒了我,“溴乙烷在强碱(氢氧化钠或氢氧化钾)的乙醇溶液中可以发生消去反应”,于是我将氢氧化钠换成氢氧化钾再次进行实验。
改进措施:改用饱和氢氧化钾的乙醇溶液(溶解时需要不断加热至沸腾),水浴温度直接提高到70℃。
第三次实验:我使用饱和氢氧化钾的乙醇溶液,又将水浴温度直接提高到70℃。这次实验比前两次更剧烈了,有大量气泡生成,我兴奋地期待酸性高锰酸钾溶液能褪色,5分钟后气泡又逐渐减少,装置又开始倒吸,酸性高锰酸钾溶液的颜色依旧没有褪去,实验失败。
实验的温度多少才合适呢?这样一组数据给了我新的灵感:氢氧化钠在100 mL无水乙醇中,沸腾状态时溶解10.0 g,溶液沸点为85℃;氢氧化钾在100 mL无水乙醇中,沸腾状态时溶解47.6g,溶液沸点为116℃。
改进措施:(1)选取95℃水浴(让酒精灯火焰尽量集中,放置网罩)。(2)将制气装置的导气管上下加长,起到冷凝回流的作用,防止倒吸。
第四次实验:在95℃水浴下,反应更加剧烈,上下加长的导气管有效地起到了冷凝回流的作用,尽管如此,除杂试管中的水底部仍有大量溴乙烷蒸出并冷凝,随着大量气泡通入酸性高锰酸钾溶液,高锰酸钾溶液颜色逐渐变浅并最终褪色,实验成功。
三、几点思考和感悟
1.由于溴乙烷与氢氧化钠在水和乙醇两种不同的溶剂中的反应情况不同,这说明溶剂对反应有影响,溶剂极性越强越有利于溴乙烷的取代反应,越不利于消去反应。另外,实验中溴乙烷的消去反应不容易发生,并不能推广到所有卤代烃,有些卤代烃是很容易发生消去反应的,反应的难易与卤代烃的结构有关。
2.在实验和总结过程中,我从网上查找了很多篇关于溴乙烷性质的文章,给了我很多启发,解决了我心中的诸多疑问,帮助我走出了困境,让我以最快的方式找到解决问题的方法。同时,我在阅读文章时,对有些实验者所写的两个观点不太认同:第一,有的作者提到“溴乙烷和氢氧化钾乙醇溶液不相容”的说法,我在实际实验中看到溴乙烷和氢氧化钾乙醇溶液是相互溶解的。第二,有些实验者在用溴乙烷制备乙烯的实验中,没有通过装水的洗气瓶而是直接将气体通入酸性高锰酸钾溶液,观察到高锰酸钾溶液褪色,即说明有乙烯生成。这种做法是不严密的,因为乙醇蒸气也能使酸性高锰酸钾溶液褪色,必须用除杂装置除去乙醇。对于有关向溴乙烷中直接加入硝酸银溶液时的现象问题。我做实验时没有见到淡黄色沉淀,但有些实验者在溴乙烷中加入稀硝酸银溶液,开始的几分钟无变化,但过几分钟后也有淡黄色沉淀。解释说法不一,我将在以后的学习中继续研究。
参考文献:
[1]东北师范大学,华南师范大学.有机化学[M].北京:高等教育出版社,2004.
[2]罗登响,杨一思.制取乙烯实验的问题研究与教学思考[J].中学化学教学参考,2014(3).

