峨眉冷杉幼苗对P的吸收利用特征及潜在机制
邱 阳,吴艳宏 ,孙守琴 ,商宏莉 *
(1.四川师范大学生命科学学院,四川 成都 610101;2.中国科学院水利部成都山地灾害与环境研究所山地表生过程和生态调控重点实验室,四川 成都 610041)
峨眉冷杉幼苗对P的吸收利用特征及潜在机制
邱 阳1,吴艳宏2,孙守琴2,商宏莉1 *
(1.四川师范大学生命科学学院,四川 成都 610101;2.中国科学院水利部成都山地灾害与环境研究所山地表生过程和生态调控重点实验室,四川 成都 610041)
采样盆栽试验的方式,从不同形态磷作用下峨眉冷杉(Abiesfabiri)幼苗生物量的响应,根区土壤速效磷含量变化特征及其与土壤pH和根系分泌有机酸间的关系的角度探讨了峨眉冷杉幼苗对P的吸收利用特征及潜在机制。结果表明,磷的添加促进了峨眉冷杉幼苗生物量的累积,但累积量随磷形态而不同(F=27.1,P< 0.001)。添加Ca-P时生物量最低,其次是 Al-P、Fe-P、Py-P和 K-P。磷形态(F=30.5,P< 0.001)对峨眉冷杉幼苗对磷的需求效率具有显著影响。峨眉冷杉幼苗的磷需求效率在K-P处理下最高,在Ca-P和Fe-P处理下最低,磷利用效率则相反。峨眉冷杉幼苗根际土壤速效磷含量高于非根际土壤,且根际-非根际土壤有效磷含量差值随着磷添加浓度的增加而增加。根区-非根区速效磷含量差值与pH具有显著相关关系,说明根区pH下降是导致峨眉冷杉幼苗根区土壤速效磷含量增加的直接原因之一。根区-非根区草酸含量差值与根区-非根区pH差值具有相关关系,说明根系分泌的有机酸尤其是草酸是导致根区pH下降的直接原因,因而是峨眉冷杉幼苗利用土壤难溶性磷的主要机制。
峨眉冷杉;根际;有机酸;磷素
磷是生物体的重要组成成分,是植物必需的大量元素之一,以广泛多样的形式参与有机体的生命代谢过程。然而,自然条件下土壤中的磷常常以铁/铝氧化物结合态、或者以钙磷的形式沉积的形态存在,因而其生物可利用性往往受限制[1]。正因为如此,磷甚至成为了许多生态系统中最主要的限制因子[2],并对森林更新等造成影响。一些研究表明,由于大气氮沉降的增加,一些本身受到氮限制的生态系统也逐渐转变为受磷限制[3]。
根际是植物根系活动影响最强烈、最直接的土壤微区域,是植物根系吸收养分的直接平台[4]。缺磷条件下,植物可能会通过多种生理机制以适应低磷状态或者以提高对磷的吸收[5]。这些适应机制包括增加根系生物量的比例、增加根系长度、增加根系表面积、降低根区pH等[6],另外还可能会通过根系丛枝菌根、酸性磷酸酶或者通过根系向土壤中释放质子、改变根际土壤pH等方式,以活化难溶态养分[7],从而促进磷素的吸收。研究表明,一些植物种类能够有效利用难利用的有机或者无机磷[8],其中无机磷(即Ca-P、Al-P和Fe-P)的溶解主要是植物根系分泌的有机酸发生作用的结果[9]。例如,白羽扇豆(LupinusalbusL.)能通过分泌大量柠檬酸的方式利用Ca-P[10],木豆 (CajanuscajanL. Millsp.) 能够通过分泌丙二酸、草酸和番石榴酸的方式利用Fe-P和Al-P[11]。相反,有机磷(主要是植酸)的溶解主要是由植物根系分泌的磷酸酶导致的[12]。
峨眉冷杉(A.fabri)是海螺沟冰川退缩区植被演替顶级群落的主要物种,也是青藏高原东缘山区亚高山暗针叶林的优势树种。虽然已有研究发现,Ca-P是该区域土壤磷的主要存在形态[13],但直至目前关于峨眉冷杉对各种形态磷的利用状况还不清楚。峨眉冷杉的正常生长对于维持生态系统碳平衡、调节水文和气候等方面具有重要意义。本文探讨了峨眉冷杉幼苗生物量对不同形态磷的响应以及对磷的吸收特征及需求利用策略,并从不同形态磷作用下峨眉冷杉幼苗根际和非根际土壤速效磷含量差异、土壤pH、根系分泌有机酸及其相互关系等角度对峨眉冷杉幼苗根际土壤速效磷变化以及峨眉冷杉幼苗利用难溶性磷的主要机制进行了分析,旨在为峨眉冷杉对各种形态磷的利用及潜在机制提供科学依据。
1 材料与方法
1.1 实验材料
本研究采用盆栽试验的方式进行。盆栽土壤为采自贡嘎山东坡海拔1850 m的表层土(0~20 cm),土壤类型为发育自石英片层岩和变质砂岩的黄棕壤。去除植物根系、石头及杂物后过4 mm筛。分别添加5种形态的磷: KH2PO4(K-P)、CaHPO4·2H2O (Ca-P)、AlPO4(Al-P)、FePO4·4H2O (Fe-P) 、phytic acid (Py-P)。每种形态磷的添加量均为50 mg P·kg-1干土。充分混匀后陈化1个月。
将大小相近[株高(7.4 ± 1.5)cm,基茎(1.9 ± 0.43)mm]的4年生峨眉冷杉幼苗分别移栽到体积为2.5 L的盆中,每盆5 kg土。另外,为了保证养分平衡,每盆另外以NH4NO3的形式添加200 mg·kg-1氮,以KCl的形式添加320 mg·kg-1钾。
1.2 实验方法
栽种一年后取样,将植物根、茎、叶分离。截取根系末梢3 cm左右用于测定丛植菌根侵染率。茎、叶和余下的根系60 ℃烘干、称重、粉碎、硝酸-高氯酸(3∶1)消解。总N用凯氏法测定[14]、全磷用孔雀石绿显色分光光度法测定[15]。丛枝菌根侵染率通过显微镜观察测定[16]。
每盆用直径为1 cm的土钻在3个位置采集土壤。与植物根系粘结的根际土通过抖落法采集。部分-4 ℃保存,按照Tabatabai and Bremner[17]和Li et al.[18]的方法测定酸性磷酸酶活性。其余土壤风干、过2 mm筛。土壤pH(土∶水=1∶2.5)用pH计测定 (AB15 pH meter, Accumet, Fisher Scientific)。
植物对磷的吸收量通过生物量乘以磷含量的方法计算;磷需求效率为单位重量根系吸收的地上部分磷量;磷利用效率为单位质量的磷产生的生物量。
1.3 数据分析
采用SPSS 19.0进行数据统计与分析。对根际与非根际各测定指标进行配对样本T测验;对全氮、全磷、有机碳、硝态氮、铵态氮、pH 和速效磷进行相关性分析。
2 结果与分析
2.1 峨眉冷杉幼苗生物量对不同形态磷的响应
磷的添加促进了峨眉冷杉幼苗生物量的累积,但累积量随磷形态而不同(F=27.1,P< 0.001)。添加Ca-P时生物量最低,其次是 Al-P、Fe-P、Py-P和 K-P (图1)。K-P、Ca-P、Al-P、Fe-P和Py-P处理下峨眉冷杉幼苗生物量比对照分别增加了129 %、26 %、53 %、78 %和94 %,说明峨眉冷杉幼苗生物量对P的响应程度为K-P> Py-P >Fe-P> Al-P > Ca-P。其原因是K-P能被植物直接吸收利用而Py-P容易被酸性磷酸酶水解从而易被植物利用[19]。添加K-P并未导致峨眉冷杉幼苗叶片中钾含量的显著增加(表1),说明添加K-P条件下较高的生物量是由K-P本身较高的磷养分生物可利用性而不是由其中的钾养分导致的。与Du等[20]对Stylosanthes的研究结果不同,添加Fe-P时峨眉冷杉幼苗生物量增幅大于添加Ca-P时的生物量增幅,说明植物对不同形态磷的响应特征取决于植物的类型。

图1 峨眉冷杉幼苗生物量与不同形态磷的关系Fig.1 The relationship between Abies fabri seedlings biomass and different forms of phosphorus
2.2 植物对磷的吸收特征及需求利用策略
磷形态对峨眉冷杉幼苗根 (F=25.0,P< 0.001)、茎 (F=13.3,P< 0.001) 、叶(F=6.0,P<0.01)磷含量具有显著影响。施加50 mg·kg-1时,峨眉冷杉幼苗根磷、叶磷含量在Fe-P处理下最低,茎磷含量在Ca-P处理下最低(表1),说明与其他形态磷相比,Fe-P最难被峨眉冷杉幼苗吸收。施加Ca-P条件下峨眉冷杉幼苗中相对与施加Fe-P时较高的磷含量并未导致峨眉冷杉幼苗产生较施Fe-P时较大的生物量 (表1)。其原因可能是Ca-P的添加导致了钙在峨眉冷杉幼苗叶片中的累积,从而引起无机磷的在植物叶片中的沉积[21]。
植物从土壤中获取磷并对其进行有效利用以形成生物量是植物适应低磷土壤的的重要特征[22]。本研究中,磷形态(F= 30.5,P< 0.001)对峨眉冷杉幼苗对磷的需求效率具有显著影响。峨眉冷杉幼苗的磷需求效率在K-P处理下最高,在Ca-P和Fe-P处理下最低,磷利用效率则相反(图2)。
2.3 峨眉冷杉幼苗对P的吸收机制
早期研究表明,当植物根系对磷素的吸收大于质流为植物提供的磷素时,往往会在植物根系周围形成磷素耗竭区[23]。土壤中施入不同形态磷之后,无机磷形态会发生变化,这种变化因各种磷源的溶解性及其它物理化学性质的不同而不同[24]。溶解度较高的K-P会向Ca-P/Al-P等有效性相对较差的磷素形态转化;有效性较低的Ca-P、Al-P和Fe-P等大部分主要以自身的形态存在,仅少部分向其他形态的磷转化[25]。本研究中,施加磷后根际速效磷含量均大于非根际,根区-非根区有效磷含量差值在K-P处理下最大,在Ca-P和Al-P处理下最小(表2),说明添加的磷在植物根系的作用下在不同程度的向着植物可利用的形态转化。
酸性磷酸酶和丛枝菌根被认为是植物在低磷条件下增加磷吸收的2个重要机制[26]。本研究中,根区土壤磷酸酶活性显著高于非根区土壤,磷形态 (F= 4.71,P< 0.01)对根际-非根际磷酸酶活性差值以及根系菌根侵染率均有显著影响。然而二者与根区-非根区有效磷含量差值之间并无显著相关关系(表3),说明根区磷酸酶活性合丛枝菌根均不是峨眉冷杉幼苗利用难溶性磷的主要机制。
土壤pH是影响土壤中磷酸盐形态和转化的重要因素,尤其是根际土壤pH的降低有利于难溶性磷酸盐向土壤溶液的释放[27]。本研究中,除不施磷对照外,峨眉冷杉幼苗根区土壤pH均小于非根区土壤(图2)。根区非根区土壤pH差值与根区-非根区速效磷含量差值间具有显著相关关系(R2=0.89,P< 0.05)(表2),说明根区pH下降是导致峨眉冷杉幼苗根区土壤速效磷含量增加的原因之一。

表1 不同磷形态和不同浓度下峨眉冷杉各器官P、K养分含量及N∶P比

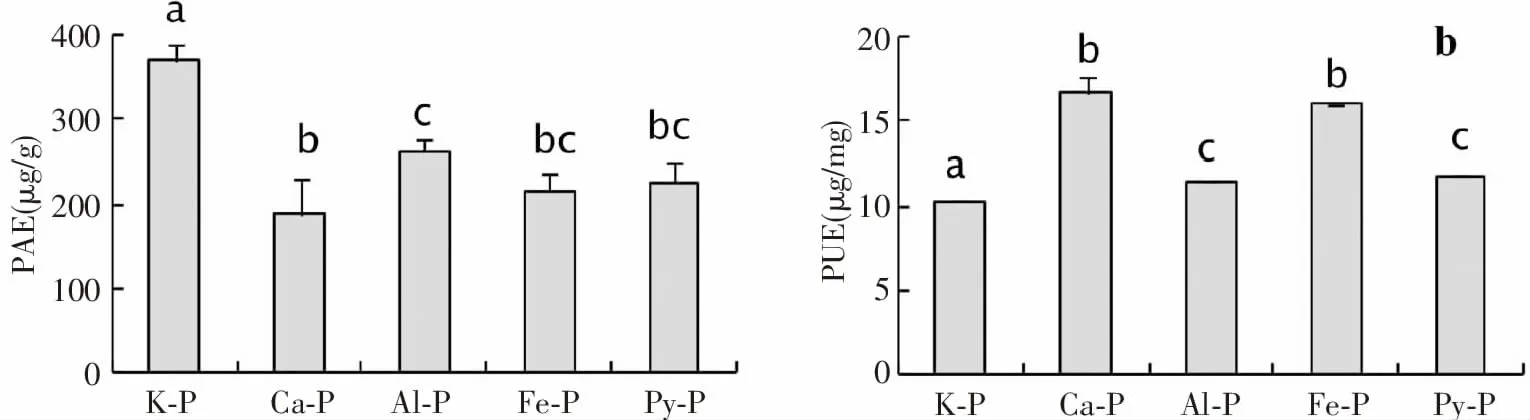
图2 不同形态磷作用下峨眉冷杉幼苗的磷需求和利用效率Fig.2 The usage of phosphorus requirement of Abies fabri seedlings under the action of different forms of phosphorus efficiency
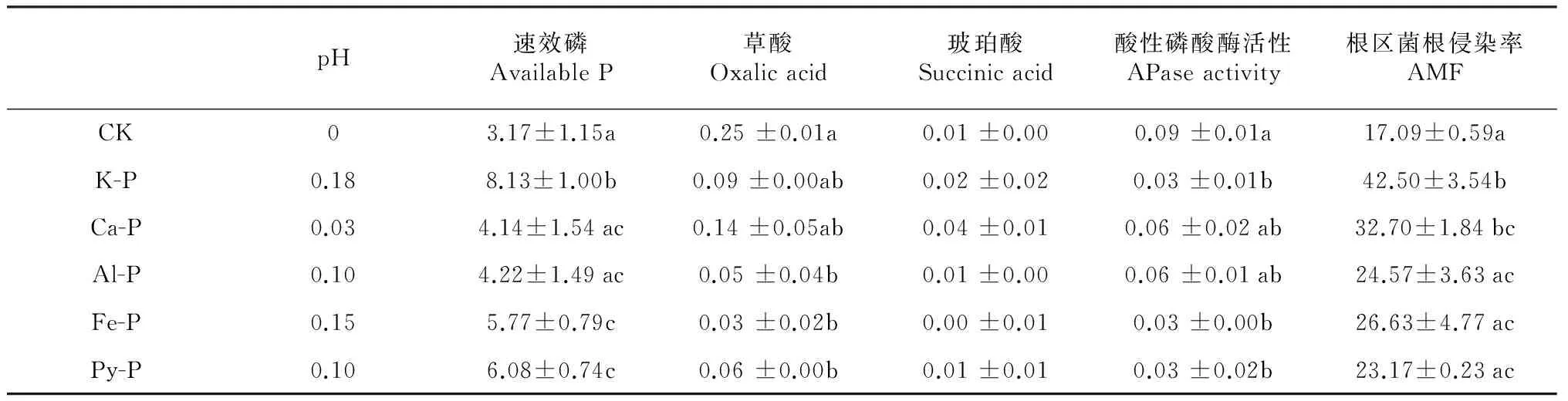
表2 根区-非根区pH、速效磷、有机酸、酸性磷酸酶差值及根区菌根侵染率
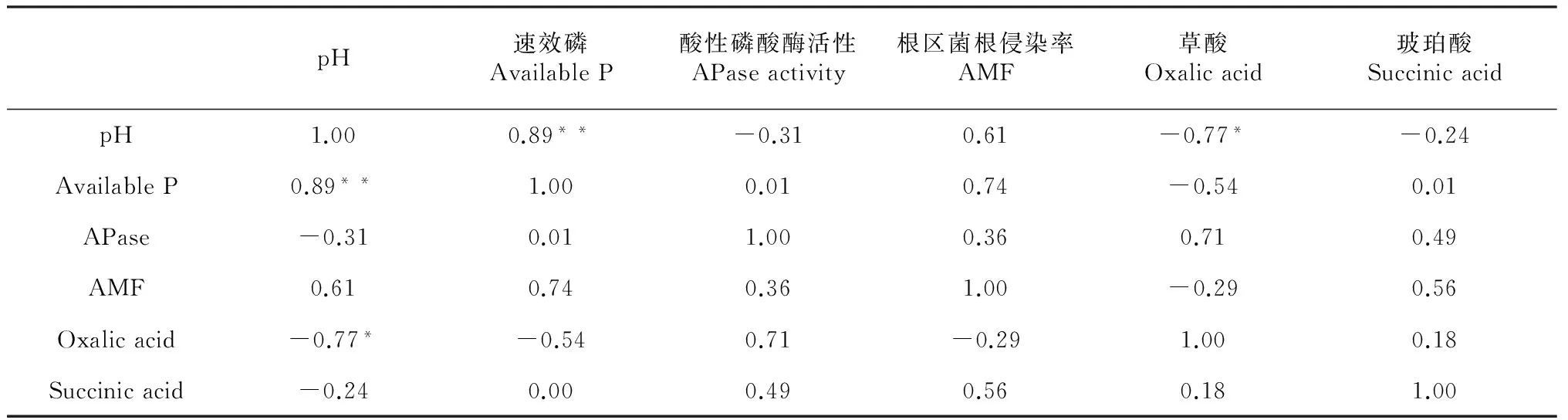
表3 Pearson相关分析
注:*P< 0.01, **P< 0.05。
根系分泌的有机酸不仅可以通过降低根际土壤的pH值、溶解土壤中的铁、铝氧化物的方式活化土壤难溶磷素[28],还可与Fe 、Al 、Ca 等离子形成螯合物通过离子交换等作用增加土壤难溶磷素的释放[29-30],因此被认为是提高非酸性土壤磷素利用的主要机制之一。但有研究表明,不同有机酸对土壤难溶性磷的活化能力不同。陆文龙等[31]发现,有机酸对石灰性土壤磷素的活化能力为草酸≥柠檬酸> 苹果酸> 酒石酸。本研究结果与陆文龙等[31]的研究结果相似,但本研究涉及的6种有机酸组分中,峨眉冷杉幼苗根际土壤中仅草酸和琥珀酸含量高于非根际土草酸和琥珀酸含量,表明峨眉冷杉根系仅能分泌这两种有机酸来活化土壤磷素、促进根系对磷素的吸收。2种有机酸中,草酸含量均大于琥珀酸含量,而且仅草酸含量与根区-非根区pH差值具有相关关系(R2=0.77,P<0.1)(表3),说明草酸是导致峨眉冷杉幼苗根区pH下降的直接原因,因此也是促进峨眉冷杉幼苗根区土壤磷形态转化过程中分泌的最重要的一种有机酸。
3 结 论
(1)磷的添加促进了峨眉冷杉幼苗生物量的累积,但累积量随磷形态而不同(F=27.1,P< 0.001)。添加Ca-P时生物量最低,其次是 Al-P、Fe-P、Py-P和 K-P。K-P、Ca-P、Al-P、Fe-P和Py-P处理下峨眉冷杉幼苗生物量比对照分别增加了129 %、26 %、53 %、78 %和94 %,说明峨眉冷杉幼苗生物量对P的响应程度为K-P> Py-P >Fe-P> Al-P > Ca-P。
(2)磷形态(F= 30.5,P< 0.001)对峨眉冷杉幼苗对磷的需求效率具有显著影响。峨眉冷杉幼苗的磷需求效率在K-P处理下最高,在Ca-P和Fe-P处理下最低,磷利用效率则相反。
(3)不同形态磷作用下,峨眉冷杉幼苗根际速效磷含量均大于非根际,说明添加的磷在植物根系的作用下在向着植物可利用的形态转化。根区非根区土壤pH差值与根区-非根区速效磷含量差值间具有显著相关关系(R2=0.89,P< 0.05),说明根区pH下降是导致峨眉冷杉幼苗根区土壤速效磷含量增加的原因之一。根系分泌的有机酸尤其是草酸在峨眉冷杉幼苗根区磷形态转化中起着重要作用。
[1]J S. Phosphorus dynamics: from soil to plant[J]. Plant Physiology, 2011, 156(3):997-1005.
[2]SHARMAN L. Mechanisms of primary succession following deglaciation at Glacier Bay, Alaska[J]. Ecological Monographs, 1994, 64(2):149-175.
[3]Carmen Blanes M, Emmett B A, Viegla B, et al. Alleviation of P limitation makes tree roots competitive for N against microbes in a N-saturated conifer forest: A test through P fertilization and 15 N labelling[J]. Soil Biology & Biochemistry, 2012:51-59.
[4]董兆佳, 孟 磊. 海南蕉园根际与非根际土壤氮素含量特征[J]. 中国农学通报, 2010, 26(6):309-312.
[5]Tchienkoua, Nolte C, Jemo M, et al. Biomass and Phosphorus Uptake Responses of Maize to Phosphorus Application in Three Acid Soils from Southern Cameroon[J]. Communications in Soil Science & Plant Analysis, 2008, 39(9):1546-1558.
[6]Shen J, Tang C, Rengel Z, et al. Root-induced acidification and excess cation uptake by N2-fixing Lupinus albus grown in phosphorus-deficient soil[J]. Plant and Soil, 2004, 260(1-2): 69-77.
[7]曾曙才, 苏志尧, 陈北光,等. 植物根际营养研究进展[J]. 南京林业大学学报:自然科学版, 2003, 27(6):79-83.
[8]Shibata R, Yano K, Shibata R, et al. Phosphorus acquisition from non-labile sources in peanut and pigeonpea with mycorrhizal interaction[J]. Applied Soil Ecology, 2003,24(2):133-141(9).
[9]Corrales I, Amenós M, Barceló C P J. Phosphorus Efficiency and Root Exudates in Two Contrasting Tropical Maize Varieties[J]. Journal of Plant Nutrition, 2007, 30(6):887-900.
[10]Dinkelaker B, Rõmheld V, Marschner H. Citric acid excretion and precipitation of calcium citrate in the rhizosphere of white lupin (LupinusalbusL.)[J]. Plant, Cell & Environment, 1989, 12(3): 285-292.
[11]Otani T, Ae N, Tanaka H. Phosphorus (P) uptake mechanisms of crops grown in soils with low P status: II. Significance of organic acids in root exudates of pigeonpea[J]. Soil Science and Plant Nutrition, 1996, 42(3): 553-560.
[12]SHINANO, T, OSAKI, et al. Comparison of reconstruction of carbon and nitrogen compounds during germination between gramineae and leguminosae[J]. Soilence & Plant Nutrition, 1991, 37(2):249-258.
[13]Zhou J, Wu Y, Prietzel J, et al. Changes of soil phosphorus speciation along a 120-year soil chronosequence In the Hailuogou Glacier Retreat Area (Gongga Mountain, Sw China)[J]. Geoderma, 2013, 195(1):251-259.
[14]Weinbaum S A, Picchioni G A, Muraoka T T, et al. Nitrogen usage, accumulation of carbon and nitrogen reserves, and the capacity for labelled fertilizer nitrogen and boron uptake varies during the alternate-bearing cycle in pistachio[J]. J. Amer. Soc. Hort. Sci, 1994, 119: 925-930.
[15]Motomizu S, Wakimoto T, Tei K. Spectrophotometric determination of phosphate in river waters with molybdate and malachite green[J]. Analyst, 1983, 108(1284): 361-367.
[16]Chen X, Tang J, Zhi G, et al. Arbuscular mycorrhizal colonization and phosphorus acquisition of plants: effects of coexisting plant species[J]. Applied Soil Ecology, 2005, 28(3): 259-269.
[17]Tabatabai M A, Bremner J M. Use of p-nitrophenyl phosphate for assay of soil phosphatase activity[J]. Soil Biology and Biochemistry, 1969, 1(4): 301-307.
[18]Yong-Fu L I, An-Cheng L U O, Xing-Hua W E I, et al. Changes in phosphorus fractions, pH, and phosphatase activity in rhizosphere of two rice genotypes[J]. Pedosphere, 2008, 18(6): 785-794.
[19]Tarafdar J C, Claassen N. Preferential utilization of organic and inorganic sources of phosphorus by wheat plant[J]. Plant and Soil, 2005, 275(1-2): 285-293.
[20]Du Y M, Tian J, Liao H, et al. Aluminium tolerance and high phosphorus efficiency helps Stylosanthes better adapt to low-P acid soils[J]. Annals of Botany, 2009: mcp074.
[21]Marschner H. Marschner's mineral nutrition of higher plants[M]. Academic Press, 2012.
[22]Pang J, Ryan M H, Tibbett M, et al. Variation in morphological and physiological parameters in herbaceous perennial legumes in response to phosphorus supply[J]. Plant and Soil, 2010, 331(1-2): 241-255.
[23]Barber S A. Soil nutrient bioavailability: a mechanistic approach [M]. New York: John Wiley, 1995.
[24]李有田, 庞荣丽, 介晓磊, 等. 低分子量有机酸对石灰性潮土磷吸附与解析的影响[J]. 河南农业大学学报, 2002(2): 133-137.
[25]庞荣丽, 介晓磊, 方金豹, 等. 有机酸对不同磷源施入石灰性潮土后无机磷形态转化的影响[J]. 植物营养与肥料学报, 2007, 13: 39-43.
[26]Mortimer P E, Archer E, Valentine A J. Mycorrhizal C costs and nutritional benefits in developing grapevines[J]. Mycorrhiza, 2005, 15(3): 159-165.
[27]刘世亮, 介晓磊, 李有田,等. 土壤-植物根际磷的生物有效性研究进展[J]. 土壤与环境, 2002, 11(2):178-182.
[28]Traina S J, G Sposito, D Hesterberg,et al. Effects of organic acids on orthophosphate solubility in an acidic, montmorillonitic soil[J ]. Soil Sci. Soc. Am. J., 1986, 50: 45-52.
[29]F. Johnson J, L. Allan D, P. Vance C. Phosphorus Stress-Induced Proteoid Roots Show Altered Metabolism in Lupinus albus.[J]. Plant Physiology, 1994, 104(2):657-665.
[30]王瑞琳,刘金宇,郭天荣.铝毒和低磷胁迫对水稻幼苗生长·根系有机酸分泌的影响[J].安徽农业科学,2014,42(6):1603-1606.
[31]陆文龙, 王敬国, 曹一平,等. 低分子量有机酸对土壤磷释放动力学的影响[J]. 土壤学报, 1998(4):493-500.
(责任编辑 李 洁)
Absorption and Utilization Characteristics and Potential Mechanism of P ofAbiesfabriSeedlings
QIU Yang1,WU Yang-hong2,SUN Shou-qin2,SHANG Hong-li1 *
(1.School of Life Science,Sichuan Normal University,Sichuan Chengdu 610101,China; 2.Key Laboratory of Mountain Surface Processes and Ecological Regulation,Institute of Mountain Hazards and Environment,Chinese Academy of Sciences,Sichuan Chengdu 610041,China)
Sampling potted test of way was adopted, under the action of different forms of phosphorus inAbiesfabriresponses of seedling biomass, root zone soil available phosphorus content change and its soil pH and organic acid in root exudates ofAbiesfabriin the context of the relationship between seedling characteristics to study p uptake and utilization of potential mechanisms. Results showed that the phosphorus promoted the accumulation of biomass of seedlings ofAbiesfabri, but the cumulative amount of phosphorus formed in different (F=27.1,P< 0.001). Added Ca-P biomass in the lowest, followed by Al-P, and Fe-P, Py-P and K-P. Phosphorus (F=30.5,P< 0.001) on seedlings ofAbiesfabrihad a significant impact on phosphorus efficiency of demand. Seedlings ofAbiesfabriphosphorus efficiency in K-P treatment of the demand the highest in the Ca-P and Fe-P under the lowest phosphorus use efficiency was the opposite.Abiesfabriseedlings in rhizosphere soil available phosphorus content was higher in rhizosphere soil, rhizosphere and non-rhizosphere soil available phosphorus value increase with increase in phosphorus concentration. Root zone-available phosphorus content of the root zone difference had significant correlation with pH, pH decline that root zone was the root seedlings ofAbiesfabridirect cause of soil available phosphorus content increased in the region. Root of the root zone of oxalic acid content difference and non-difference of rhizosphere pH were correlated, description of organic acids in root exudates, especially oxalic acid was the direct reason leading to lower rhizosphere pH, thus seedlings ofAbiesfabriinsoluble phosphorus in soil of main mechanisms.
Abiesfabri;Rhizosphere;Organic acid;Phosphate
1001-4829(2016)07-1682-05
10.16213/j.cnki.scjas.2016.07.033
2015-06-01
国家自然科学基金面上项目(41273096);中国科学院知识创新工程重要方向项目(Grant no. KZX2-YW-331-2)
邱 阳(1991-),男,四川达州人,硕士研究生,研究方向为环境生态学,E-mail:skyqiuyang@163.com,*为通讯作者,E-mail:csshanghongli@yeah.net。
S718
A

