珍稀树种花榈木组培不同外植体的无菌繁殖体系构建
乔 栋,韦小丽,李 群
(贵州大学 林学院,贵阳 贵州 550025)
珍稀树种花榈木组培不同外植体的无菌繁殖体系构建
乔 栋,韦小丽*,李 群
(贵州大学 林学院,贵阳 贵州 550025)
为构建花榈木组织培养的无菌繁殖体系,采用随机区组试验方法研究不同药剂组合对其籽苗茎段、幼苗茎段和叶片、成年植株茎段和嫩叶等外植体的消毒效果。结果表明:籽苗茎段以70 %乙醇消毒30 s+0.1 %升汞灭菌8 min+培养基中添加PPM 0.5 mL/L的消毒效果最好;幼苗外植体最佳采集时间为4月,茎段用70 %乙醇浸泡30 s+(50 mg/L利福平+50 mg/L氯霉素)混合液浸泡30 min+0.1 %升汞浸泡8 min消毒效果最好,叶片用70 %乙醇浸泡30 s+(50 mg/L利福平+50 mg/L氯霉素)混合液浸泡30 min+0.1 %升汞浸泡6 min消毒效果最好;成年植株叶片以4月采集较好,最佳消毒方法为70 %乙醇浸泡30 s+(50 mg/L利福平+50 mg/L氯霉素)混合液浸泡30 min+0.1 %升汞浸泡12 min,成年植株茎段尚未取得理想消毒效果。
花榈木;外植体;消毒方法
花榈木(OrmosiahenryiPrain)为豆科(Leguminosae)红豆属(Ormosia)常绿乔木,又名花梨木,属国家二级重点保护植物和珍贵用材树种[1]。由于花榈木野生植株稀少,结实困难,结实率及种子繁殖系数低[2],因而建立花榈木组织培养快繁体系、扩大其繁殖系数对保护花榈木野生资源,提高人工培育种苗的繁殖效率具有重要意义。
有关花榈木组织培养技术的相关研究已有文献报道。姚军等[3]采用花榈木种子无菌萌发获得的带叶茎段进行组织培养研究;高丽等[4]采用花榈木种子无菌萌发获得的胚轴进行组织培养及后续的耐冷性诱导。然而,目前已有研究采用的外植体均来源于种子无菌萌发材料,尚未见有关采用花榈木自然萌发植株和成年植株外植体进行组培的报道,在繁殖材料方面存在局限性。其原因可能是自然萌发植株和成年植株外植体内生菌多,无菌培养体系建立困难[5-8]。为此,笔者以自然条件下生长的花榈木植株的籽苗茎段、幼苗茎段和嫩叶、成年植株茎段和嫩叶作外植体,采用随机区组试验方法研究各消毒剂不同消毒时间组合对花榈木不同外植体的消毒效果,旨在寻求花榈木不同外植体的有效消毒方法,扩大组织培养外植体的来源,为花榈木组织培养中无菌繁殖体系的建立提供依据。
1 材料与方法
1.1 供试材料
1.1.1 外植体 花榈木籽苗茎段、幼苗茎段和叶片、成年植株茎段和嫩叶,其中籽苗茎段来源于气候箱内播种萌发10 d的花榈木籽苗,剪取3 cm长茎段(带顶芽)做外植体;幼苗外植体取自贵州大学苗圃当年生播种苗,分别于4、8和12月剪取带顶芽长约6 cm的茎段(带1~2个侧芽,不带叶片)作为外植体;成年植株外植体取自贵州大学苗圃7年生及农场20年生花榈木带顶芽枝条,分别于4、8和12月剪取当年生长约20 cm半木质化枝条进行试验。将各种茎段剪成1.5 cm长带顶芽或带侧芽茎段(不带叶片),将幼苗和成年植株茎段上的当年生叶片切成1 cm×1 cm大小作为外植体。
1.1.2 试剂 植物组培抗菌剂(PPM)、利福平、链霉素和氯霉素,美国Phytotech公司生产,购自北京西美杰公司。启动培养基自制,配方为MS+6-BA 2.0 mg/L+NAA 1.0 mg/L+琼脂8 g/L+蔗糖30 g/L,pH 5.8~6.0。
1.1.3 仪器与设备 LDZX-50E高压灭菌锅,SW-CJ-1D单人超净工作台。
1.2 方法
1.2.1 材料预处理 分别将采集的籽苗外植体、幼苗外植体和成年植株外植体用洗涤剂浸泡15 min、30 min和1 h,然后在流水下分别冲洗30 min、1 h和2 h,并用牙刷轻轻刷洗,成年植株外植体需去除表面绒毛。之后所有材料在超净工作台内用70 %乙醇浸泡30 s,用无菌水冲洗2~3次后备用。
1.2.2 试验设计 试验设16个处理(表1)。供试材料分别按表1进行消毒并用无菌水冲洗4~5次后接种到启动培养基中,每个处理接种15瓶,每瓶接种外植体1个。接种后置(25±2)℃、光照强度3 000 lx下培养,光照时间12 h/d条件下培养。
1.2.3 测定内容 接种后每天观察、记录材料污染情况,并统计污染率、存活率、诱导率和灭菌有效值。
污染率=(污染数/接种数)×100%
存活率=(存活数/接种数)×100%
诱导率=(成功诱导数/存活数)×100%
灭菌有效值=(1-污染率)×成活率×诱导率×100%
1.3 数据统计与分析
采用Excel 2007进行数据的统计与分析。
2 结果与分析
2.1 籽苗茎段的消毒效果
由表2可知,以籽苗茎段为外植体的各处理中,处理3和处理4的污染率低,灭菌有效值为44.45%~87.10 %;处理3消毒效果优于处理2;培养基中添加PPM的处理4其外植体的污染率显著降低,仅为6.67 %,存活率显著提高,达93.33 %,比未添加PPM的处理3提高26.66 %。因此,对籽苗茎段而言,用70 %乙醇浸泡30 s+0.1 %升汞浸泡8min+PPM消毒效果最好。

表1 花榈木不同外植体的消毒方法
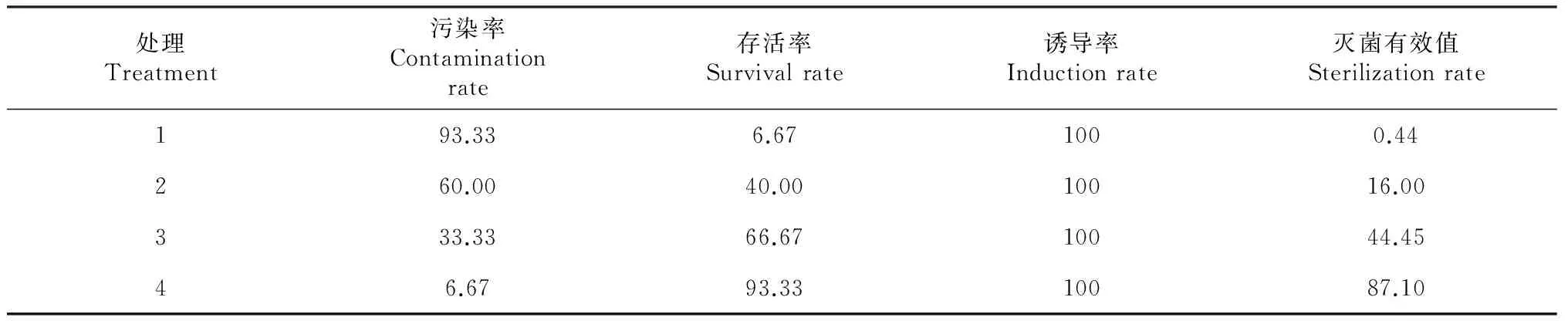
表2 不同处理花榈木籽苗茎段的消毒效果
2.2 幼苗外植体的消毒效果
2.2.1 叶片 从表3可知,以幼苗叶片为外植体,4月采集的幼苗叶片,污染率和存活率相对较低,为0~40 %;诱导率(处理13和处理16除外)较高,为50 %~100 %;8和12月采集的叶片,尽管存活率高,为70 %~100 %,但诱导率均为0。用(100 mg/L苯菌灵+100 mg/L链霉素)混合液浸泡30 min(处理11~13)与(50 mg/L利福平+50 mg/L氯霉素)混合液浸泡30 min(处理14~16)均能有效降低4月采集幼苗叶片的污染率,其污染率均为0,低于处理9和处理10,但其存活率降低。处理11~16抗菌素用量产生的效果差异不明显,外植体存活率和诱导率均随升汞处理时间增加而降低,其中以处理14的消毒效果最好,存活率和诱导率分别为33.33 %和60 %,灭菌有效值达19.99 %。因此,4月采集的幼苗叶片外植体最佳处理方式为70 %乙醇浸泡30 s+(50 mg/L利福平+50 mg/L氯霉素)混合液浸泡30 min+0.1 %升汞浸泡6 min。
2.2.2 茎段 从表3还可知,不同时期采集茎段的污染率(处理9除外)依次为4月>8月>12月,但大多数消毒处理的污染率差异不明显,处理9~16的污染率平均值比较接近。与叶片消毒相比,处理9~16的消毒方法均可对茎段产生较好效果。说明,幼苗茎段外植体对取材时间没有叶片要求严格。外植体存活率(处理11除外)则表现为12月>8月>4月。可能与4月幼苗茎段较幼嫩有关。诱导率以4月最高,平均诱导率为70.86 %,12月次之,平均诱导率为58.67 %, 8月最低,平均诱导率为55.71 %。外植体存活率和诱导率均随升汞处理时间增加而降低。从灭菌有效值看,各月采集的材料以处理9、处理10和处理15的效果较好。但需要注意的是,虽然8月及12月的外植体材料灭菌有效值高于4月,但外植体诱导产生的愈伤组织较少且容易褐化。因此,建议4月采集的茎段用处理10消毒,即70 %乙醇浸泡30 s+0.1 %升汞浸泡6 min+培养基中添加PPM;8月和12月采集的茎段用处理15消毒,即用70 %乙醇浸泡30 s+(50 mg/L利福平+50 mg/L氯霉素)混合液浸泡30 min+0.1 %升汞浸泡8 min消毒。
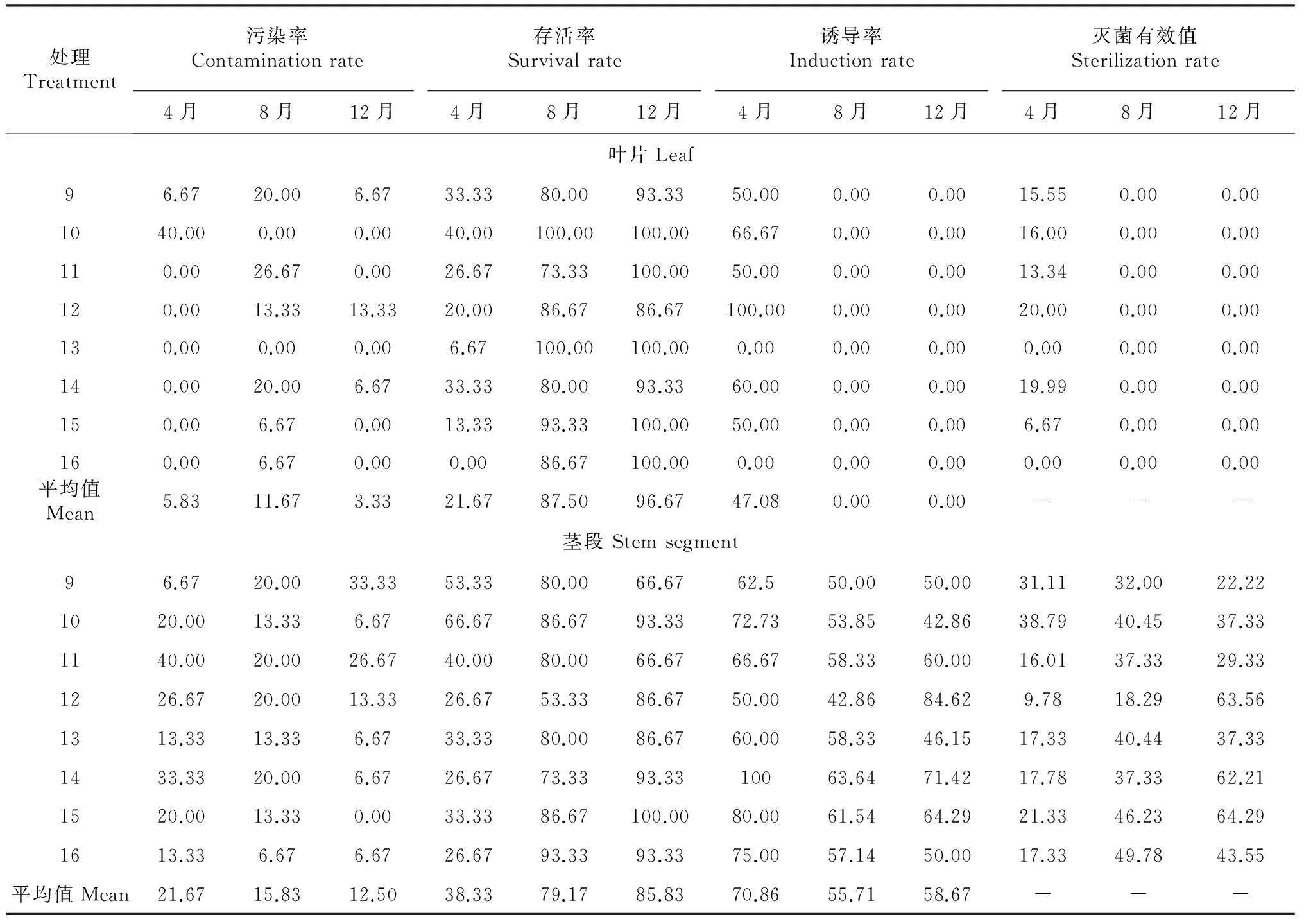
表3 不同处理花榈木当年生幼苗叶片和茎段的消毒效果
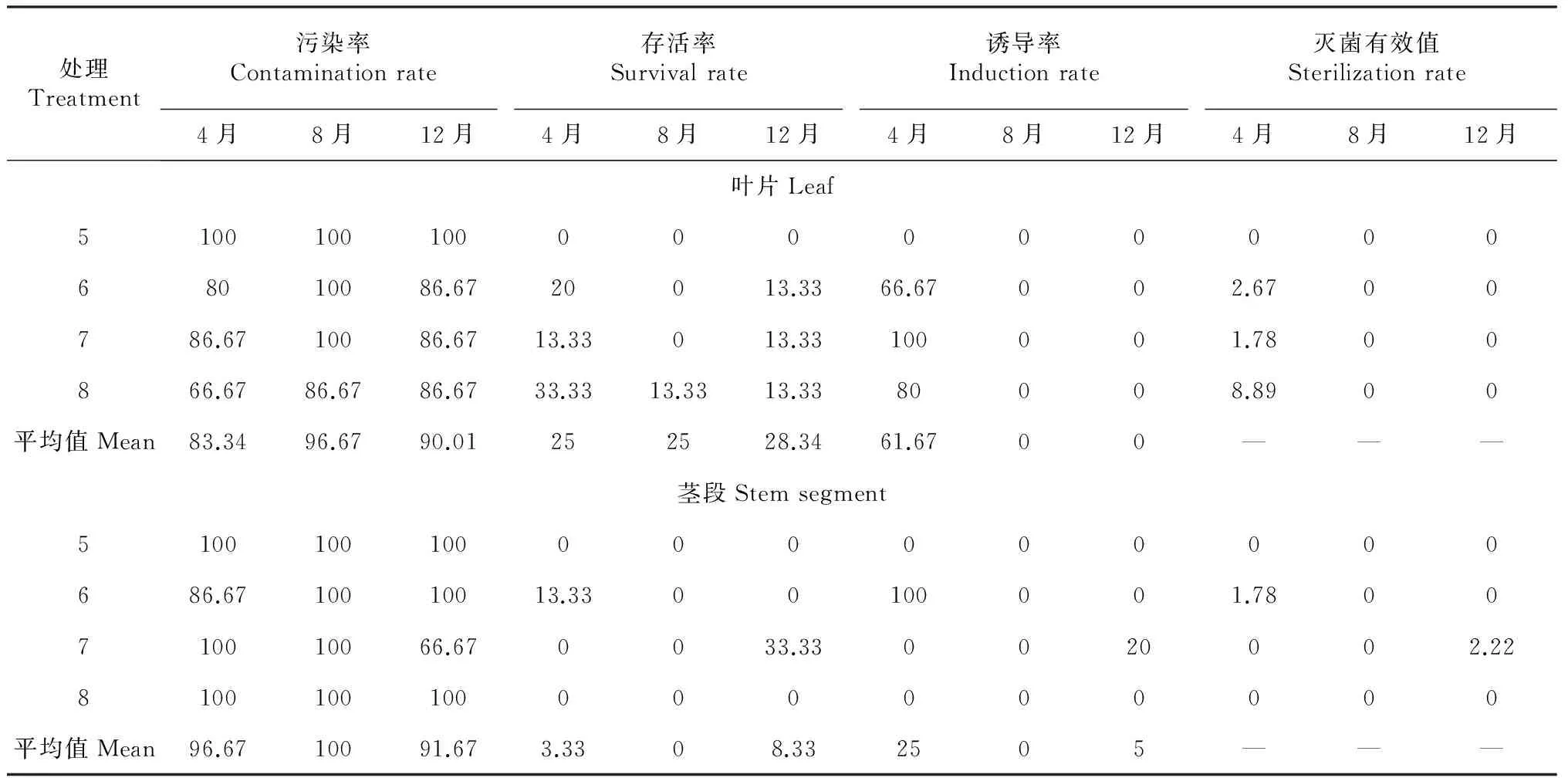
表4 不同处理花榈木成年植株叶片和茎段的消毒效果
2.3 成年植株外植体
2.3.1 叶片 从表4可知,不同时期采集的成年植株外植体其污染率依次为8月>12月>4月,8月的叶片带菌多,灭菌困难。与幼苗叶片相比,成年植株叶片消毒困难,即使是4月采集的叶片外植体,污染率也在60 %以上,培养基中添加PPM 0.5 mL/L的灭菌效果仍然很差。处理5~9以处理8的灭菌效果较好,添加抗菌剂处理后,其污染率为66.67 %,存活率为33.33 %,诱导率为80 %,灭菌有效值为8.89 %。因此,用成年植株叶片外植体,以4月采集为宜,其最佳消毒及诱导处理方式为70 %乙醇浸泡30 s+(50 mg/L利福平+50 mg/L氯霉素)混合液浸泡30 min+0.1 %升汞浸泡12 min。
2.3.2 茎段 从表4还可知,成年植株茎段外植体消毒比其叶片更困难。其中,4和12月采集的茎段相对带菌较少,其污染率低于60 %,8月的带菌最多,无论哪种灭菌处理均全部污染。成年植株茎段消毒效果以12月采集茎段用处理7消毒的灭菌效果较好,污染率为63.67 %,存活率为33.33 %。但从诱导率看,以4月采集茎段采用处理6(在培养基中添加PPM 0.5 mL/L)消毒的灭菌效果较好,诱导率达100 %。从灭菌有效值看,处理6和处理7的灭菌效果均较差。
3 结论与讨论
在植物组织培养过程中,无菌培养体系的建立是获得组培苗的重要环节。该试验结果表明,籽苗外植体以70 %乙醇消毒30 s+0.1 %升汞灭菌8 min+70 %乙醇消毒30 s+培养基中添加PPM 0.5 mL/L的消毒效果最好;幼苗外植体以4月采集较好,其幼苗茎段用70 %乙醇浸泡30 s+(50 mg/L利福平+50 mg/L氯霉素)混合液浸泡30 min+0.1 %升汞浸泡8 min的消毒效果最好,幼苗叶片用70 %乙醇浸泡30 s+(50 mg/L利福平+50 mg/L氯霉素)混合液浸泡30 min+0.1 %升汞浸泡6 min消毒效果最好。成年植株叶片外植体以4月采集较好,最佳消毒方法为70 %乙醇浸泡30 s+(50 mg/L利福平+50 mg/L氯霉素)混合液浸泡30 min+0.1 %升汞浸泡12 min。
研究发现,采用抗菌剂(50 mg/L利福平+50 mg/L氯霉素)混合液及(100 mg/L苯菌灵+100 mg/L链霉素)混合液浸泡对花榈木幼苗叶片、茎段和成年植株叶片消毒均能起到较好的灭菌效果,污染率较低,其成活率和诱导率均较高。
在培养基中添加PPM只在籽苗茎段灭菌中具有良好效果,对于幼苗及成年植株叶片和茎段的灭菌效果并不显著。在植物组织培养中使用抗菌剂成本较高,应谨慎考虑其适用范围。
不同取材部位及取材时间对外植体的消毒难易程度有极大影响[9-13]。取材时间对多数植物的组织培养都有一定的影响[14-17]。该研究发现,4月及12月采集的外植体其消毒效果优于8月,可能与4月之后温度上升导致菌类活跃性上升有关。另外,由于4月植物生长较旺盛,因而此时取材的外植体诱导效果更好。同时,消毒时选用幼嫩叶片及带顶芽茎段比下部茎段消毒效果更好。因为其生长时间不长,杂菌等附着物较少,因而较容易灭菌。但花榈木成年植株茎段的消毒仍有待进一步研究。
[1]段如雁,韦小丽,孟宪帅. 不同光照条件下花榈木幼苗的生理生化响应及生长效应[J]. 中南林业科技大学学报,2013,33(5):30-34.
[2]邓 兆,韦小丽,孟宪帅, 等. 花榈木种子休眠和萌发的初步研究[J]. 贵州农业科学,2011, 39(5):69-72.
[3]姚 军,李洪林,杨 波. 花榈木的组织培养和快速繁殖[J]. 植物生理学通讯,2007,43(1):123-124.
[4]高 丽,李洪林,杨 波. 花榈木胚轴愈伤组织的诱导及植株再生[J]. 安徽农业科学,2009, 37(33): 16271-16273.
[5]王子成,李忠爱,邓秀新. 柑橘成年态茎段外植体消毒方法研究[J]. 河南大学学报:自然科学版,2005,35(2):57-60.
[6]吴坤林,曾宋君,张志胜,等. 番木瓜外植体消毒方法研究[J]. 福建林业科技,2008,35(3):76-79,83.
[7]冯金玲,陈 辉,杨志坚,等. 锥栗组织培养外植体消毒和选择[J]. 福建林学院学报,2006,26(1):22-25.
[8]李 键,李建鹃,吴承祯,等. 雷公藤组织培养外植体消毒和选择[J]. 中南林业科技大学学报,2010,30(8):18-21.
[9]王 波,刘德江,邵 红,等. 组织培养的消毒技术和污染的防治技术[J]. 农业工程技术:温室园艺,2013(7):34-36.
[10]林 妃,李敬阳,常胜合,等. 花梨木组织培养外植体消毒方法初步探讨[J]. 基因组学与应用生物学,2013,32(4):522-525.
[12]郭 梁,晋学娟,陈学森,等. 欧洲甜樱桃茎段离体培养污染率控制方法的研究[J]. 山东农业科学,2009(2):30-33.
[13]吕亚凤,赖钟雄. 不同外植体对厚荚相思试管苗增殖系数和玻璃化的影响[J]. 福建农业科技,2010(5):20-22.
[14]马 琳,何丽娜,姜 岩,等. 锯叶班克木Banksia serrata外植体的选择及消毒方法的研究[J]. 中南林业科技大学学报,2011,31(12):133-137.
[15]马玲玲,王 鹏,王淑安,等. 取材时间和激素对“豫楸1号”腋芽诱导的影响[J]. 北方园艺,2014(13):84-87.
[16]陈 峰.臭椿组培快繁技术体系的建立[D]. 南京:南京林业大学,2013.
[17]于 传. 美国红枫(Acerrubrum)的组织培养技术体系研究[D]. 重庆:西南大学,2013.
(责任编辑 王 海)
Establishment of Sterile Propagation System of Different Explant for Rare SpeciesOrmosiahenryiin Tissue Culture
QIAO Dong, WEI Xiao-li*,LI Qun
(Forest College, Guizhou University, Guizhou Guiyang 550025, China)
In order to establish the sterile system ofO.henryifor tissue culture, stem segment of ten days seedling, leaf and stem segment of seedling and adult tree were used to study the sterilization effects of different combination of reagent on the tissue culture through a random block experiment. Results: 70 % alcohol soak 30 s+0.1 % HgCl2soak 8 minutes+PPM 0.5 mL/L have the best sterilization effect for stem segment of ten days seedling. The optimum collecting time of seedling explant is April, the optimum sterilization method of leaf for seedling and stem segment for seedling are 70 % alcohol soak 30 s+(50 mg/L Rifampicin+50 mg/L Chloramphennicol)+0.1 % HgCl2soak 6 minutes and 70 % alcohol soak 30 s+(50 mg/L Rifampicin+50 mg/L Chloramphennicol)+0.1 % HgCl2soak 8 minutes. The optimum collecting time of leaf explant for adult tree is April, and the best sterilization method is 70 % alcohol soak 30 s+(50 mg/L Rifampicin+50 mg/L Chloramphennicol)+0.1 % HgCl2soak 12 minutes, but the stem segment of adult tree has not achieved optimum sterilization effect.
Ormosiahenryi; Explant; Sterilization method
1001-4829(2016)07-1719-05
10.16213/j.cnki.scjas.2016.07.039
2015-10-13
国家自然科学基金“花榈木根瘤菌多样性及幼苗形成调控因素研究”(31460193);贵州省国际合作项目“珍贵用材树种花榈木精准化容器育苗理论与技术研究”[G字(2012)7012];贵州省林业厅重大攻关“贵州优质阔叶用材树种培育技术与示范”[黔林科合(2010)重大02号];贵州大学研究生创新基金“组培过程中不同家系花榈木的影响探究”(贵大研农2015003);贵州大学SRT项目“花榈木组织培养外植体的灭菌技术探讨”[贵大SRT字(2014)113号]
乔 栋(1991-),男,在读硕士,研究方向:林木植物组织培养,E-mail:610064918@163.com,*为通讯作者。
S792.99;Q813.1+2
A

