降钙素基因相关肽对MC3T3-E1成骨细胞氧化损伤的保护作用研究
郭俊峰 张慧宇 张纲 安洋 杨阳 王飞 谭颖徽
第三军医大学新桥医院口腔颌面外科,重庆 400037
降钙素基因相关肽对MC3T3-E1成骨细胞氧化损伤的保护作用研究
郭俊峰 张慧宇 张纲 安洋 杨阳 王飞 谭颖徽
第三军医大学新桥医院口腔颌面外科,重庆 400037
目的 探讨降钙素基因相关肽(CGRP)对MC3T3-E1成骨细胞氧化损伤的保护作用及其潜在机制。方法 1)构建细胞氧化损伤模型,将实验分为4组,H2O2组使用含不同浓度(10-1、10-2、10-3、10-4、10-5mol·L-1)H2O2的培养液,CGRP+H2O2组使用含不同浓度(10-6、10-7、10-8、10-9、10-10mol·L-1)CGRP的培养液预处理后再加入含
降钙素基因相关肽; 成骨细胞; 氧化损伤; 超氧化物歧化酶; 活性氧
颌面部的创伤和骨折在现代社会中很常见[1]。骨创伤愈合本身是一个受多种因子、信号、激素等精密调控的复杂的生理过程。其中,活性氧(reactive oxygen species,ROS)的产生在骨折的发生及修复过程中起到重要的调节作用[2]。真核细胞在正常代谢中均能产生ROS[3];但过剩的ROS所造成的氧化应激反而会导致许多疾病的发生。过氧化氢(H2O2)是主要的活性氧之一,能穿透生物膜导致细胞的膨胀破裂,损伤线粒体,造成细胞器和蛋白质的功能异常,从而对宿主细胞造成广泛性的伤害。研究[4]表明,骨折发生时不仅会释放大量的炎症介质,同时组织内的ROS水平也会显著增高;骨细胞在这样的环境下功能会受到损伤,这也将严重影响骨的修复与愈合。
研究[5]证实,神经系统参与骨重塑。降钙素基因相关肽(calcitonin gene-related peptide,CGRP)作为骨组织中分布最为广泛的神经肽,被认为是骨的天然活化剂,它的潜在治疗作用越来越受到广泛的关注。CGRP是由特定神经元的可变剪接生成的37个氨基酸所组成的[6],其受体属于G蛋白偶联家族成员。骨创伤后,在创伤周围的末梢神经会分泌大量CGRP颗粒,且与其他神经肽类物质参与损伤修复和组织重建[7]。在体外实验中,CGRP不仅能够促进成骨细胞的增殖和分化,同时还能抑制破骨细胞的增殖;体内实验中,CGRP能促进骨折或者其他外伤的愈合。此外,CGRP还能抑制成骨细胞的凋亡[8]。通过这些结果,笔者推测CGRP对成骨细胞具有潜在的保护作用,那么在成骨细胞受到氧化损伤的过程中,CGRP是否还能够对成骨细胞的生物学活性起到积极的作用呢?本实验对此进行研究,观察CGRP对H2O2刺激下MC3T3-E1成骨细胞增殖的影响,以及CGRP对MC3T3-E1成骨细胞氧化损伤的保护作用,旨在进一步了解骨创伤愈合机制以及CGRP在其中扮演的重要角色,以期为今后治疗颌骨骨创伤提供新的思路和方向。
1 材料和方法
1.1 主要试剂
MC3T3-E1成骨细胞(中国科学院细胞库);MEMα培养基、优质胎牛血清、双抗、胰蛋白酶(Gibco公司,美国),PBS缓冲液干粉(武汉博士德生物工程有限公司),30%过氧化氢(重庆川东化工集团有限公司)、CGRP(Sigma公司,美国)、CCK-8试剂盒(上海碧云天生物技术有限公司)、超氧化物歧化酶(superoxide dismutase,SOD)、ROS测定试剂盒(南京建成生物工程研究所)、小鼠肿瘤坏死因子(tumor necrosis factor,TNF)-α、白细胞介素(interleukin,IL)-1β、IL-6定量分析酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)试剂盒(上海巧伊生物科技有限公司)。
本实验采用第3代MC3T3-E1 成骨细胞。
1.2 构建细胞氧化损伤模型及CCK-8法检测细胞增殖活性
取生长状态良好、处于对数生长期的MC3T3-E1成骨细胞以5×103个·mL-1的密度接种于96孔板内,置于37 ℃、5%CO2培养箱中培养24 h,使细胞充分贴壁后随机分组处理。实验分为4组:对照组,H2O2组,CGRP+H2O2组,空白组。每组设3个平行孔。H2O2组:又分为5个小组,分别加入含不同浓度(10-1、10-2、10-3、10-4、10-5mol·L-1)H2O2的培养液100 μL;CGRP+H2O2组:又分为5个小组,分别使用含不同浓度(10-6、10-7、10-8、10-9、10-10mol·L-1)CGRP的培养液100 μL预处理1 h,再加入含10-4mol·L-1H2O2的培养液100 μL;对照组:加入常规培养液100 μL;空白组:用于调零,不接种细胞,仅加入常规培养液100 μL。将96孔板置于培养箱中继续培养12、24、36、48 h后弃去上清液,每孔加入10 μL CCK-8溶液和90 μL PBS缓冲液,轻微振荡混匀后继续孵育1 h,测定450 nm波长下的吸光度值,重复实验3次,筛选最佳建模浓度和CGRP对成骨细胞氧化损伤的最佳保护浓度。
1.3 SOD活性测定
将MC3T3-E1成骨细胞接种于6孔板中,细胞密度为每孔3×106个,置于37 ℃、5%CO2培养箱中培养24 h,使细胞充分贴壁。实验分为4组,CGRP+ H2O2组使用含10-8mol·L-1CGRP的培养液1 mL预处理1 h,然后再加入含10-4mol·L-1H2O2的培养液1 mL;H2O2组中加入含10-4mol·L-1H2O2的培养液2 mL;CGRP组中加入含10-8mol·L-1CGRP的培养液2 mL;对照组中加入常规培养液2 mL。培养48 h后,收集细胞,按SOD测定试剂盒说明书进行操作,重复实验3次。
1.4 ELISA法检测炎症因子TNF-α、IL-1β、IL-6水平
将MC3T3-E1成骨细胞接种于6孔板中,细胞密度为每孔3×106个,置于37 ℃、5%CO2培养箱中培养24 h,使细胞充分贴壁。实验分为4组,CGRP+H2O2组使用含10-8mol·L-1CGRP的培养液1 mL预处理1 h,然后再加入含10-4mol·L-1H2O2的培养液1 mL;H2O2组中加入含10-4mol·L-1H2O2的培养液2 mL;CGRP组中加入含10-8mol·L-1CGRP的培养液2 mL;对照组中加入常规培养液2 mL。培养48 h后,收集细胞培养液上清,按小鼠TNF-α、IL-1β、IL-6定量分析ELISA试剂盒说明书进行操作,重复实验3次。
1.5 ROS含量的测定
将MC3T3-E1成骨细胞接种于6孔板中,细胞密度为每孔3×106个,置于37 ℃、5%CO2培养箱中培养24 h,使细胞充分贴壁。实验分为4组,CGRP+H2O2组使用含10-8mol·L-1CGRP的培养液1 mL预处理1 h,然后再加入含10-4mol·L-1H2O2的培养液1 mL;H2O2组中加入含10-4mol·L-1H2O2的培养液2 mL;CGRP组中加入含10-8mol·L-1CGRP的培养液2 mL;对照组中加入常规培养液2 mL。培养48 h后,按ROS测定试剂盒说明书进行操作,重复实验3次。
1.6 统计学分析
采用SPSS 19.0软件对数据进行t检验和单因素方差分析,检验水准为双侧α=0.05。
2 结果
2.1 细胞增殖活性
各组的细胞增殖活性见图1、2。
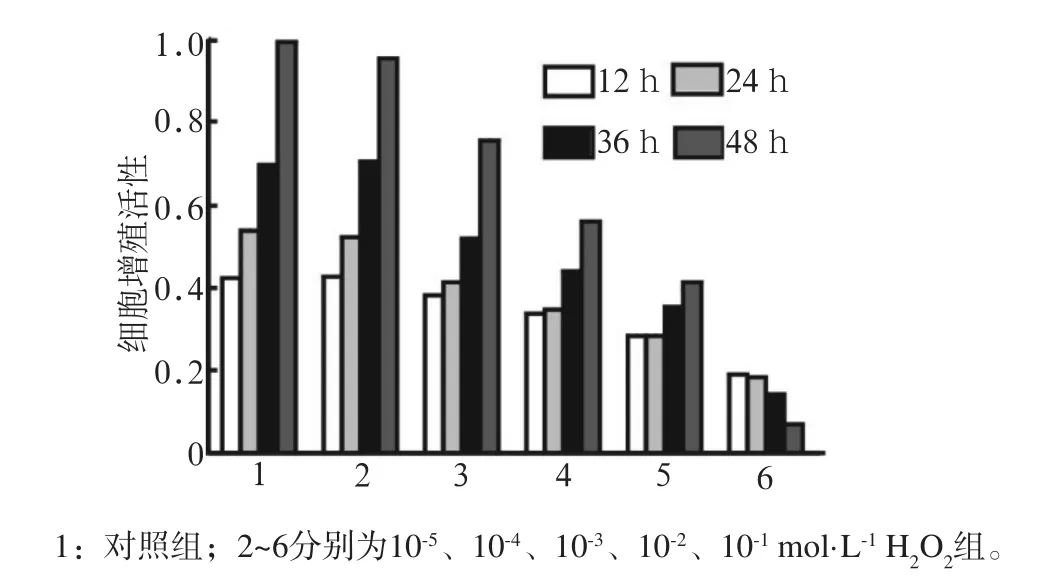
图1 H2O2对MC3T3-E1成骨细胞增殖的影响Fig 1 Effects of H2O2on MC3T3-E1 osteoblasts proliferation
1)MC3T3-E1成骨细胞在不同浓度(10-1、10-2、10-3、10-4、10-5mol·L-1)H2O2下培养12~48 h,细胞增殖活性在10-4mol·L-1H2O2时开始出现抑制(P<0.01),并随着浓度的增加和时间的后移,呈现浓度和时间依赖性(图1);2)MC3T3-E1成骨细胞在不同浓度(10-6、10-7、10-8、10-9、10-10mol·L-1)CGRP的培养液预处理后,10-8mol·L-1CGRP的培养液中细胞增殖活性最高,与只加入10-4mol·L-1H2O2的培养液有统计学差异(P<0.01)(图2),提示10-8mol·L-1CGRP具有明显的抗氧化损伤的作用,对MC3T3-E1成骨细胞的氧化损伤具有一定的保护作用。
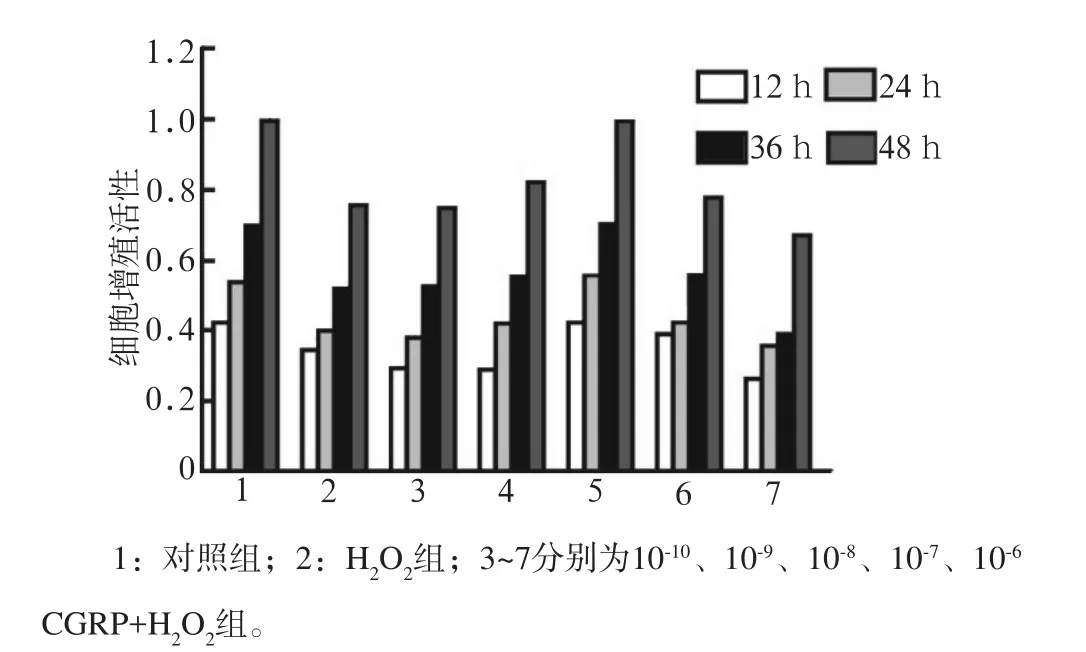
图2 CGRP对MC3T3-E1成骨细胞增殖的影响Fig 2 Effects of CGRP on MC3T3-E1 osteoblasts proliferation
2.2 细胞SOD活性
与对照组相比,CGRP组、CGRP+H2O2组SOD活性升高(P<0.05),H2O2组SOD活性降低(P<0.05)。CGRP+H2O2组SOD活性高于H2O2组(P<0.01)(图3)。提示:CGRP在一定程度上可以降低H2O2对MC3T3-E1成骨细胞SOD活性的抑制作用。
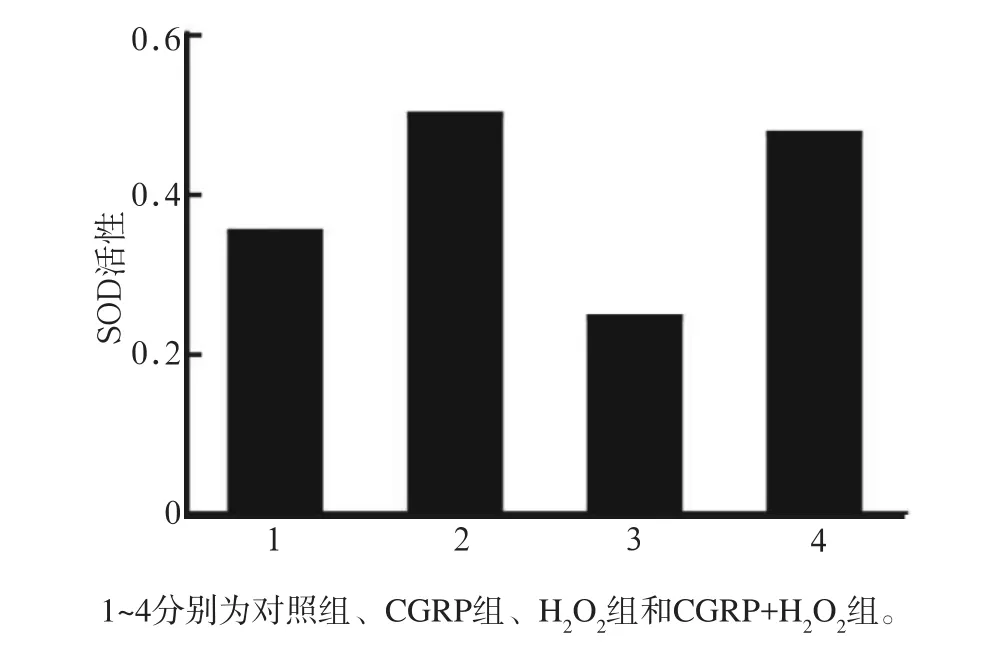
图3 各组成骨细胞SOD活性的影响Fig 3 Osteoblasts activity of SOD of every group
2.3 TNF-α、IL-1β、IL-6的水平
各组的TNF-α、IL-1β、IL-6水平见图4。H2O2组TNF-α、IL-1β、IL-6水平高于对照组(P<0.01);CGRP+H2O2组TNF-α、IL-1β、IL-6水平低于H2O2组(P<0.05)。提示:CGRP的抗炎效应在MC3T3-E1成骨细胞氧化损伤中发挥了一定的保护作用。
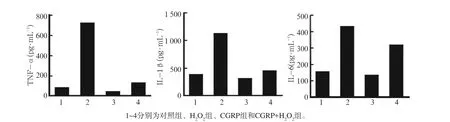
图4 各组TNF-α、IL-1β、IL-6的水平Fig 4 TNF-α、IL-1β、IL-6 level of every group
2.4 ROS含量
CGRP+H2O2组、H2O2组、CGRP组、对照组的ROS含量分别为22.2%、32.6%、3.5%、11.0%。H2O2组ROS含量高于对照组(P<0.01),CGRP+H2O2组ROS含量低于H2O2组(P<0.01)。提示:CGRP具有抗氧化作用,其能抑制H2O2对MC3T3-E1成骨细胞造成的氧化损伤。
3 讨论
骨的生理功能主要依赖骨重建的动态平衡。骨的生理活动取决于成骨细胞的骨形成和破骨细胞的骨吸收之间的平衡,任何影响或者破坏骨重建平衡的因素均会导致骨代谢性疾病。成骨细胞是骨重建的重要细胞,它的质量与数量将决定基质的分泌,影响破骨细胞的功能。氧化应激是由细胞内产生过量的ROS或者是机体的抗氧化防御机制受损所引起,现已证实氧化应激对骨代谢有重要的影响[9-11]。骨折的过程中伴随着ROS的升高,直接会影响到骨修复。此外,H2O2会对MC3T3-E1成骨细胞造成氧化损伤,不仅体现在细胞会失去原有的形态,成骨细胞增殖也会受到明显的抑制。
CGRP作为重要的感觉神经递质,被证明在颌骨创伤修复、骨重建过程中发挥着重要作用[12]。本课题前期研究[5]证实,CGRP在下颌骨骨折愈合中的修复作用,有一部分是通过促进成骨细胞增殖来实现的。笔者推测,在颌骨损伤的修复机制中是否也存在一部分是依赖于CGRP抗氧化损伤的保护机制来实现的呢?本实验结果表明,CGRP可以逆转H2O2对MC3T3-E1成骨细胞增殖的抑制,并筛选了最优势浓度。此外,本研究结果还表明,CGRP能够恢复H2O2对MC3T3-E1成骨细胞SOD活性的抑制。分析CGRP这种发挥抗氧化作用所涉及的机制,笔者认为,可能是因为CGRP增强了MC3T3-E1成骨细胞在H2O2下被抑制的SOD活性,SOD本身能够清除MC3T3-E1成骨细胞因氧化损伤所产生的过量的超氧化物如ROS;ROS量的减少又可以改善MC3T3-E1成骨细胞的细胞活性,从而促进骨折的愈合。
近来,也有研究报道CGRP还具有抗炎的潜能。CGRP能够抑制在内毒素刺激下炎症因子如TNF-α、IL-1β、IL-6等的释放,通过减少炎症反应,抑制成骨细胞凋亡和破骨细胞活化从而促进骨折愈合[8,13],这些结果也是CGRP积极参与骨修复的有力证据。在H2O2作用下,成骨细胞产生的ROS增多,ROS通过刺激破骨细胞释放TNF-α等炎症因子间接影响到成骨细胞的活性与增殖,进而影响骨折的愈合。
不论如何,CGRP可以减轻H2O2对MC3T3-E1成骨细胞SOD的负性影响,改善MC3T3-E1成骨细胞的增殖活性,能对氧化损伤下的MC3T3-E1成骨细胞产生保护作用,这一点是比较明确的。相关的研究还在继续,我们在下一步的实验中将会进一步揭示这种保护作用所涉及的信号分子及机制,以期为CGRP促进颌面部骨创伤的愈合提供新的靶点和依据。
[1] 刘家武, 俞辉明, 邱长乐, 等. 颅颌面骨折及伴发伤同期手术的临床研究[J]. 华西口腔医学杂志, 2014, 32(1):51-53.
Liu JW, Yu HM, Qiu CL, et al. Clinical research on the simultaneous surgical treatment of craniomaxillofacial fracture combined with other injuries[J]. West Chin J Stomatol, 2014, 32(1):51-53.
[2] Yamamoto N, Fukuda K, Matsushita T, et al. Cyclic tensile stretch stimulates the release of reactive oxygen species from osteoblast-like cells[J]. Calcif Tissue Int, 2005, 76(6): 433-438.
[3] Yang YH, Li B, Zheng XF, et al. Oxidative damage to osteoblasts can be alleviated by early autophagy through the endoplasmic reticulum stress pathway—implications for the treatment of osteoporosis[J]. Free Radic Biol Med, 2014,77:10-20.
[4] Smietana MJ, Arruda EM, Faulkner JA, et al. Reactive oxygen species on bone mineral density and mechanics in Cu, Zn superoxide dismutase (Sod1) knockout mice[J]. Biochem Biophys Res Commun, 2010, 403(1):149-153.
[5] Tian G, Zhang G, Tan YH. Calcitonin gene-related peptide stimulates BMP-2 expression and the differentiation of human osteoblast-like cells in vitro[J]. Acta Pharmacol Sin, 2013, 34(11):1467-1474.
[6] Liang W, Zhuo X, Tang Z, et al. Calcitonin gene-related peptide stimulates proliferation and osteogenic differentiation of osteoporotic rat-derived bone mesenchymal stem cells[J]. Mol Cell Biochem, 2015, 402(1/2):101-110.
[7] Wu M, Zhao Z, Han Y. The changes of Proteome in MG-63 cells after induced by calcitonin gene-related peptide[J]. Biochem Biophys Res Commun, 2014, 453(3):648-652.
[8] Mrak E, Guidobono F, Moro G, et al. Calcitonin gene-related peptide (CGRP) inhibits apoptosis in human osteoblasts by β-catenin stabilization[J]. J Cell Physiol, 2010, 225(3):701-708.
[9] Baek KH, Oh KW, Lee WY, et al. Association of oxidative stress with postmenopausal osteoporosis and the effects of hydrogen peroxide on osteoclast formation in human bone marrow cell cultures[J]. Calcif Tissue Int, 2010, 87(3):226-235.
[10] Manolagas SC. From estrogen-centric to aging and oxidative stress: a revised perspective of the pathogenesis of osteoporosis[J]. Endocr Rev, 2010, 31(3):266-300.
[11] Allen RG, Tresini M. Oxidative stress and gene regulation [J]. Free Radic Biol Med, 2000, 28(3):463-499.
[12] Park SH, Sim YB, Kim CH, et al. Role of α-CGRP in the regulation of neurotoxic responses induced by kainic acid in mice[J]. Peptides, 2013, 44:158-162.
[13] Villa I, Mrak E, Rubinacci A, et al. CGRP inhibits osteoprotegerin production in human osteoblast-like cells via cAMP/ PKA-dependent pathway[J]. Am J Physiol Cell Physiol, 2006, 291(3):C529-C537.
(本文采编 李彩)
Protective effect of calcitonin gene-related peptide against oxidative damage in MC3T3-E1 osteoblasts
Guo Junfeng, Zhang Huiyu, Zhang Gang, An Yang, Yang Yang, Wang Fei, Tan Yinghui. (Dept. of Oral and Maxillofacial Surgery, Xinqiao Hospital, The Third Military Medical University, Chongqing 400037, China)
Supported by: The National Natural Science Foundation of China (81371110). Correspondence: Tan Yinghui, E-mail: tanyhxqkq@163.com.
Objective This study aimed to observe the protective effect of calcitonin gene-related peptide (CGRP), as well as its potential mechanism, against oxidative damage in MC3T3-E1 osteoblasts. Methods 1) MC3T3-E1 osteoblasts were treated with different hydrogen peroxide (H2O2) concentrations (10-1, 10-2, 10-3, 10-4, and 10-5mol·L-1) for 12, 24, 36, and 48 h to build an oxidative damage model, to determine cell proliferation activity in each group by using CCK-8 assay, and to determine the optimal modeling concentration. MC3T3-E1 osteoblasts were pretreated for 1 h with different CGRP concentrations (10-6, 10-7, 10-8, 10-9, and 10-10mol·L-1) followed by treatment with H2O2(10-4mol·L-1). After 12, 24, 36, and 48 h, the CGRP expression and activity of osteoblasts were detected using the CCK-8 method to determine the optimal CGRP concentration that provides the best protective effect against oxidative damage. 2) Superoxide dismutase (SOD) activity, reactive oxygen species (ROS) content, and the levels of the inflammatory cytokines tumor necrosis factor (TNF)-α, interleukin (IL)-1β, and IL-6 of the groups treated with CGRP, H2O2, CGRP+H2O2were determined. Results 1) Compared with the control group, treatment with 10-4mol·L-1H2O2significantly started to inhibite the proliferation of osteoblasts (P<0.01) in a dose- and timedependent manner. Compared with 10-4mol·L-1H2O2group, pretreatment with 10-8mol·L-1CGRP significantly increased the proliferation of osteoblasts (P<0.01). 2) Compared with H2O2group, CGRP+H2O2group significantly increased theSOD activity (P<0.01), ROS content significantly decreased (P<0.01), TNF-α, IL-1β, and IL-6 secretion significantly decreased (P<0.05). Conclusion H2O2can cause oxidative damage to MC3T3-E1 osteoblasts, whereas CGRP exerts protective effect against oxidative damage in MC3T3-E1 osteoblasts.
calcitonin gene-related peptide; osteoblasts; oxidative damage; superoxide dismutase; reactive oxygen species
R 782.4
A
10.7518/hxkq.2016.06.007
2016-02-16;
2016-06-10
国家自然科学基金资助(81371110)
郭俊峰,硕士,E-mail:guojfkq@163.com
谭颖徽,教授,博士,E-mail:tanyhxqkq@163.com
10-4mol·L-1H2O2的培养液,对照组为常规培养液,空白组不接种细胞。培养12、24、36、48 h后,CCK-8法检测细胞增殖活性,筛选最佳建模浓度和CGRP对成骨细胞氧化损伤的最佳保护浓度。2)采用含10-4mol·L-1H2O2(H2O2组)、10-8mol·L-1CGRP(CGRP组)的培养液和10-8mol·L-1CGRP+10-4mol·L-1H2O2培养液(CGRP+H2O2组)、常规培养液(对照组)培养成骨细胞,测定超氧化物歧化酶(SOD)的活性、活性氧(ROS)的含量以及炎症因子肿瘤坏死因子(TNF)-α、白细胞介素(IL)-1β、IL-6的水平。结果 1)在10-4mol·L-1H2O2时细胞增殖开始出现抑制(P<0.01),并呈浓度和时间依赖性;10-8mol·L-1CGRP预处理后细胞增殖活性最高,与只加入10-4mol·L-1H2O2有统计学差异(P<0.01)。2)与H2O2组相比,CGRP+H2O2组SOD活性升高(P<0.01),TNF-α、IL-1β、IL-6水平降低(P<0.05),ROS含量降低(P<0.01)。结论 H2O2会对MC3T3-E1成骨细胞造成氧化损伤,CGRP对MC3T3-E1成骨细胞氧化损伤具有保护作用。

