CR1基因多态性对遗忘型轻度认知障碍患者脑功能的影响
程莹,苏凡,赵琼,徐慧,柏峰
(1.东南大学 医学院,江苏 南京 210009;2.东南大学附属中大医院神经内科,江苏 南京 210009)
·论 著·
CR1基因多态性对遗忘型轻度认知障碍患者脑功能的影响
程莹1,苏凡1,赵琼1,徐慧1,柏峰2
(1.东南大学 医学院,江苏 南京 210009;2.东南大学附属中大医院神经内科,江苏 南京 210009)
目的:探讨补体受体1(CR1)基因rs3818361多态性对遗忘型轻度认知障碍(aMCI)患者脑功能的影响模式。方法:以85例aMCI患者及135例健康对照(HC)者为研究对象,根据CR1 rs3818361基因型分型,采用静息态功能磁共振成像技术,结合多维度认知神经心理量表评估,运用低频振幅算法,分析CR1 rs3818361多态性对aMCI患者脑功能的影响。结果:(1) 多维度认知神经心理量表功能评分在aMCI组和HC组间的差异有统计学意义(P<0.05)。(2) 疾病与基因产生交互作用脑区为右侧额上回(rSFG)及前扣带回(AC)。(3) aMCI组GG基因型患者rSFG和AC的低频振幅值与简易精神状态量表评分呈负相关,与连线测试B所耗时间呈正相关(P<0.00238)。结论:CR1 rs3818361基因多态性可影响aMCI患者的总体认知功能和执行功能,且局部脑区活动增强可能是对认知功能障碍的代偿。
遗忘型轻度认知障碍;补体受体1;静息态功能磁共振;低频振幅;右侧额上回
遗忘型轻度认知功能障碍(amnestic mild cognitive impairment,aMCI)患者以记忆功能受损为主要临床表现,其转化为阿尔茨海默病(Alzheimer disease,AD)比例是正常老龄(1%~2%)的10倍[1],是AD发病的高危人群[2]。
目前,补体受体1(complement receptor 1,CR1)已被证实是散发性AD的风险基因。近年来,大量多中心大样本全基因组关联研究(Genome Wide Association Study,GWAS)发现单核苷酸多态性(single nucleotide polymorphism,SNP)与AD的发病风险之间存在密切关联[3],其中CR1 rs3818361在不同种族人群的研究中多次被发现可增加AD的发病风险[4]。以汉族人为研究群体的Meta分析结果[5-6]显示,CR1 rs3818361可增加AD的易感性。CR1作为补体系统的重要成分之一,rs3818361位点变异可显著影响CR1蛋白的长度,形成的长片段CR1异构体因导致淀粉样斑块清除下降,显著增加了AD的易感性[7]。研究发现AD患者的颞叶及海马区域发现补体因子显著升高,CR1通过调节补体C3的降解参与Aβ的清除过程。通过18F Aβ-PET扫描发现,在我国AD患者中CR1 rs4844609与扣带回、额叶、颞叶及顶叶的Aβ沉积显著相关[8]。随访进一步提示携带CR1 rs3818361 G等位基因的AD患者认知功能减退进展迅速[9]。这些研究表明,CR1在AD的发生发展中发挥重要作用。
静息态功能磁共振成像(resting-state functional magnetic resonance imaging,rs-fMRI)是在研究静息状态下,即在闭眼、非睡眠状态,且无系统的思维活动时,检测大脑自发活动所产生的血氧水平依赖(blood oxygenation level dependent,BOLD)信号[10-11]。低频振幅(amplitude of low frequency fluctuation,ALFF)是一种在低频范围内(0.01~0.08Hz),根据BOLD信号高低来测量脑内局部神经元自发活动水平高低的方法,从而可以直接观察脑内不同区域自发活动水平,是目前静息态功能影像研究中重要的计算方法之一[10,12]。近年来遗传影像学研究发现,特定基因型可影响脑功能自发信号[13]。
本研究采用rs-fMRI和临床神经心理评估相结合,通过ALFF算法,结合aMCI患者CR1 rs3818361 A/G多态性,进一步探索CR1 rs3818361基因型对aMCI患者脑功能的影响模式。
1 对象与方法
1.1 研究对象
1.1.1 受试者招募
通过多种媒体发布广告、社区开展宣传义诊等形式招募南京社区居民以及就诊于东南大学附属中大医院神经精神医学科的患者。其中aMCI组85例,正常对照(healthy control,HC)组135例;G为风险等位基因,根据是否为CR1 GG基因纯合子进一步分为4个亚组,分别为aMCI组CR1 rs3818361 GG基因型(40例)、aMCI组CR1 rs3818361 AA/AG基因型(45例)、HC组CR1 rs3818361 GG基因型(55例)和HC组CR1 rs3818361 AA/AG基因型(80例)。所有受试者均为右利手,年龄55~80岁,受教育年龄≥8年以消除年龄和文化程度对认知功能的影响,可配合完成检查。所有受试者均自愿签署知情同意书,同时本研究得到东南大学附属中大医院伦理委员会批准。
1.1.2 纳入与排除标准
1.1.2.1 aMCI纳入标准 (1) 患者主诉或家属证实存在≥6个月的记忆障碍;(2) 有客观记忆功能损害证据;(3) 日常生活能力正常或轻微受损;(4) 无痴呆;(5) 排除精神性与血管性因素所致的认知障碍。
1.1.2.2 正常对照组纳入标准 (1) 无认知障碍主诉;(2) 神经系统检查正常;(3) 核心认知量表:简易精神状态量表(mini-mental state examination,MMSE)评分≥26,Mattis痴呆评定量表(Mattis dementia rating scale,MDRS-2)评分>120,日常生活活动(activities of daily living,ADL)正常,Hachiski缺血量表(Hachiski ischemia scale,HIS)评分≤4,汉密尔顿抑郁量表(Hamilton depression scale,HAMD)评分≤7;(4) 多维度认知神经心理评估量表在年龄与受教育程度匹配的正常范围内。
1.1.2.3 排除标准 (1) 确诊痴呆;(2) 临床卒中或卒中病史:头颅MRI或CT存在病灶直径≥2mm,HIS评分>4分;(3) 头颅损伤、中枢神经系统感染、中毒代谢性疾病、癫痫、帕金森病、多发性硬化、颅内肿瘤、甲减;(4) 有精神疾病史;(5) 有酒精或药物依赖史,服用相关改善认知的药物;(6) 合并严重心、肝、肾、脑及造血系统疾病;(7) 有fMRI扫描禁忌证。
1.2 神经认知功能评估
在神经精神科高年资医师指导下对aMCI患者和正常受试者进行临床资料评估,主要包括:(1) 总体认知功能评价:MMSE、MDRS-2;(2) 日常生活能力受损程度评价:ADL;(3) 排除血管性因素所致的认知障碍:HIS;(4) 记忆功能测评:修订韦氏记忆量表手册、听觉词语学习测验、Rey-Osterrich复杂图形测验回忆部分;(5) 执行功能测评:Stroop色词测验、语义相似性测验、连线测试-B;(6) 语言功能测评:言语流畅性测验、图片命名测验;(7) 注意功能测评:数字广度测验、符号数字转换测试、连线测试-A;(8) 视空间功能测评:画钟测试、复杂图形测验模仿部分。
1.3 磁共振扫描方法
受试者保持清醒状态,嘱其闭眼并尽量放松,避免思考及头动,使用耳塞降低噪音干扰。采用东南大学附属中大医院Simens MAGNETOM Verio 3.0 T磁共振机器扫描,采集受试者静息态fMRI数据。GRE-EPI序列成像参数,重复时间2000 ms,回波时间25 ms,层数36层,层厚4mm,间隔0mm,矩阵64×64,翻转角90°,FOV=240mm×240mm。扫描时间为8 min 6 s。
1.4 数据预处理与统计分析
1.4.1 数据预处理
应用DPARSF软件(http://www.restfmri.net)进行数据预处理,主要包括去除前10个时间点的数据、时间校正、头动校正(将头动平移超过3mm、旋转超过3°的被试除去)、空间标准化、平滑、去线性漂移和滤波。进一步提取0.01~0.08 Hz低频段信号并进行处理,计算脑自发活动信号的功率并开方,得到脑功能ALFF值。
1.4.2 统计分析
运用SPSS 15.0软件,将神经认知功能评分各项转换为标准分数(Z score),分别采用Mann-Whitney U-test和独立样本T检验检测aMCI组与HC组的一般资料和神经认知功能评分(Z score)。使用SPM8软件(http://www.fil.ion.ucl.ac.uk/spm)对aMCI组和HC组受试者ALFF图进行双因素的ANVOA检验,因素一:疾病(aMCI组和HC组);因素二:基因(基因型GG和AA/AG)(Monte Carlosimulation多重比较校正),探讨疾病×基因交互作用区域。同时运用简单线性相关检验进行交互作用区域与认知功能的相关分析(Bonferroni多重检验校正)。P<0.05为差异具有统计学意义。
2 结 果
两组的CR1 rs3818361基因型频率分布符合Hardy-Weinberg平衡定律(aMCI组χ2=0.24,P=0.63>0.05,HC组χ2=1.32,P=0.25>0.05),见表1。
表1 aMCI组和HC组CR1 rs3818361基因型频率表 例

Tab 1 Genotype frequencies of aMCI and HC groups cases
aMCI组与HC组的年龄、性别及受教育年限等人口学资料差异均无统计学意义(P>0.05);有无家族史和APOE不同基因型的人群分布在两组间差异也无统计学意义(P>0.05)。见表2。
表2 aMCI组与HC组人口学资料比较
Tab 2 Demographic data of aMCI and HC groups

人口学资料aMCI组GG(n=40)AA/AG(n=45)P值HC值GG(n=55)AA/AG(n=80)P值P值(女/男)/例19/2120/250.77930/2540/400.6050.390年龄/岁68.35±7.0670.49±7.840.19267.27±6.67168.96±6.6150.1480.214受教育年限/年11.49±3.1012.14±3.320.35112.53±3.42812.11±2.8160.4530.308家族史(无/有)/例31/934/110.83442/1366/140.3830.654APOEε(2/3/4)/例4/21/155/25/150.69315/15/2522/31/270.3650.283
APOEε2:基因型为APOE ε2ε3;APOE ε3:基因型为APOE ε3ε3;APOE ε4:携带APOE ε4等位基因
在aMCI组与HC组神经认知功能评分比较中,除Mattis痴呆评定量表的因子之一结构和复杂图形测验模仿差异无统计学意义(P>0.05),其他包括MMSE、Mattis痴呆评定量表总评分、情节记忆、视空间功能、信息处理速度和执行功能的相关量表评分在两组间差异均有统计学意义(P<0.05),但各量表评分在aMCI组和HC组组内差异均无统计学意义(P>0.05)。见表3。



神经认知功能评分aMCI组GG(n=40)AA/AG(n=45)P值HC值GG(n=55)AA/AG(n=80)P值P值MMSE-0.03±1.060.02±0.960.815-0.03±1.140.02±0.900.7464.445×10-9aMattis痴呆评定量表-0.02±1.000.02±1.010.856-0.07±0.970.04±1.030.5332.353×10-13a 注意-0.22±1.090.19±0.880.0560.07±1.04-0.05±0.970.4761.058×10-2b 启动与保持-0.09±1.030.08±0.970.418-0.07±1.090.05±0.940.5253.385×10-7a 概念形成0.19±0.89-0.17±1.070.097-0.03±0.840.02±1.100.7611.224×10-3b 结构0.08±1.00-0.07±1.010.514-0.01±0.890.01±1.080.9281.819×10-1 记忆0.01±0.96-0.01±1.040.932-0.08±0.980.06±1.010.4294.753×10-11a情节记忆(20min回忆部分) 听觉词语学习测验-0.09±1.070.08±0.940.455-0.07±0.960.05±1.030.4776.660×10-53a 逻辑记忆测验-0.17±0.990.15±0.990.150.04±1.08-0.03±0.950.723.464×10-15a 复杂图形测验0.02±0.98-0.01±1.020.889-0.13±1.010.09±0.990.2014.303×10-11a视空间功能 画钟测试0.03±0.96-0.03±1.040.7960.03±1.00-0.02±1.000.7381.300×10-5a 复杂图形测验模仿-0.12±0.110.1±1.370.318-0.07±1.100.05±0.930.4844.768×10-1信息处理速度 数字字符替代测验-0.01±0.950.01±1.050.9160.19±1.04-0.13±0.950.0682.364×10-10a 连线测试-A-0.21±0.630.19±1.210.062-0.06±1.080.04±0.950.5748.000×10-5a Stroop色词测验A-0.07±0.740.06±1.190.535-0.04±0.950.03±1.040.7247.251×10-8a Stroop色词测验B-0.03±0.790.02±1.170.814-0.05±0.830.03±1.100.6291.500×10-5a执行功能 词语流畅性测验-0.11±0.990.1±1.010.353-0.06±1.080.04±0.950.5969.934×10-13a 数字广度测验(逆序)-0.1±0.930.09±1.060.3810.17±1.03-0.12±0.970.1042.418×10-3b 连线测试-B-0.07±0.970.06±1.040.5370.00±1.160.00±0.880.9775.881×10-7a Stroop色词测验C0.14±0.92-0.12±1.060.228-0.14±0.820.09±1.100.1939.961×10-7a 语义相似性0.18±0.85-0.16±1.100.122-0.04±1.000.03±1.010.6671.191×10-7a
注:由独立样本T检验计算得P值。a.代表两组间差异存在显著统计学意义(P<0.001); b.代表两组间差异存在统计学意义(P<0.05)
aMCI组与HC组ALFF图像经过双因素ANOVA检验后,aMCI疾病主效应脑区包括右侧颞下回、右侧额叶及楔前叶等;CR1 rs3818361基因主效应脑区包括左侧颞上回、岛叶、右侧枕叶、舌回、右侧额下回等。疾病(aMCI)与基因(CR1 rs3818361)产生交互作用脑区,为右侧额上回及前扣带回。见表4,图1~3。
表4 疾病×基因ANOVA检验结果
Tab 4 Descriptions of brain regions for disease×genotype ANOVA
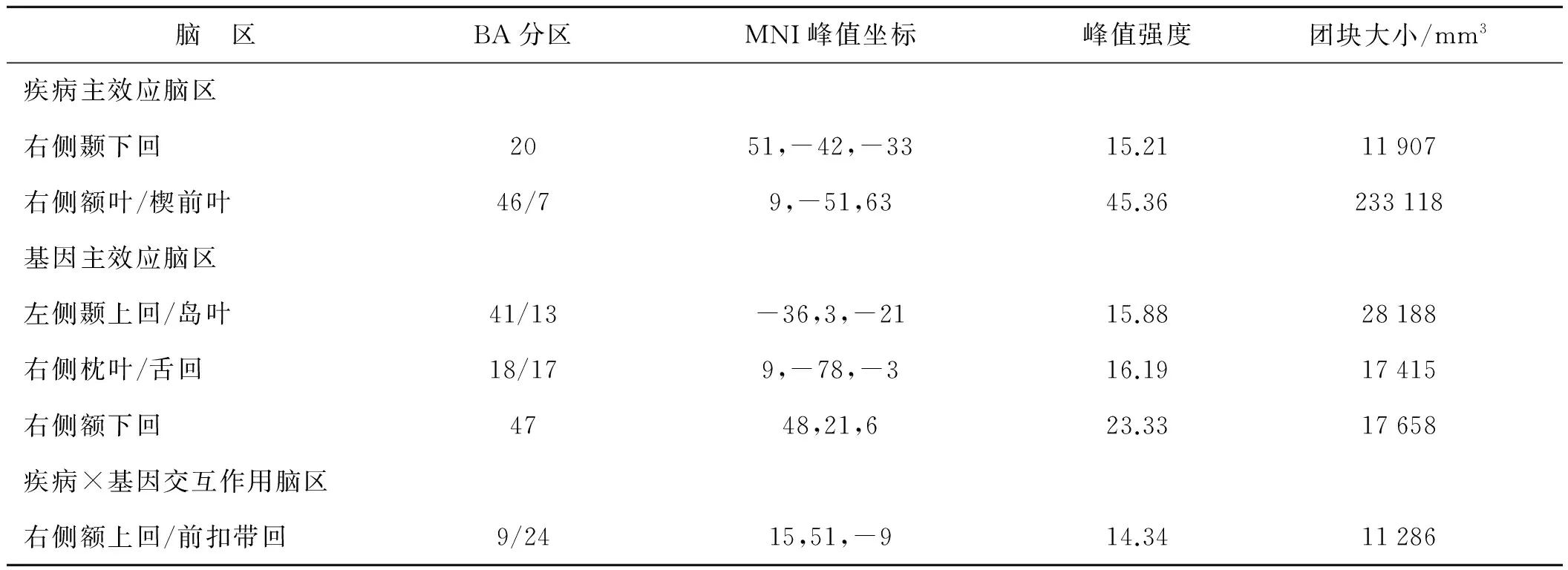
脑 区BA分区MNI峰值坐标峰值强度团块大小/mm3疾病主效应脑区右侧颞下回2051,-42,-3315.2111907右侧额叶/楔前叶46/79,-51,6345.36233118基因主效应脑区左侧颞上回/岛叶41/13-36,3,-2115.8828188右侧枕叶/舌回18/179,-78,-316.1917415右侧额下回4748,21,623.3317658疾病×基因交互作用脑区右侧额上回/前扣带回9/2415,51,-914.3411286

图1 aMCI疾病主效应脑区(包括右侧颞下回、右侧额叶及楔前叶等,P<0.05,Monte Carlo simulation多重比较校正)
Fig 1 Brain regions for main effect of disease(including right inferior temporal gyrus,right frontal lobe and precuneus.P<0.05,Monte Carlo simulation multiple comparison correction)
运用简单线性相关检验进行疾病×基因交互作用区域(右侧额上回及前扣带回)ALFF值与认知功能的相关分析,并进行Bonferroni多重检验校正。aMCI组GG基因型患者ALFF值与MMSE呈负相关,与连线测试B所耗时间呈正相关,且相关性具有统计学意义(P<0.00238)。在aMCI组AA/AG基因型患者及正常对照组中无显著相关,见图4。
3 讨 论
本研究以“基因—脑—行为”网络为思路框架,首次利用CR1基因SNP rs3818361多态性,结合静息态fMRI技术和多维度认知神经心理量表评估,探讨了CR1 rs3818361基因多态性对aMCI患者静息态脑功能的影响。主要有以下3点发现:(1) aMCI组较HC组出现多维度认知功能损害,但是各量表评分在aMCI组基因型亚组内差异无统计学意义。(2) aMCI患者的疾病与基因(CR1 rs3818361)产生交互作用脑区为右侧额上回及前扣带回。(3) aMCI组GG基因型患者的疾病与基因交互作用脑区(右侧额上回及前扣带回)ALFF值与其认知功能损害程度具有相关性。

图2 CR1 rs3818361基因主效应脑区(包括左侧颞上回、岛叶、右侧枕叶、舌回及右侧额下回等,P<0.05,Monte Carlo simulation多重比较校正)
Fig 2 Brain regions for main effect of genotype(including left superior temporal gyrus,insular lobe,right occipital lobe,lingual gyrus and right inferior frontal gyrus.P<0.05,Monte Carlo simulation multiple comparison correction)
Sweet等[14]通过对心血管健康认知中心的非痴呆患者研究,发现CR1基因与认知功能减退加快有关。Schmidt等[9]在长期临床随访中发现,携带CR1 rs3818361 G等位基因的AD患者MMSE评分以每年3分的速度减退,CR1 rs3818361多态性与散发性AD患者的认知功能损害显著相关。Pedraza等[15]发现在黑种人AD患者中CR1 rs3818361 A等位基因携带者的逻辑记忆瞬时回忆测验得分显著偏低。在本研究中aMCI组患者的情节记忆、视空间功能、信息处理速度以及执行功能广泛受损,但在aMCI组基因型亚组内未见显著差异,可能与aMCI组患者仍处于早期的认知功能损害阶段有关。

图3 疾病(aMCI)×基因(CR1 rs3818361)交互作用脑区(位于右侧额上回及前扣带回,P<0.05,Monte Carlo simulation多重比较校正)
Fig 3 Brain regions for disease×genotype interaction(including right superior frontal gyrus and anterior cingulate.P<0.05,Monte Carlo simulation multiple comparison correction)

图4 aMCI组GG基因型患者的疾病×基因交互作用脑区的(右侧额上回及前扣带回)ALFF值与MMSE得分(r=-0.569,P=0.000359)及连线测试B所耗时间(r=0.502,P=0.002135)具有相关性
Fig 4 In aMCI with the CR1 rs3818361 GG genotype,ALFF value of brain regions for disease×genotype interaction(right superior frontal gyrus and anterior cingulate) is associated with MMSE scores(r=-0.569,P=0.000359) and seconds consumed in TMT-B(r=0.502,P=0.002135)
在AD及aMCI相关的神经影像学研究中,右侧额上回多次被发现信号异常。在执行工作记忆任务时,AD及aMCI患者的右侧额上回、两侧颞中回及前扣带回可见显著的激活信号,且AD患者的激活脑区信号低于aMCI患者[16]。近年来在rs-fMRI研究中,GSK 3β rs334558的T等位基因携带者可见右侧额上回ALFF值显著降低[17]。携带TOMM40 rs157581 G等位基因的aMCI患者左侧额下回及岛叶的ALFF值显著降低,右侧后扣带回、舌回及距状沟的ALFF值显著升高,且不同脑区ALFF值变化模式与aMCI患者认知功能损害相一致[18]。合并有抑郁症状的AD患者的右侧额上、中及下回的局部一致性信号降低[19]。在单光子发射计算机断层扫描(single photon emission computed tomography,SPECT)研究中发现额叶功能评定量表得分低的AD患者左侧额中回、右侧额上回的灌注显著下降[20]。本研究中疾病(aMCI)与基因(CR1 rs3818361 GG基因型)可产生交互作用脑区,位于右侧额上回及前扣带回。Zhu等[8]的研究结果显示,CR1基因突变与扣带回、额叶、颞叶及顶叶的Aβ沉积显著相关。右侧额上回主要负责注意、精神运动速度、执行功能及视空间等,这与aMCI组GG基因型患者的右侧额上回及前扣带回的ALFF值与其执行功能呈负相关是一致的,局部脑区活动增强可能是对认知功能障碍的代偿。
散发性AD受多基因复杂效应的影响,aMCI患者静息态功能磁共振的局部脑功能可能还受CR1基因其它SNP位点多态性、AD其它危险基因(如GSK3β[17]、TOMM40[18]、CLU[21]等)及基因间的相互作用的影响;此外,由于样本量较少,AA和AG基因型无法分亚组,从而没能进一步探讨A等位基因的量效关系。然而,本研究首次探讨了CR1 rs3818361基因多态性对aMCI患者静息态脑功能的影响,发现CR1 rs3818361基因多态性可影响aMCI患者的执行功能,且局部脑区活动增强可能是对认知功能障碍的代偿。
[1] PETERSEN R C,SMITH G E,WARING S C,et al.Mild cognitive impairment:clinical characterization and outcome[J].Arch Neurol,1999,56(3):303-308.
[2] PETERSON R C,ROBERTS R O,KNOPMAN D S,et al.Mild cognitive impairment:ten years later[J].Arch Neurol,2009,66(12):1447-1455.
[3] LAMBERT J C,HEATH S,EVEN G,et al.Genome-wide association study identifies variants at CLU and CR1 associated with Alzheimer’s disease[J].Nat Genet,2009,41(10):1094-1099.
[4] CARRASQUILLO M M,BELBIN O,HUNTER T A,et al.Replication of CLU,CR1,and PICALM associations with alzheimer disease[J].Arch Neurol,2010,67(8):961-964.
[5] LI Y,SONG D,JIANG Y,et al.CR1 rs3818361 polymorphism contributes to Alzheimer’s disease susceptibility in Chinese population[J/OL].Mol Neurobiol,2015(2015-07-21).doi:10.1007/s12035-015-9343-7.
[6] LUO J,LI S,QIN X,et al.Meta-analysis of the association between CR1 polymorphisms and risk of late-onset Alzheimer’s disease[J].Neurosci Lett,2014,578(2014):165-170.
[7] MAHMOUDI R,KISSERLI A,NOVELLA J L,et al.Alzheimer’s disease is associated with low density of the long CR1 isoform[J].Neurobiol Aging,2015,36(4):1766.e5-1766.e12.
[8] ZHU X C,WANG H F,JIANG T,et al.Effect of CR1 genetic variants on cerebrospinal fluid and neuroimaging biomarkers in healthy,mild cognitive impairment and Alzheimer’s disease cohorts[J].Mol Neurobiol,2016(2016-01-07).doi:10.1007/s12035-015-9638-8.
[9] SCHMIDT C,WOLFF M,AHSEN N,et al.CR1 is potentially associated with rate of decline in sporadic Alzheimer’s disease[J].J Clin Neurosci,2014,21(10):1705-1708.
[10] BISWAL B,YETKIN F Z,HAUGHTON V M,et al.Functional connectivity in the motor cortex of resting human brain using echo-planar MRI[J].Magn Reson Med,1995,34(4):537-541.
[11] KIVINIEMI V,JAUHIAINEN J,TERVONEN O,et al.Slow vasomotor fluctuation in fMRI of anesthetized child brain[J].Magn Reson Med,2000,44(3):373-378.
[12] ZANG Y F,HE Y,ZHU C Z,et al.Altered baseline brain activity in children with ADHD revealed by resting-state functional MRI[J].Brain Dev,2007,29(2):83-91.
[13] WESTLYE E T,LUNDERVOLD A,ROOTWELT H,et al.Increased hippocampal default mode synchronization during rest in middle-aged and elderly APOE epsilon4 carriers: relationships with memory performance[J].J Neurosci,2011,31(21):7775-7783.
[14] SWEET R A,SELTMAN H,EMANUEL J E,et al.Effect of Alzheimer’s disease risk genes on trajectories of cognitive function in the Cardiovascular Health Study[J].Am J Psychiatry,2012,169(9):954-962.
[15] PEDRAZA O,ALLEN M,JENNETTE K,et al.Evaluation of memory endophenotypes for association with CLU,CR1,and PICALM variants in black and white subjects[J].Alzheimers Dement,2014,10(2):205-213.
[16] YETKIN F Z,ROSENBERG R N,WEINER M F,et al.FMRI of working memory in patients with mild cognitive impairment and probable Alzheimer’s disease[J].Eur Radiol,2006,16(1):193-206.
[17] BAI F,SHI Y,YUAN Y,et al.Association of a GSK-3beta polymorphism with brain resting-state function in amnestic-type mild cognitive impairment[J].J Alzheimers Dis,2012,32(2):387-396.
[18] LIU X,BAI F,YUE C,et al.The association between TOMM40 gene polymorphism and spontaneous brain activity in amnestic mild cognitive impairment[J].J Neurol,2014,261(8):1499-1507.
[19] GUO Z,LIU X,JIA X,et al.Regional coherence changes in Alzheimer’s disease patients with depressive symptoms: a resting-state functional MRI study[J].J Alzheimers Dis,2015,48(3):603-611.
[20] OSHIMA E,TERADA S,SATO S,et al.Frontal assessment battery and brain perfusion imaging in Alzheimer’s disease[J].Int Psychogeriatr,2012,24(6):994-1001.
[21] HAROLD D,ABRAHAM R,HOLLINGWORTH P,et al.Genome-wide association study identifies variants at CLU and PICALM associated with Alzheimer’s disease[J].Nat Genet,2009,41(10):1088-1093.
Association of CR1 polymorphism with brain function in amnestic-type mild cognitive impairment
CHENG Ying1,SU Fan1,ZHAO Qiong1,XU Hui1,BAI Feng2
(1.MedicalSchool,SoutheastUniversity,Nanjing210009,China;2.DepartmentofNeurology,ZhongdaHospital,SoutheastUniversity,Nanjing210009,China)
Objective: Exploring association of complement receptor 1(CR1) rs3818361 polymorphism with brain resting-state function in amnestic-type mild cognitive impairment(aMCI) patients.Methods: In this study,85 aMCI patients and 135 healthy controls(HC) grouped by their CR1 rs3818361 genotypes underwent resting-state functional magnetic resonance and a clinical interview which focused on neurological and mental status.Gene-brain-behavior relationships were examined to determine the effect of the risk variant on regional brain activity in these subjects.Results: (1) The difference of neurological and mental status between aMCI and HC subjects was significant(P<0.05).(2) Regions of “groups×genotypes” ANOVA interaction were located in right superior frontal gyrus(rSFG) and anterior cingulate(AC).(3) Negative relation of regional brain activity of rSFG and AC with mini-mental state examination(MMSE), positive relation of regional brain activity of rSFG and AC with seconds consumed in trail making test B(TMT-B) were observed in GG carriers of aMCI patients(P<0.002 38).Conclusion: Our findings are the first to show that CR1 rs3818361 polymorphism has a significant influence on overall cognitive function impairment and executive function,which may be compensated by regional brain hyperactivity.
amnestic-type mild cognitive impairment; complement receptor 1;rs-fMRI; amplitude of low frequency fluctuation;right superior frontal gyrus
2016-03-21
2016-05-29
中央高校基本科研业务费专项资金资助项目(SJZZ15_0028);江苏省普通高校研究生科研创新计划资助项目(SJZZ15_0028)
程莹(1991-),女,江苏盐城人,在读硕士研究生。E-mail:yingcheng515@outlook.com
柏峰 E-mail:baifeng515@126.com
程莹,苏凡,赵琼,等.CR1基因多态性对遗忘型轻度认知障碍患者脑功能的影响.东南大学学报:医学版,2016,35(5):692-699.
R749.1
A
1671-6264(2016)05-0692-08
10.3969/j.issn.1671-6264.2016.05.010

