联合肝素结合蛋白和降钙素原诊断脓毒症及分级的临床应用价值
陈永健 王毓
联合肝素结合蛋白和降钙素原诊断脓毒症及分级的临床应用价值
陈永健 王毓
目的 探讨肝素结合蛋白(HBP)、降钙素原(PCT)、C反应蛋白(CRP)、WBC在脓毒症诊断及分级中的临床应用价值。方法 选取脓毒症患者22例、重症脓毒症患者25例、脓毒症休克患者20例、局部感染患者21例以及健康体检者29例,测定各组患者血清HBP、PCT、CRP及全血WBC水平,并对部分病例进行HBP与PCT的跟综监测。结果 (1)脓毒症组HBP、PCT、CRP水平明显高于局部感染和健康对照组,差异均有统计学意义(均P<0.05);脓毒症、重症脓毒症、脓毒性休克组中PCT水平分别为2.3(0.6~5.1)、6.2(2.8~16.1)、15.3(4.4~49.0)ng/ml,各组间差异有统计学意义(P<0.05);脓毒症组HBP为283.1(168.9~397.6)ng/ml,高于脓毒性休克组的111.6(62.6~250.5)ng/ml(P<0.05)。CRP在脓毒症分级中无统计学意义(P>0.05)。(2)跟综监测显示,在脓毒症的进展过程中,PCT水平进行性升高,而HBP水平却下降。(3)HBP与PCT联合诊断脓毒症的效能高于单一指标的应用。结论 在HBP、PCT是脓毒症诊断的有效标志物,HBP和PCT联合检测有助于脓毒症的诊断,PCT进行性升高而HBP下降提示疾病预后不良。
脓毒症 降钙素原 肝素结合蛋白 C反应蛋白
1 对象和方法
1.1 对象 选取2014年7月至2015年3月在本院住院期间临床诊断为脓毒症患者22例,男11例,女11例,年龄23~87岁,中位年龄62.4岁;重度脓毒症患者25例,男13例,女12例,年龄21~90岁,中位年龄61.5岁;脓毒性休克患者20例,男11例,女9例,年龄25~90岁,中位年龄67岁。所有患者诊断均符合相关标准[2]。选取同期局部感染(非脓毒血症,包括肺炎、支气管炎、胆道感染等)患者21例,男11例,女10例,年龄32~93岁,中位年龄67.3岁;另选取本院同期健康体检者29例作为健康对照组,男15例,女14例,年龄26~80岁,中位年龄60.8岁。各组间性别、年龄比较差异均无统计学意义(均P>0.05)。
1.2 方法 对诊断为脓毒症、重症脓毒症、脓毒性休克或局部感染的患者,入组时空腹抽取2ml抗凝全血作WBC检测,3ml不抗凝血液离心后其血清作PCT和CRP检测,剩余血清-20℃保存以便统一作HBP检测。健康对照组体检时行WBC、CRP、PCT及HBP检测。由于PCT和HBP的连续监测对患者有较重的经济压力,故笔者只对4例脓毒症患者进行PCT和HBP的连续监测(1~2d/次),观察在疾病发展的不同阶段两个指标的动态变化。CRP检测采用速率散射免疫比浊法(试剂及仪器购自美国贝克曼公司),PCT检测用电化学发光分析法(试剂及仪器购自瑞士罗氏公司),WBC采用日本SYMEX血细胞计数仪测定(试剂及仪器购自日本希森美康公司),HBP检测用酶联免疫吸附试验法(试剂及仪器购自中国中翰盛泰公司)。
1.3 统计学处理 应用SPSS 11.5统计软件,非正态分布的计量资料以四分位数[M(Q)]表示,组间比较采用非参数检验(K-W检验),联合诊断采用多因素回归分析建立logistic回归模型,诊断效能采用ROC曲线下面积表示。
2 结果
2.1 各组HBP、PCT、CRP及WBC水平的比较 脓毒症组HBP、PCT、CRP水平明显高于局部感染和健康对照组,差异均有统计学意义(均P<0.05);PCT水平随着脓毒症加重而明显升高,各组间差异有统计学意义(P<0.05)。脓毒性休克组HBP低于脓毒症组(均P<0.05),脓毒症组HBP水平与重症脓毒症组比较无统计学差异(P>0.05)。CRP在脓毒症分级中无统计学意义(P>0.05)。WBC在局部感染与脓毒症各分级间均无统计学差异(均P>0.05),详见表1。
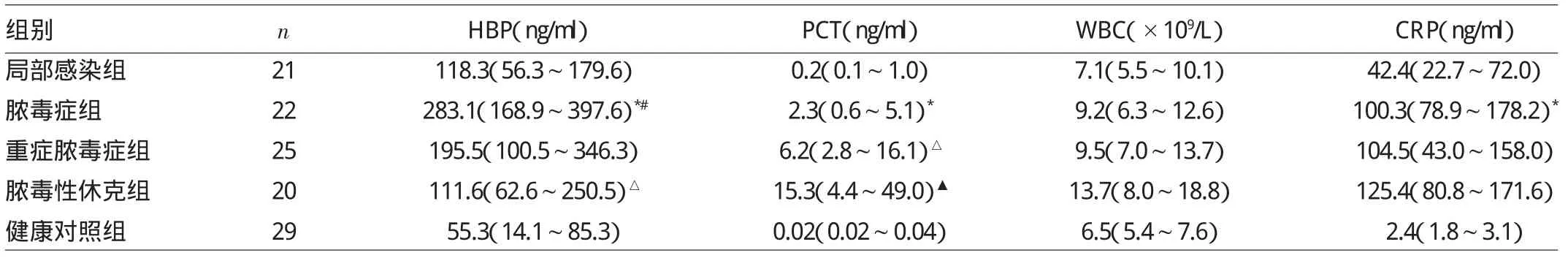
表1各组HBP、PCT、CRP及WBC水平的比较
2.2 4例患者HBP、PCT连续监测结果 病例1和病例2为感染引起的脓毒性休克患者,对这2例脓毒症患者进行HBP与PCT的连续监测,发现随着患者病情的加重,PCT水平逐渐升高,而HBP水平在脓毒症期达到高峰,此后随着疾病的加重反而下降(见图1a、b)。病例3为多发伤、肺炎引起的脓毒性休克病例,此例患者在脓毒性休克期,HBP水平随着PCT水平进行性升高反而下降(见图1c)。以上3例患者最终均病重出院。病例4为肺部感染引起的重症脓毒症,随着感染的有效控制,PCT和HBP均进行性下降,最终治愈出院(见图1d)。

图1 4例患者HBP PCT连续监测结果(为使HBP与PCT在同一纵坐标轴上更好体现,HBP与PCT采用不同的浓度单位;a:病例1;b:病例2;c:病例3;d:病例4)
2.3 多指标联合诊断脓毒症的效能 经多因素回归分析,建立HBP、PCT的联合诊断模型方程为Logit(p)= 0.014HBP+1.097PCT-5.34,通过联合指标诊断脓毒症的效能明显高于HBP与PCT单指标的诊断效能,ROC曲线下面积分别是0.955、0.869和0.905,详见表2及图2。
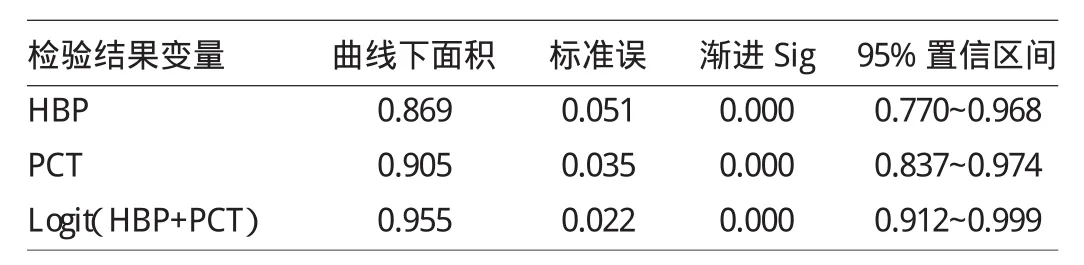
表2 HBP、PCT及两者联合回归后诊断脓毒症的ROC曲线下面积置信区间

图2 脓毒症患者HBP、PCT等指标诊断的ROC曲线
3 讨论
目前,重症监护病房中约40%的患者患有脓毒症,重症脓毒症病死率高达36%[4],提高脓毒症的早期诊断并进行有效干预对降低病死率,改善预后甚为重要。虽然,脓毒症是感染引起的全身炎症反应综合征,但其发生、发展并不依赖细菌和细菌毒素的持续存在,病原菌培养阳性率不高且耗时[5]。所以增加感染相关的有效生物学标志有助于临床对脓毒症的诊断,监测与疗效评价。
PCT主要是甲状腺C细胞产生的116个氨基酸的降钙素前体蛋白(分子量13kD),1993年,Assicot等[6]首次将它作为脓毒症的诊断指标进行报道。此后,PCT作为脓毒症的标志物得到广泛的研究。Sakran等[7]证实脓毒症时,PCT水平比非感染时的全身炎症反应综合征高,Karlsson等[8]认为PCT水平与脓毒症的严重程度相关。本研究结果证实脓毒症组PCT水平明显高于局部感染组和健康对照组,随着脓毒症病情的加重,PCT水平也逐步升高。
HBP是存在于中性粒细胞嗜苯胺蓝颗粒和分泌颗粒中含222个氨基酸的蛋白质分子,HBP最初受到关注是因其灭菌活性,后来发现其还是一种趋化物质,可激活单核/巨噬细胞释放TNF-α、INF-γ等炎性介质而成为研究的焦点[9]。Linder等[10]发现,脓毒症患者血浆HBP水平明显高于非脓毒症对照组,HBP水平与脓毒症的严重程度和死亡风险相关。但也有学者认为HBP不能区分重症监护病房中的脓毒症及重症脓毒症病例,指出HBP可能只适合急诊科诊断脓毒症的一个生物标志物[11]。本研究发现,脓毒症患者的HBP水平最高,脓毒性休克组HBP水平却低于脓毒症组,跟综监测也显示:随着脓毒症病情的加重,HBP反而下降。因此,笔者推断:随着病情加重,至脓毒性休克期,虽然WBC总体并无明显改变,但由于机体功能下降以及大剂量药物等应用可能引起WBC内合成HBP减少,同时由于WBC内贮存HBP的大量消耗,使得HBP测值下降。在脓毒症的不良进展过程中,监测到PCT进行性升高而HBP下降;在脓毒症的治愈过程中,监测到PCT与HBP均进行性下降。所以,PCT与HBP的这种分离现象提示预后不良。
在脓毒症的发生、发展中,中性粒细胞和单核细胞可以向炎症部位迁徙,能识别和吞噬各种病原体,所以WBC是脓毒症发生、发展中的重要因素,但在实际应用中发现,WBC不能有效区分局部感染、脓毒症及脓毒症的分级,虽然统计给出的无统计学差异,可能与样本例数不足有关,但也反应了WBC在脓毒症患者及局部感染患者之间的区别不大这一事实。CRP是一个非特异性的急性时相蛋白,能区分病毒性或细菌性感染而广泛应用,在脓毒症的诊断应用上,Orati等[12]认为CRP水平能区分腹部感染引起的脓毒症和肺部感染引起的脓毒症;在重症监护病房中,高水平CRP是器官衰竭和死亡的危险因子。但本研究表明,虽然CRP水平在各级脓毒症患者中均高于局部感染患者,但在脓毒症分级诊断中无意义,与一些研究认为CRP水平不能反映脓毒症患者的生存这一结论相符[13-14]。
脓毒症发生机制复杂,临床表现差异巨大,单一的生物学标志物在脓毒症的诊断和监测上存在缺陷,如Mauro等[15]证实PCT水平与脓毒症高度相关,但不能作为独立的诊断指标来进行鉴别诊断。于是,标志物的联合检测为提高脓毒症的诊断和监测提供了另一种思路。Gibot等[16]将PCT、可溶性触发受体1和中性粒细胞表面高亲和力免疫球蛋白Fc段受体I(CD64)联合检测,发现对脓毒症的诊断及预后方面优于3者独立时的价值。笔者联合检测HBP与PCT,发现联合后对脓毒症的诊断效率高于单指标效率,同时对HBP和PCT的连续监测发现,PCT的进行性增加和HBP的进行性下降可能是疾病不良预后的表现。
[1] Binkowska A M,Michalak G,SlotwińskiR,et al.Current views on the mechanisms of immune responses to trauma and infection[J]. Cent Eur J Immunol,2015,40(2):206-216.
[2] Dellinger R P,Levy M M,Rhodes A,et al.Surviving sepsis campaign:international guidelines for management of severe sepsis and septic shock:2012[J].Crit Care Med,2013,41(2):580-637.
[3] Pierrakos C,Vincent J L.Sepsis biomarkers:a review[J].Crit Care, 2010,14(1):R15.
[4] Moore L J,Mckinley B A,Turner K L,et al.The epidemiology of sepsis in generalsurgery patients[J].J Trauma,2011,70(3):672-680.
[5] 王静,李熙鸿.脓毒症发病机制的研究进展[J].实用儿科临床杂志, 2012,27(10):786-789.
[6] Assicot M,Gendrel D,Carsin H,et al.High serum procalcitonin concentrations in patients with sepsis and infection[J].Lancet, 1993,341(8844):515-518.
[7] Sakran J V,Miehetti C P,Sheridan M J,et al.The utility of procalcitonin in critically illtrauma patients[J].J Trauma Acute Care Surg, 2012,73(2):413-418.
[8] Karlsson S,Heikkinen M,Pettila V,et al.Predictive value of procalcitonin decrease in patients with severe sepsis:a prospective observationalstudy[J].Crit Care,2010,14(6):R205.
[9] Schou M,Djurup R,Norris K,et al.Identifying the functionalpart of heparin-binding protein (HBP)as a monocyte stimulator and the novelrole ofmonocytes as HBP producers[J].Innate Immun,2011, 17(1):60-69.
[10]Linder A,kesson P,Inghammar M,et al.Elevated plasma levels of heparin-binding protein in intensive care unit patients with severe sepsis and septic shock[J].Crit Care,2012,16(3):R90.
[11] Llewelyn M J,Berger M,Gregory M,et al.Sepsis biomarkers in unselected patients on admission to intensive or high-dependency care[J].Crit Care,2013,17(2):R60.
[12] Orati J A,Almeida P,Santos V,et al.Serum C-reactive protein concentrations in early abdominaland pulmonary sepsis[J].Rev Bras Ter Intensiva,2013,25(1):6-11.
[13] Miguel-Bayarri V,Casanoves-Laparra E B,Pallás-Beneyto L, et al.Prognostic value of the biomarkers procalcitonin,interleukin-6 and C-reactive protein in severe sepsis[J].Med Intensiva,2012,36(8):556-562.
[14] Tschaikowsky K,Hedwig-Geissing M,Braun G G,et al.Predictive value of procalcitonin,interleukin-6,and C-reactive protein for survivalin postoperative patients with severe sepsis[J].J Crit Care,2011,26(1):54-64.
[15] Mauro M V,Cavalcanti P,Perugini D,et al.Diagnostic utility of LightCycler SeptiFast and procalcitonin assays in the diagnosis of bloodstream infection in immunocompromised patients[J]. Diagn MicrobiolInfect Dis,2012,73(4):308-311.
(本文编辑:严玮雯)
Combined detection of heparin-binding protein and procalcitonin in diagnosis and classifications of sepsis
CHEN Yongjian,WANG Yu.Department of Clinical Laboratory,Zhenjiang Provincial People's Hospital,Hangzhou 310014,China
【 Abstract】 Objective To assess the detection of heparin-binding protein(HBP),procalcitonin(PCT),white blood cell (WBC),C-reactive protein(CRP)in diagnosis and classification of sepsis. Methods Sixty seven septic patients,including 22 with sepsis,25 with severe sepsis and 20 with septic shock,21 patients with local infection,29 healthy controls were enrolled in the study.Levels of HBP,PCT,WBC and CRP were determined. Results The levels of HBP,PCT and CRP in the sepsis group were significantly higher than those in local infection group or control group(P<0.05).The PCT levels in the groups of sepsis, severe sepsis,and septic shock were 2.3(0.6-5.1)ng/ml,6.2(2.8-16.1)ng/mL and 15.3(4.4-49.0)ng/mL,respectively(P<0.05), HBP level in sepsis group was higher[283.1(168.9-397.6)ng/mL]than that in septic shock group[111.6(62.6-250.5)ng/mL](P<0.05),however there was no significant difference in CRP levels among 3 sepsis groups(P>0.05).The effectiveness of HBP and PCT combination in the diagnosis of sepsis was higher than that of single index. Conclusion HBP and PCT are effective markers for diagnosis and classification of sepsis,the combination of two indexes would increase the diagnostic effectiveness.
Sepsis Procalcitonin Heparin-binding protein CRP
310014 杭州,浙江省人民医院检验中心
陈永健,E-mail:lab_cyj@126.com
2015-12-15)
脓毒症是一种由各种感染因素诱发,多种炎症反应物质介导的全身炎症反应综合征。脓毒症病情凶险,病死率高[1],其诊断与分级常以美国胸科医师学会和危重病学会的标准[2]分为脓毒症、重症脓毒症及脓毒性休克,该标准主要通过体温、心率、呼吸频率等体征和部分实验室指标[如WBC、C反应蛋白(CRP)]来进行诊断,缺乏特异性,因此临床上迫切需要能够快速、准确,灵敏地诊断、监测脓毒症的生物学指标。近年来文献报道的脓毒症标志物高达178种[3],如何在众多的标志物中进行选择和有效组合非常重要。除外较早报道的CRP和WBC,降钙素原(PCT)和肝素结合蛋白(HBP)是近年来报道诊断脓毒症的生物学指标,为此笔者对脓毒症患者进行WBC、CRP、PCT及HBP检测,探讨它们单独或联合检测在诊断脓毒症及其分级上的意义,现将结果报道如下。

